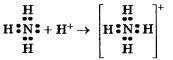|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Аммиак
Прежде всего рассмотрим строение молекулы аммиака NН3. Как вы уже знаете, на внешнем энергетическом уровне атомы азота содержат пять электронов, из которых три электрона неспаренные. Именно они и участвуют в формировании трех ковалентных связей с тремя атомами водорода при образовании молекулы аммиака NH3:
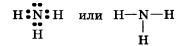
Три общие электронные пары смещены в сторону более электроотрицательного атома азота, а так как молекула аммиака имеет форму треугольной пирамиды (рис. 28), то в результате смещения электронных пар возникает диполь, т. е. система с двумя полюсами.
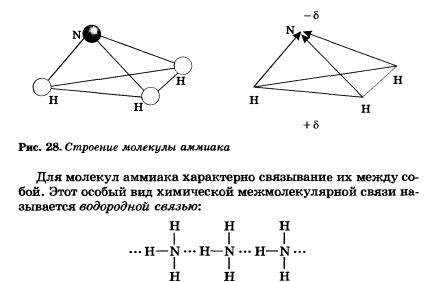
Водородная связь — это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов (фтора, кислорода, азота), имеющих иеподеленные электронные пары другой молекулы.
Это очень слабая связь — примерно в 15—20 раз слабее ковалентной. Благодаря ей некоторые низкомолекулярные вещества (т. е. имеющие небольшую молекулярную массу) образуют ассоциаты, что приводит к повышению температур плавления и кипения веществ. Водородная связь образуется между молекулами воды, спиртов, фтороводорода.
Очень важную роль играет водородная связь в молекулах важнейших для живых существ соединений — белков и нуклеиновых кислот.
Аммиак — бесцветный газ с резким запахом, почти в два раза легче воздуха. Аммиак нельзя вдыхать продолжительное время, так как он ядовит. Этот газ легко сжижается при обычном давлении и температуре -33,4 °С, а при испарении жидкого аммиака из окружающей среды поглощается много тепла, поэтому аммиак применяется в холодильных установках.
Аммиак очень хорошо растворим в воде: при 20 °С в 1 объеме ее растворяется около 710 объемов аммиака (рис. 29). Концентрированный водный раствор аммиака (25%-ный по массе) называется водным аммиаком, или аммиачной водой, а используемый в медицине раствор аммиака известен под названием нашатырный спирт. Тот нашатырный спирт, который имеется в вашей домашней аптечке, содержит 10% аммиака.
Если к раствору аммиака прилить несколько капель фенолфталеина, то он окрасится в малиновый цвет, т. е. покажет щелочную среду:
NH3 + Н20 <-> NH3 • Н20 -> NН4 + ОН-
Наличием гидроксид-ионов ОН- и объясняется щелочная реакция водных растворов аммиака. Если окрашенный фенолфталеином раствор аммиака подогреть, то окраска исчезнет (почему?).
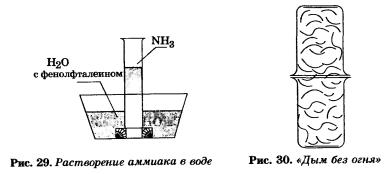
Аммиак взаимодействует с кислотами, образуя соли аммония. Это взаимодействие наглядно наблюдается в следующем опыте: если стеклянную палочку или стакан, смоченные раствором аммиака, поднести к другой палочке или стакану, смоченным раствором соляной кислоты, то появится густой белый дым (рис. 30). Вот и верь после этого поговорке, что дыма без огня не бывает:
NH3 + НСl = NH4Сl
Хлорид аммония
И водный раствор аммиака, и соли аммония содержат особый ион — катион аммония NH4, играющий роль катиона металла. Он получается в результате того, что атом азота имеет свободную (неподеленную) электронную пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул кислот или воды:
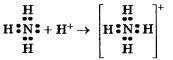
Такой механизм образования ковалентной связи, которая возникает не в результате обобществления непарных электронов, а благодаря свободной электронной паре, имеющейся у одного из атомов, называется донорно-акцепторным.
В данном случае донором этой свободной электронной пары служит атом азота в аммиаке, а акцептором — катион водорода кислоты или воды.
Еще одно химическое свойство аммиака вы сможете сами прогнозировать, если обратите внимание на степень окисления в нем атомов азота, а именно -3. Конечно же аммиак — сильнейший восстановитель, т. е. его атомы азота могут только отдавать электроны, но не принимать их. Так, аммиак способен окисляться или до свободного азота (без участия катализатора):
4NН3 + 302 = 2N2 + 6Н20
или до оксида азота(II) (в присутствии катализатора):
4NН3 + 502 = 4N + 6Н20
Как производят аммиак в промышленности, вы уже знаете — синтезом из азота и водорода. В лаборатории аммиак получают действием гашеной извести Са(ОН)2 на соли аммония, чаще всего на хлорид аммония:
Са(ОН)2 + 2NН4С1 = СаСl2 + 2NН3 + 2Н20
Газ собирают в перевернутый кверху дном сосуд, а распознают или по запаху, или по посинению влажной красной лакмусовой бумажки, или по появлению белого дыма при внесенной палочке, смоченной соляной кислотой. Аммиак и его соли широко используются в промышленности и технике, в сельском хозяйстве, быту. Основные области их применения показаны на рисунке 31.
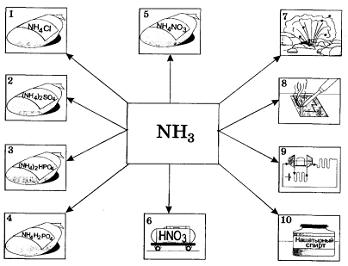
Рис. 31. Применение аммиака и солей аммония:
1—5 — производство минеральных удобрений; 6 — производство азотной кислоты; 7 — получение взрывчатых веществ; 8 — для паяния; 9 — в холодильных установках; 10 — в медицине и быту (нашатырный спирт)
1. Строение молекулы аммиака.
2. Водородная связь.
3. Свойства аммиака: взаимодействие с водой, кислотами и кислородом.
4. Донорно-акцепторный механизм образования иона аммония.
5. Получение, собирание и распознавание аммиака.
Какие свойства аммиака лежат в основе его применения в медицине, холодильных установках?
В чем особенности водородной связи? Какое значение она имеет в химии и биологии?
Является ли донорно-акцепторная связь особым видом химической связи? Почему?
Какую степень окисления имеет азот в хлориде аммония? в нитрате аммония?
Определите коэффициенты в следующей схеме химической реакции, используя метод электронного баланса: СuО + NH3 -> N2 + Сu + Н2O
Почему аммиак проявляет только восстановительные свойства?
новые знания по химии, фишки для учеников 9 класса, конспекты уроков
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|