|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Ацетилен. Молекулярні, електронні та структурні формули, фiзичні властивості. Хімічні властивості вуглеводнів
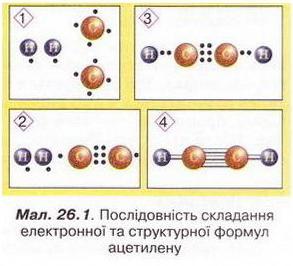
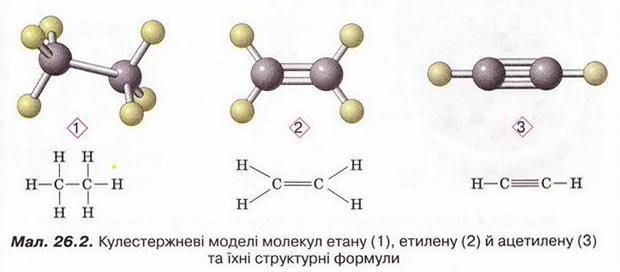
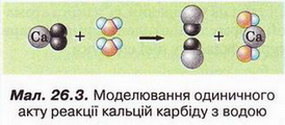
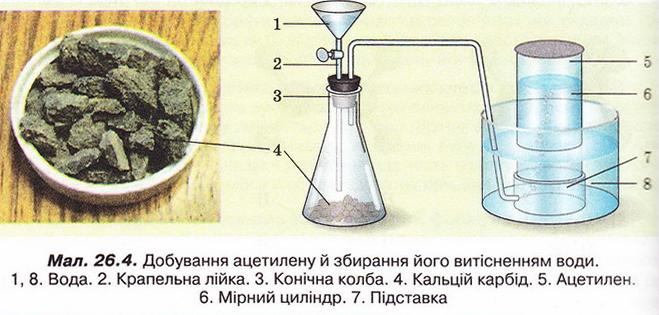
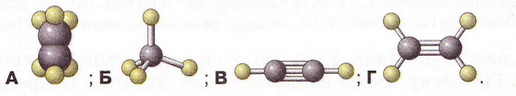
Ацетилен Після опрацювання § 26 ви зможете: складати й пояснювати молекулярну, електронну та структурну формули ацетилену; збирати моделі молекули ацетилену; характеризувати склад структуру фізичні та хімічні властивості ацетилену; ілюструвати властивості ацетилену рівняннями хімічних реакцій; розрізняти за функціональними ознаками ненасичені вуглеводні й порівнювати їх з ненасиченим; розв'язувати розрахункові задачі вивчених типів на прикладі ацетилену; визначати ацетилен дослідним шляхом; наводити приклади застосування ацетилену; встановлювати причинно-наслідкові зв'язки між складом, будовою, властивостями та біологічними функціями і застосуванням ацетилену; обґрунтовувати застосування ацетилену його властивостями. На шляху до успіху пригадаємо з вивчених курсів хімії і біології: які речовини називають вуглеводнями; яка валентність Карбону в органічних сполуках; як і чому змінюється характер горіння вуглеводнів залежно від вмісту Карбону; чому лужні метали, галогени, луги не трапляються в природі; чим зумовлена низька реакційна здатність метану та його гомологів; як пов'язані кількість, маса й об'єм газуватих речовин; що таке каталізатор. • Молекулярна, електронна та структурна формули ацетилену (у сучасній науковій хімічній літературі вам траплятиметься й інша назва цієї сполуки - етин) - знакові моделі, за допомогою яких унаочнюють склад і будову молекули цієї органічної сполуки. Розгляньмо їх докладніше. За молекулярною формулою ацетилену С2Н2 легко встановити його приналежність до вуглеводнів. Ви, звичайно, пам'ятаєте, що Гідроген — одновалентний хімічний елемент, а Карбон в органічних сполуках чотирьохвалентний. Як сполучити між собою два атоми Карбону і два атоми Гідрогену, аби не порушити цієї умови? Єдиний правильний варіант зображено на малюнку 26.1. На зовнішньому енергетичному рівні атома Гідрогену міститься один неспарений електрон. Атом Карбону в збудженому стані містить на зовнішньому енергетичному рівні чотири неспарених електрони. На утворення потрійного зв'язку між атомами Карбону кожен з них витрачає по три електрони. Ще по одному неспареному електрону атоми Карбону можуть використати на утворення зв'язків з атомами Гідрогену. Замінивши в електронній формулі ацетилену спільні пари електронів рисочками, дістанемо структурну формулу цієї сполуки. Завдання Назвіть науковця, який встановив наявність потрійного зв'язку в молекулі ацетилену (за потреби зверніться до § 24). Отже, у молекулі ацетилену атоми Карбону сполучені потрійним зв'язком, це унеможливлює обертання навколо нього. Кути між зв'язками в молекулі ацетилену становлять 180°, вона має лінійну будову (мал. 26.2,3). Ви, напевно, звернули увагу, що молекулу ацетилену можна уявити як молекулу етану, в якій від кожного атома Карбону відщеплено по два атоми Гідрогену. Внаслідок цього між атомами Карбону виникає потрійний зв'язок. Завдання Порівняйте за малюнком 26.2 склад і будову ацетилену, етилену та етану. Поясніть, чи можна вважати їх гомологами. Пригадайте, що таке гомологічна різниця і складіть молекулярні формули двох наступних за ацетиленом членів гомологічного ряду. • Фізичні властивості ацетилену зумовлені складом і будовою його молекул, сили притягання між якими дуже слабкі. Ацетилен - безбарвний газ, без запаху. Він зріджується й твердне за низьких температур. Ацетилен розчиняється у воді ліпше за метан і етилен. Аби пересвідчитися в цьому, пропустімо ацетилен через воду в пробірці впродовж кількох хвилин. Після цього нагріймо воду до кипіння й до отвору пробірки піднесімо запалену скіпку. Ацетилен, який виділиться з розчину, спалахне. Завдання Визначте, легший чи важчий ацетилен за повітря. Поясніть, чи доцільно збирати ацетилен у посудину: а) витісненням повітря; б) витісненням води. • Добування ацетилену можливо здійснити в кілька способів. Приміром, 1836 р. Едмунд Деві синтезував ацетилен з вуглецю й водню. 1860 р. його відкриття повторив Марселін Бертло, який і назвав добутий газ ацетиленом. У промисловості ацетилен добувають розкладанням метану: 2CH4 Завдання За малюнком 26.3 запишіть рівняння реакцій між кальцій карбідом і водою. За малюнком 26.4 опишіть, як добувають і збирають ацетилен у лабораторії. Цю реакцію здавна використовують у карбідних ліхтарях. У верхньому резервуарі ліхтаря міститься вода, у нижньому - кальцій карбід Ацетилен, який утворюється внаслідок їхньої взаємодії, трубкою надходить до пальника, де його й підпалюють. З реакції горіння (повного окиснення) почнімо вивчати хімічні влаcтивості ацетилену. УВАГА!!! Суміш ацетилену з киснем вибухонебезпечна. Перш ніж підпалити ацетилен, перевірмо його на відсутність домішок кисню. Для цього занурмо газовідвідну трубку в розчин мийного засобу. Коли склянка наповниться піною, заберімо газовідвідну трубку й підпалімо піну в склянці довгою палаючою скіпкою. Якщо спалах супроводжується різким звуком, це свідчить про наявність домішок кисню в газі, що надходить з приладу. У такому разі підпалювати газ біля газовідвідної трубки вкрай небезпечно. Зачекаймо, доки струмінь ацетилену не витіснить повітря з приладу для добування газу, й повторімо перевірку на чистоту. Алетилен горить кіптявим полум'ям: С2Н2 + 02 → С02 + Н20; ΔН < 0 Завдання Перетворіть схему реакції горіння ацетилену на хімічне рівняння. Ацетилен - досить реакційноздатна сполука. Характерними для нього, так само як для етилену, є реакції приєднання за місцем кратного зв'язку. Продуктом приєднання до молекули ацетилену однієї молекули водню є етилен: Завдання Запишіть рівняння реакцій: а) приєднання до молекули ацетилену однієї молекули брому; б) приєднання до молекули ацетилену двох молекул брому. Назви подано для ознайомлення, а не для запам'ятовування • Ацетилен у природі майже не трапляється. Причина полягає у високій реакційній здатності цієї сполуки. За допомогою космічного зонда Гюйгенс астрономі виявили ацетилен на поверхні Титана супутника Сатурна. Науковці вважають що на Титані падають ацетиленові дощі внаслідок розпаду молекул метану під дією УФ-випромінювання. • Застосування ацетилену ґрунтується насамперед на використанні теплової світлової енергії, яка виділяється під час його горіння. Ацетиленові (карбідні) ліхтарі використовували у велосипедних і автомобільних фарах, на маяках тощо. Спелеологи та дигери й досі застосовують карбідні ліхтарі під час мандрівок підземними лабіринтами. За допомогою високотемпературного ацетиленокисневого полум'я зварюють і ріжуть метали. Однак слід пам'ятати, що повітряно-ацетиленові суміші з об'ємною часткою ацетилену 3-82 % вибухонебезпечні, тож потребують особливо обережного поводження. Приміром, шведський інженер Нільс Густав Дален (мал. 26.5) 1912 р. одержав Нобелівську премію за винаходження пристрою для автоматичного запалювання і гасіння ацетиленового полум'я у джерелах світла маяків і буїв. Однак під час досліджень унаслідок вис газу втратив зір. Також ацетилен використовують як сировину для синтезу різноманітних органічних речовин. Стисло про головне Молекулярна формула ацетилену С2Н2, електронна - Ацетилен - безбарвний газ, без запаху, трохи легший за повітря, зріджується й твердне за низьких температур. Він малорозчинний у воді та інших полярних розчинниках, натомість добре розчиняється у вуглеводнях. У промисловості ацетилен добувають термічним розкладанням метану та дією води на кальцій карбід: CaC2 + 2H2O → Ca(OH)2 + C2H2↑ Ацетилен у природі майже не трапляється. Причина полягає у високій реакційній здатності цієї сполуки. Застосування ацетилену ґрунтується насамперед на використанні теплової і світлової енергії, яка виділяється під час його горіння. За допомогою високотемпературного ацетиленокисневого полум'я зварюють і ріжуть метали. Також ацетилен використовують як сировину для синтезу різноманітних органічних речовин. Повітряно-ацетиленові суміші з об'ємною часткою ацетилену 3-82 % вибухонебезпечні, тож потребують особливо обережного поводження. Застосуйте свої знання й уміння 1. Виберіть модель молекули ацетилену: 2. Виберіть зображення хімічного зв'язку між атомами Карбону в молекулі ацетилену: 3. Виберіть загальну кількість спільних електронних пар у молекулі ацетилену: 4. Виберіть загальну кількість ковалентних зв'язків у молекулі ацетилену: 5. На занятті хімічного гуртка учні 9 класу добули ацетилен, перевірили його на чистоту й зібрали в мірний циліндр. Циліндр з ацетиленом вони закріпили у штативі так, щоб отвір циліндра був занурений у посудину з підфарбованою холодною водою. Зібрану установку дев'ятикласники залишили до наступного заняття. Спрогнозуйте зміни, які відбулися з рівнем води в циліндрі. 6. Виберіть суму коефіцієнтів у лівій частині рівняння реакції горіння ацетилену: 7. Запишіть рівняння хімічних реакцій, про які йдеться в уривку з літературного твору. До яких типів належать ці реакції? 8. Виберіть реактиви, за допомогою яких виявляють етилен: 9. Внаслідок спалювання ацетилену утворився вуглекислий газ об'ємом 8 л. Обчисліть об'єм кисню, який витратився в цій реакції (об'єми газуватих реагентів і продуктів реакції виміряно за однакових умов). 10. Обчисліть об'єм водню, який витратиться на повне гідрування ацетилену об'ємом 20 л (об'єми газуватих реагентів і продуктів реакції виміряно за однакових умов).
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: