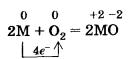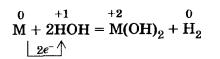|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Бериллий, магний и щелочноземельные металлы
Строение и свойства атомов. Бериллий Ве, магний Мё и щелочноземельные металлы кальций Са, стронций Sr, барий Ва и радий Ra — элементы главной подгруппы II группы Периодической системы. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2. С ростом порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий — радиоактивный элемент, содержание его в природе невелико.
Бериллий, магний и щелочноземельные металлы — простые вещества. Легкие серебристо-белые металлы, стронций имеет золотистый оттенок. Он значительно тверже щелочных металлов, барий же по мягкости напоминает свинец.
На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов. Для записи уравнений реакций также воспользуемся общим обозначением металлов М:
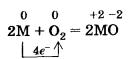
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в темных помещениях. В настоящее время используют электрическую вспышку.
Бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды, нитриды:

Из всех металлов главной подгруппы II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных условиях:
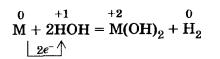
Подобно алюминию магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов.
Такие способы получения металлов по аналогии с алюминотермией называют магниетермией и кальциетермией.
Магний и кальций применяют для производства редких металлов и легких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
Соединения бериллия, магния и щелочноземельных металлов. В природе щелочноземельные металлы, как и щелочные металлы, находятся только в форме соединений вследствие своей высокой химической активности.
Оксиды МО — твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур.
Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер.
Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно взаимодействуют с ней:
МО + Н20 = М(ОН)2
Оксиды получают обжигом карбонатов: МС03 = МО + С02
В технике оксид кальция СаО называют негашеной известью, а МgО — жженой магнезией. Оба этих оксида используют в производстве строительных материалов.
Гидроксиды щелочноземельных металлов относятся к щелочам. Их растворимость в воде растет от Са(ОН)2 к Ва(ОН)2. Эти гидроксиды получают взаимодействием соответствующего оксида с водой.
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести (рис. 11), а образующийся Са(ОН)2 — гашеной известью:
СаО + Н20 = Са(ОН)2
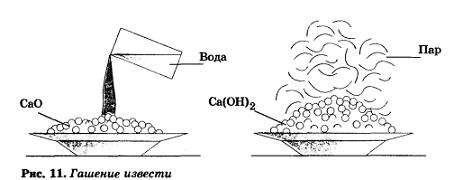
Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Са(ОН)2 в воде — известковым молоком. Гашеная известь широко используется в строительстве. Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами. Галогениды (фториды, хлориды, бромиды и иодиды) этих металлов — белые кристаллические вещества, большинство из них растворимо в воде.
Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов уменьшается от ВеSO4 к ВaSO4. Карбонаты этих металлов малорастворимы или совсем нерастворимы в воде.
Сульфиды щелочноземельных металлов, содержащие в малых количествах примеси тяжелых металлов, после предварительного освещения начинают светиться различным цветом — красным, оранжевым, голубым, зеленым. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов и т. п.
Рассмотрим наиболее важные соединения элементов главной подгруппы II группы периодической системы.
СаС03 — карбонат кальция — одно из самых распространенных на Земле соединений. Вам хорошо известны такие содержащие его минералы, как мел, мрамор, известняк.
Самый важный из этих минералов — известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомните знаменитые одесские катакомбы — бывшие каменоломни, в которых добывали камень для строительства города), во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и др.
Известковой щебенкой укрепляют дороги, а порошком — уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных (рис. 12). Один из примеров его использования вы хорошо знаете — это школьные мелки, зубные пасты. Мел применяют в производстве бумаги и резины, а также для побелки.
Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Из него создавал свои прекрасные творения Микеланджело (рис. 13), стены всемирно известного индийского мавзолея-Тадж-Махал выложены из мрамора, им же облицованы многие станции московского метро.

МgС03 — карбонат магния, необходим в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т. е. не содержащей соединения металла, в шлак.
СаS04 — сульфат кальция, встречается в природе в виде минерала гипса СаSO4 • 2Н20, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения неподвижных гипсовых повязок, для получения слепков.
Для этого применяют полуводный гипс 2СаS04 • Н20 — алебастр, который при взаимодействии с водой образует двувод-ный гипс:
2СаS04 • Н20 + Н20 = 2СаS04 • 2Н2О
Эта реакция идет с выделением теплоты.
— сульфат магния, известный под названием горькая, или английская, соль, используемый в медицине в качестве слабительного средства. Содержится в морской воде и придает ей горький вкус.
ВаS04 — сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике («баритовая каша») при заболеваниях желу-дочно-кишечного тракта.
Са3(РO4)2 — фосфат кальция, входит в состав фосфоритов (горная порода) и апатитов (минерал), а также в состав костей и зубов. В организме взрослого человека содержится более 1 кг кальция в виде соединения Са3(Р04)2.
Кальций имеет важное значение для живых организмов, это материал для постройки костных скелетов. Он играет существенную роль и в самих процессах жизнедеятельности: ионы кальция регулируют работу сердца, участвуют в процессах свертывания крови.
На долю кальция приходится более 1,5% от массы тела человека, 98% кальция содержится в костях скелета. Однако кальций не только делает наши кости крепче, но и способствует работе нервной системы. При недостатке кальция руки теряют способность удерживать предметы, мышцы начинают судорожно сокращаться, кровь перестает свертываться, нервная система приходит в негодность, а сердечная мышца отказывается нормально работать.
Чтобы не было проблем со здоровьем из-за нехватки кальция, здоровый человек должен получать в день 1,5 г его. Необходимо при этом помнить, что организм усваивает кальций только в присутствии жиров: на каждые 0,06 г кальция нужно съесть 1 г жира. Наибольшее количество кальция содержится в сыре, твороге, петрушке, салате и других продуктах.
Магний также является необходимым биоэлементом, играя роль стимулятора обмена веществ, содержится в печени, костях, крови, нервной ткани и мозге. Магния в человеческом организме намного меньше, чем кальция, — всего около 40 г. Однако ему отведена очень важная роль: ионы магния «сшивают» молекулы белка в клубочки, обеспечивая тем самым присущую для живых организмов структуру этих молекул. Магний входит в состав хлорофилла, а следовательно, участвует в процессах фотосинтеза. Без хлорофилла не было бы жизни, а без магния — хлорофилла, ведь в нем содержится 2% этого элемента.
Открытие магния и кальция. Магний был впервые получен Г. Дэви в 1808 г. из белой магнезии — минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу.
Полученный Г. Дэви металл был загрязнен примесями, а чистый магний получил француз А. Бюсси в 1829 г.
Кальций был впервые получен также Г. Дэви в 1808 г., название элемента происходит от лат. слова кальс, что означает «известь, мягкий камень».
1. Строение атомов бериллия и магния, щелочноземельных металлов.
2. Химические свойства бериллия, магния и щелочноземельных металлов: образование оксидов, хлоридов, сульфидов, нитридов, гидридов и гидроксидов.
3. Магииетермия и кальциетермия.
4. Оксиды кальция — негашеная известь и магния — жженая магнезия.
5. Гидроксиды кальция — гашеная известь, известковая вода, известковое молоко — и других щелочноземельных металлов.
6. Соли: карбонаты кальция — мел, мрамор, известняк — и магния; сульфаты — гипс, горькая соль, «баритовая каша»; фосфаты.
Массовая доля костей человека составляет 20% от общей массы организма. На долю фосфата кальция, входящего в состав костей, приходится также 20% от массы костей. Зная свой вес, рассчитайте, сколько килограммов фосфата кальция содержится в вашем организме. Сколько килограммов кальция содержится в нем?
Вспомните из курса анатомии, что такое гемофилия. Почему гемофиликам вводят при кровотечениях раствор хлорида кальция?
Какое количество вещества гашеной извести может быть получено из 2 т известняка, содержащего 25% примесей?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
МСO3 -> МО -> М(ОН)2 -> МSO3 -> МS04
Какие металлы главной подгруппы II группы могут быть использованы для этих превращений, а какие — нет? Почему?
Напишите уравнения реакций для осуществления превращений:
Уравнение последней реакции запишите также в ионной форме.
Используя в качестве примера приведенное в предыдущем параграфе сочинение ученицы, напишите свое сочинение о химическом веществе или процессе, посвященное химии щелочноземельных металлов.
Почему для гипсовых повязок используется не гипс СаSO4 • 2Н20, а алебастр 2СаS04 • Н20? Какой процесс происходит при наложении такой повязки?
Подберите условия для смещения химического равновесия системы
СаС03 -> СаО + С02 - Q
вправо, руководствуясь принципом Ле Шателье.
методические рекомендации по химии, дополнения к школьной программе по химии 9 класса, шпаргалки и конспекты уроков
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|