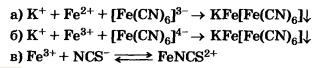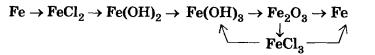|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Железо
Строение и свойства атомов. Железо Fе — элемент побочной подгруппы VIII группы и 4-го периода Периодической системы Д. И. Менделеева. Атомы Ре устроены несколько отлично от атомов элементов главных подгрупп. Как и положено элементу 4-го периода, атомы железа имеют четыре энергетических уровня, но заполняется у них не последний, а предпоследний, третий от ядра, уровень. На последнем же уровне атомы железа содержат два электрона. На предпоследнем уровне, который может вместить 18 электронов, у атома железа находятся 14 электронов. Следовательно, распределение электронов по уровням в атомах железа таково: 2е-; 8е- ; 14е- ; 2е-.
Подобно всем металлам, атомы железа проявляют восстановительные свойства, отдавая при химических взаимодействиях не только два электрона с последнего уровня и приобретая степень окисления +2, но и электрон с предпоследнего уровня, при этом степень окисления атома повышается до +3.
Железо — простое вещество. Это серебристо-белый блестящий металл с температурой плавления 1539 °С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают технически чистое и химически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02—0,04% углерода, а кислорода, серы, азота и фосфора — еще меньше. Химически чистое железо содержит менее 0,01% примесей. Из технически чистого железа сделаны, например, канцелярские скрепки и кнопки. Такое железо легко корродирует, в то время как химически чистое железо почти не подвергается коррозии.
Первые образцы железа, попавшего в руки человека, очевидно, были метеоритного происхождения. О знакомстве человека в древности с железом космического происхождения говорит факт наличия у жителей Гренландии, не имевших никакого понятия о железной руде, изделий из железа. Алхимики обозначали железо в виде копья и щита — характерных атрибутов бога войны Марса.
В настоящее время железо — это основа современной техники и сельскохозяйственного машиностроения, транспорта и средств связи, космических кораблей и вообще всей современной цивилизации. Большинство изделий, начиная от швейной иглы и кончая космическими аппаратами, не может быть изготовлено без применения железа.
Переходя к описанию химических свойств железа, повторим, что оно может проявлять степени окисления +2 и +3, соответственно железо дает два ряда соединений. Число электронов, которое атом железа отдает при химических взаимодействиях, зависит от окислительной способности реагирующих с ним веществ. Например, с галогенами железо образует галоге-ниды, в которых оно имеет степень окисления +3:

В соответствии с положением железа в электрохимическом ряду напряжений оно может вытеснять металлы, стоящие правее него, из водных растворов их солей.
В разбавленных соляной и серной кислотах железо растворяется, т. е. окисляется ионами водорода.
Растворяется железо и в разбавленной азотной кислоте, при этом образуются нитрат железа(III), вода и продукт восстановления азотной кислоты — N2, N0 или NH2(NН4NO3) в зависимости от концентрации кислоты.
Соединения железа. По распространенности в земной коре железо занимает четвертое место среди всех элементов (после кислорода, кремния и алюминия).
В природе железо образует ряд минералов. Это магнитный железняк (магнетит) Fе3O4, красный железняк (гематит) Fе203, бурый железняк (лимонит) 2Fе2O3 * ЗН20.
Все они используются в черной металлургии для производства чугуна и стали.
Еще одно природное соединение железа — железный, или серный, колчедан (пирит) FеS2, не служит железной рудой для получения металла, но применяется для производства серной кислоты.
Как уже было сказано выше, для железа характерны два ряда соединений: соединения железа(II) и железа(III).
Оксид железа(II) FеО и соответствующий ему гидроксид железа(II) Fе(ОН)2 получают косвенно, в частности по следующей цепи превращений:
Fе -> FеС12 -> Fе(ОН)2 -> FеО
Оба соединения имеют ярко выраженные основные свойства.
Катионы железа(II) Fе2+ легко окисляются кислородом воздуха или другими окислителями до катионов железа(III) Fе3+. Поэтому белый осадок гидроксида железа(II) Fе(ОН)2 на воздухе сначала приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа(III):
4Fе(0Н)2 + 2Н20 + 02 = 4Fе(0Н)3
Оксид железа(ІІІ) Fе2O3 и соответствующий ему гидроксид железа(ІІІ) Fе(ОН)3 также получают косвенно.
Из солей железа наибольшее техническое значение имеют сульфаты и хлориды.
Кристаллогидрат сульфата железа FеSО • 7Н20, известный под названием железный купорос, применяют для борьбы с вредителями растений, для приготовления минеральных красок и в других целях.
Хлорид железа(ІІІ) FеСl3 используют в качестве протравы при крашении тканей.
Сульфат железа(ІІІ) Fе2(SO4)3 • 9Н20 применяется при очистке воды и в других целях.
Для распознавания соединений железа(II) и (IIІ) проводят качественные реакции на ионы Fе2+ и Fе3+. Качественной реакцией на ионы Fе2+ служит реакция солей железа с соединением, называемым красной кровяной солью. Соединения такого типа вам еще не знакомы. Это особая группа солей, которые называются комплексным и1. С ними вы будете знакомиться в старших классах. Пока же вам нужно усвоить, как диссоциируют такие соли:
К3[Fе(СN6)] = ЗК+ + [Fе(СN)6] 3-
Реактивом на ионы Fе3+ является другое комплексное соединение — желтая кровяная соль — К4[Fе(СN)6], которая в растворе диссоциирует аналогично.
Если к растворам, содержащим ионы Fе2+ или Fе3+, прилить, соответственно, растворы красной кровяной соли (реактив на Fе2+) и желтой кровяной соли (реактив на Fе3+), то в обоих случаях выпадает одинаковый синий осадок. Для обнаружения ионов Fе3+ еще используют взаимодействие солей железа(III) с роданидом калия КNCS или аммония NH4NCS. При этом образуется ярко окрашенный ион FеNCS 2+, в результате чего весь раствор приобретает интенсивно-красный цвет.
Роль железа в жизнедеятельности живых организмов очень велика. Оно входит в состав гемоглобина крови, который осуществляет перенос кислорода от органов дыхания к другим органам и биологическим тканям.
Окраску крови придают именно соединения железа. Если лишить железа растения и животных, то они изменяют свою окраску. Как человек бледнеет, когда не хватает гемоглобина в крови, так и растение, растущее при недостатке железа в почве, будет бледным или даже бесцветным. Поэтому соединения железа издавна применяются для лечения малокровия, при истощении, упадке сил.
Для человека и животных источником железа служат растения. В зеленых овощах, таких, как шпинат, салат, капуста, железа много. Чем интенсивнее окрашены растения и животные, тем больше в них железа. Так, розовая вишня содержит наполовину меньше железа, чем черная. Светло-зеленый капустный лист в шесть раз беднее железом, чем зеленый. В говядине железа больше, чем в телятине.
1. Строение атома железа. Степени окисления железа: +2, +3.
2. Физические и химические свойства железа. Образование хлоридов железа(II) и (III), взаимодействие с серой, кислородом, водой, кислотами, солями.
3. Железо в природе, минералы железа (магнитный, бурый и красный железняки).
4. Соединения катионов железа Fе2+ и Fе3+.
5. Качественные реакции на Fе2+ и Fе3+ и реактивы: желтая и красная кровяная соли, роданид калия.
Напишите уравнения реакций, иллюстрирующих генетические ряды соединений Fе2+ и Fе3+. Первые реакции каждого ряда охарактеризуйте с позиций окисления-восстановления, а реакции с участием электролитов запишите также в ионном виде.
Напишите по два молекулярных уравнения, соответствующих следующим сокращенным ионным уравнениям:
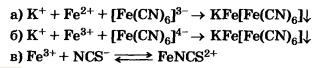
Как называются эти реакции? Напишите названия реактивов.
Используя дополнительную литературу (словари русского языка, химические словари и др.), подготовьте рассказ о происхождении названий реактивов и продуктов качественных реакций на Fе2+ и Fе3+.
Сместится ли химическое равновесие следующего обратимого процесса:
ЗFе + 4Н20 <-> Fе3O4 + 4Н2
при повышении давления? Ответ обоснуйте.
Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
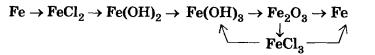
Первое и последнее превращение рассмотрите с позиций окисления-восстановления. Реакции с участием электролитов напишите в молекулярной и ионных формах.
Напишите три уравнения реакций железа с разбавленной азотной кислотой, в которых продуктом восстановления кислоты будет соответственно N2, N0, NH4NO3. При уравнивании записей реакции используйте метод электронного баланса. Определите окислитель и восстановитель в этих реакциях.
Какой объем оксида углерода(II) потребуется для восстановления железа из 2,32 т магнитного железняка, содержащего 5% пустой породы? Какое количество вещества железа при этом получится, если выход его составляет 80% от теоретически возможного?
Используя свои знания по химии железа, напишите сочинение на тему «Художественный образ вещества или химического процесса».
юмор к уроку химии 9 класса, конспекты уроков по химии, акселеративные методы для всех предметов
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|