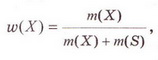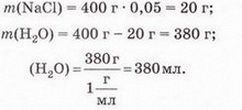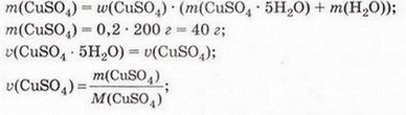|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину
КІЛЬКІСНИЙ СКЛАД РОЗЧИНУ. МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ. ВИГОТОВЛЕННЯ РОЗЧИНУ
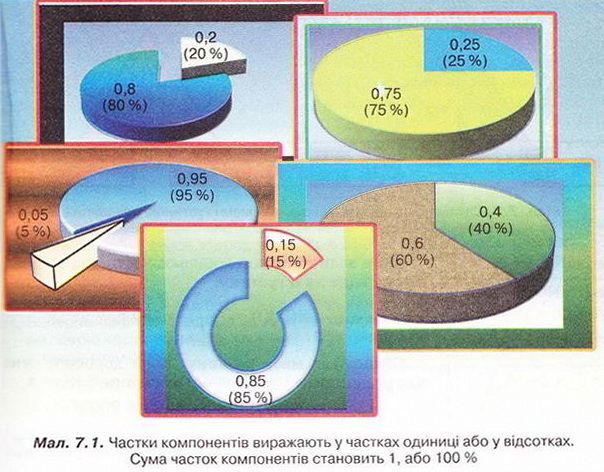
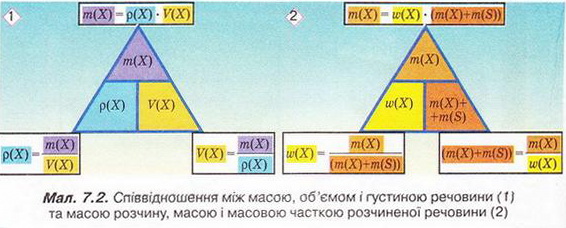
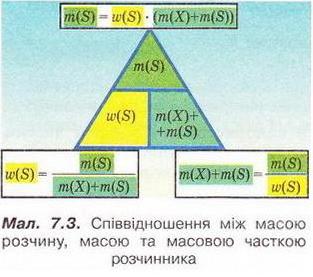
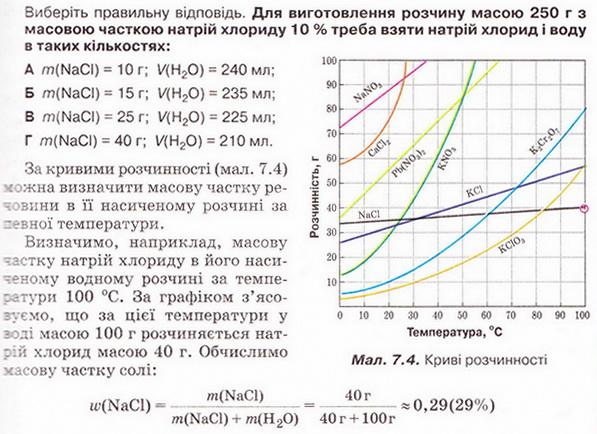
Кількісний склад розчину. Масова частка розчиненої речовини Певні уявлення про кількісні характеристики розчинів ви дістали вивчаючи розчинність речовин та її залежність від різних чинників (пригадайте, яких саме). Відносні кількості компонентів розчину можуть змінюватися в досить широких межах (поміркуйте й висловіть припущення, який чинник визначає ці межі). Під час роботи з розчинами важливо знати їхній кількісний склад, зокрема масову частку розчиненої речовини. Цю важливу кількісну характеристику завжди зазначають на етикетках хімічних реактивів, харчових продуктів, лікарських засобів у формі розчинів. Наприклад, масова частка брильянтового зеленого в його спиртовому розчині становить 1 %; масова частка амоніаку в його водному розчині - 10 %; масова частка оцтової кислоти у столовому оцті – 6 %, а масова частка гідроген пероксиду в його водному розчині - 3 % (виразіть ці масові частки у частках від одиниці). Якщо препарат призначений для лікування дітей, то масова частка розчиненої речовини в ньому зазвичай у кілька разів менша, ніж у ліках для дорослих. Запам'ятайте! Важливо уважно читати етикетки на споживчих товарах, аби не сплутати, наприклад, столовий оцет, масова частка оцтової кислоти в якому не перевищує 9 %, з оцтовою есенцією. Масова частка оцтової кислоти в ній становить 70 %. Помилкове вживання есенції замість столового оцту може спричинити важкі хімічні опіки органів травлення. Поняття масової частки вже відоме вам з курсу хімії 8-го класу. Завдання Обчисліть масову частку Оксигену в кальцій карбонаті. Для цього спочатку обчисліть відносну формульну масу цієї сполуки. Далі визначте відносну масу атомів Оксигену в ній. Частка від ділення відносної маси атомів Оксигену на відносну формульну масу сполуки і буде шуканою величиною. Величини, які називають частками компонентів (складових частин) системи, або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (x) об ємні (ф) та масові (w) частки компонентів. З малюнка 7.1 легко зрозуміти, що сума часток компонентів становить 1, або 100 %. Завдання Виберіть правильне твердження. Масова частка води в розчині з масовою часткою сульфатної кислоти 0,3 становить: А 30 %; Б 40 %; В 70 %; Г 7 %; Д 3 %. • Масова частка розчиненої речовини — це відношення її маси до загальної маси розчину. Масову частку розчиненої речовини в бінарному розчині обчислюють за формулою де w(Х) - масова частка розчиненої речовини X; Розгляньмо приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масову частку натрій нітрату розчину, для виготовлення якого було взято натрій нітрат масою 20 г воду об'ємом 180 мл. Запишемо скорочено умову задачі й виконаємо необхідні розрахунки. Які формули для цього знадобляться, легко зрозуміти зі співвідношень, наведених на схемах (мал. 7.2). Завдання Виберіть правильні відповіді. Масова частка цукру в розчині, для виготовлення якого було взято цукор масою 200 г і воду об'ємом 300 мл, становить: А 20 %; Б 40 %; В 6,6 %; Г 30 %; Д 0,4; Е 0,02; Ж 0,3. Розглянемо ще один приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масу калій гідроксиду і об'єм води, потрібні для виготовлення розчину масою 800 г з масовою часткою лугу 0,2. Потрібні формули наведені на малюнках 7.2 і 7.3. Використовуючи їх, можна, зокрема, обчислити масу речовини у розчині за її масовою часткою та масою розчину, вирахувати масу води у ньому та її об'єм. Завдання Ви вже знаєте, що чимало речовин, солей зокрема, кристалізуються з розчинів у вигляді гідратів. Тому, якщо треба виготовити розчин з використанням кристалогідрату, слід спочатку обчислити масу та кількість (у молях) безводної солі, яка відповідає необхідній масі кристалогідрату. Оскільки кількості (у молях) безводної солі й кристалогідрату рівні, можна обчислити масу кристалогідрату. Масу води обчислюють за різницею маси розчину й кристалогідрату. Наприклад, обчислимо об'єм води й масу купрум(ІІ) сульфату, пентагідрату, необхідні для виготовлення розчину купрум(ІІ) сульфату масою 200 г з масовою часткою солі 0,08. Для цього пригадаємо: яка хімічна формула відповідає назві купрум(ІІ) сульфат, пентагідрат; як обчислюють молярну масу кристалогідрату; як обчислюють масу речовини за її кількістю (у молях). Отже, ці та інші типи розрахунків, пов'язані з виготовленням розчинів (розбавляння, упарювання, добавляння розчинюваної речовини, змішування кількох розчинів), ґрунтуються на розумінні понять «ціле», «частка від цілого», «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, представлених на малюнках 7.2 і 7.3, та вмінні ними оперувати. Уміння обчислювати маси компонентів розчину необхідні під час роботи в хімічних лабораторіях і на багатьох виробництвах. Знадобляться вони й у побуті, щоб виготовити розчини залізного або мідного купоросу (пригадайте, для чого їх застосовують), розчини для засолювання овочів. Одержання столового оцту розбавлянням оцтової есенції також потребує згадуваних умінь. Як правильно виготовити розчин з певною масовою часткою розчиненої речовини, ви дізнаєтеся з наступного параграфа. Стисло про головне Відносні кількості компонентів розчину можуть змінюватися в досить широких межах, які залежать від розчинності речовини. Масова частка розчиненої речовини - важлива кількісна характеристика розчинів. Величини, які називають частками компонентів (складових частин) системи або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (x), об'ємні (ф) та масові (w) частки компонентів. Сума часток компонентівтстановить 100 %, або 1. • Масова частка розчиненої речовини - це відношення її маси до загальної маси розчину. У бінарному розчині її обчислюють за формулою де w(Х) - масова частка розчиненої речовини X; Чимало речовин, солей зокрема, кристалізуються з розчинів у формі гідратів. Тому, якщо треба виготовити розчин з використанням кристалогідрату, слід спочатку обчислити масу та кількість (моль) безводної солі, яка відповідає необхідній масі кристалогідрату. Оскільки кількості (моль) безводної солі й кристалогідрату рівні, можна обчислити масу кристалогідрату. Масу води обчислюють за різницею маси розчину й кристалогідрату. Розрахунки, пов'язані з виготовленням розчинів, ґрунтуються на розумінні понять «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, наведених на малюнках 7.2 і 7.3, та вмінні ними оперувати. Уміння обчислювати маси компонентів розчину необхідні під час роботи в хімічних лабораторіях і на багатьох виробництвах. Знадобляться зони й у побуті. Застосуйте свої знання й уміння 1. Виберіть правильне твердження. Масова частка розчиненої речовини - це: 2. Виберіть правильне твердження. Масову частку розчиненої речовини позначають літерою: А w; Б p; В x; Г ф. 3. Виберіть усі правильні твердження. Масову частку розчиненої речовини виражають у: А Літрах; Б Відсотках; В Градусах; Г Частках від одиниці; Д Грамах. 4. Встановіть відповідність між складом розчинів і масовими частками розчинених речовин.
5. Обчисліть масу оцтової кислоти в 6 %-му столовому оцті об'ємом 1 л і густиною 1кгл 6. Обчисліть масу оцтової кислоти в оцтовій есенції масою 250 г з масовою часткою оцтової кислоти 0,7. 7. Обчисліть масу порції столового оцту з масовою часткою оцтової кислоти 9%, якщо маса оцтової кислоти в ній становить 175 г. Обчисліть об’єм води в цій порції оцту. 8. У так званому фізіологічному розчині масова частка натрій хлориду становить 0,9%. Обчисліть масу солі та об’єм води, потрібні для виготовлення фізіологічного розчину об'ємом 1 л та густиною 1 кгл. Поясніть, як перевірити, істинним чи колоїдним є фізіологічний розчин. 9. Обчисліть масу води в нашатирному спирті об'ємом 40 мл - розчині з масовою часткою амоніаку 10 % та густиною 1 гмл. 10. Обчисліть масові частки солей у насичених розчинах: а) калій нітрату за 20°С; б) калій хлориду за 10°С; в) калій дихромату за 100°С; г) калій хлориду за 70 °С; д) кальцій хлориду за 70°С; ж) плюмбум(ІІ) нітрату за 55 °С. 11. Виберіть правильну відповідь. Масова частка ферум(ІІ) сульфату в розчині, для виготовлення якого було взято залізний купорос масою 27,8 г і воду об'ємом 744,8 мл, дорівнює: 12. Визначте масову частку купрум(II) сульфату в розчині, який утвориться внаслідок змішування мідного купоросу масою 50 г з водою об'ємом 750 мл. Скарбничка досвіду Препарат «Регідрон» використовують для лікування і профілактики теплових уражень, пов ‘язаних з порушенням водного балансу (інтенсивне потовиділення, пронос у дітей). В одному пакетику цього засобу містяться натрій хлорид масою 3,5 г, калій хлорид масою 2,5 г, натрій цитрат масо 2,9 г і глюкоза масою 10 г. Обчисліть масові частки кожного із цих компонентів у розчині одержаному внаслідок розчинення одного пакетика «Регіону» у воді об ємом 150 мл. Одержані результати округліть до цілих. Аби перевірити правильність своїх обчислень, використайте комп'ютерну програму Microsoft Office Excel. Побудуйте за її допомогою на основі даних про маси компонентів розчину «Регідрону» кругову діаграму. Виберіть у вбудованому меню «Формат підписів даних» команду «Включити в підписи частки».
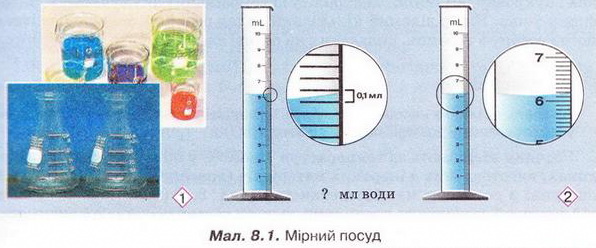
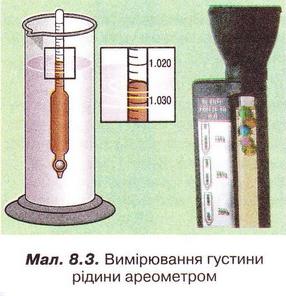
Завдання Пригадайте й назвіть послідовність операцій з виготовлення водного розчину кухонної солі. Для виготовлення розчинів, окрім дистильованої води та розчинюваної речовини, потрібні: ваги, мірний посуд, посуд для розчинення, шпателі або ложечки для відбору речовин, скляні палички, лійка, фільтрувальний папір, ареометри. Завдання Поясніть, чому для виготовлення розчинів у лабораторії застосовують дистильовану воду. Порції води (а також необхідні об'єми інших рідких речовин і розчинів) відмірюють за допомогою різноманітного мірного посуду (мал. 8.1,1). Завдання 1. Назвіть мірний посуд, зображений на малюнку 8.1,2. Пригадайте, як визначають ціну поділки мірного посуду (мал. 8.1, 2). Визначте об'єм води у мірному циліндрі. Розчинювані речовини повинні мати певний ступінь чистоти й не містити помітних механічних домішок (поясніть, чому). Перед виготовленням розчинів тверді речовини зазвичай подрібнюють. Порції твердих речовин зважують на вагах із погрішністю (для навчальних цілей) не більш 0,1-1 г. У хімічних і фармацевтичних лабораторіях ви користовують високоточні електронні ваги (мал. 8.2). Завдання Поясніть: а) для чого подрібнюють тверді речовини перед виготовленням розчину; б) яку операцію треба виконати раніше - відбір порції твердої речовини чи її подрібнення. Розчинення здійснюють у чистому посуді, який не взаємодіє з розчином (поясніть, чому). За потреби (поясніть, коли вона виникає) готовий розчин фільтрують. Найважливішою характеристикою рідких розчинів є густина, яку зазвичай вимірюють ареометром (мал. 8.3) за 20 °С. Принцип дії ареометра ґрунтується на законі Архімеда (пригадайте його зміст і застосування). За глибиною занурення ареометра (об'ємом витиснутої ним досліджуваної рідини) визначають її густину. За результатами низки вимірів складено таблиці відповідності густий й кількісного складу розчинів різних речовин. Ці дані широко використовують для визначення кількісного складу розчинів за їхніми густинами. Деякі ареометри відразу градуйовано у масових чи об'ємних частках певного компонента. Вони призначені для вимірювання густин специфічних рідин - молока, спиртових і цукрових розчинів, електроліту автомобільних акумуляторів, антифризу тощо. Якщо відомий кількісний склад розчину, можна дізнатися його густину з таблиць, складених на основі експериментальних даних. Завдання Поясніть, як можна швидко перевірити, чи відповідає масова частка речовини у виготовленому розчині заданій величині. Розчини зберігають за температури 15-20 °С у щільно закритих посудинах, виготовлених з інертних матеріалів (поясніть, чому). На кожній посудині з розчином має бути етикетка (мал. 8.4) (поясніть, чому). На ній зазвичай зазначають розчинник, масову частку розчиненої речовини, дату виготовлення розчину. Запам'ятайте! Тривале й неправильне зберігання може призвести до псування розчину аж до повної непридатності - появи пластівців і каламуті, зміни кольору й складу тощо. Виготовлення розчинів потребує точності, акуратності й попереднього проведення правильних математичних розрахунків. Усі ці якості та вміння знадобляться вам не лише на одному з наступних уроків під час виконання Практпичної роботи № 1, а й у повсякденному житті. Докладно розглянемо послідовність виготовлення розчину на конкретному прикладі. Виготовимо водний розчин масою 400 г із масовою часткою натрій хлориду 5 % . Спочатку обчислимо потрібні для цього масу солі та об'єм води: У колбу або склянку ємністю 500-700 мл помістимо наважку солі масою 20 г і невеликими порціями, обережно перемішуючи скляною паличкою або круговими рухами посудини, добавимо попередньо відміряну циліндром воду об'ємом 380 мл. Після повного розчинення солі переллємо розчин у посудину та закоркуємо її. На етикетці зазначимо дату виготовлення розчину та масову частку розчиненої речовини (поясніть, для чого). Пам'ятайте, у разі виготовлення розчину з кристалогідрату слід зважати на наявність у ньому кристалізаційної води. Обчислимо масу купрум(ІІ) сульфату, пентагідрату та об'єм води, потрібні для виготовлення розчину масою 200 г із масовою часткою купрум(II) сульфату 20 %. • Значення розчинів у природі та житті людини важко переоцінити, тож у попередніх параграфах ми неодноразово наголошували на застосуванні цих систем у побуті та різних галузях суспільного господарства. Вода морів і океанів містить багато розчинених речовин - переважно хлоридів та сульфатів Натрію, Кальцію, Магнію. Рослини споживають розчинені у воді мінеральні речовини. Чи не всі обмінні процеси в живих організмах відбуваються за участю розчинів. Адже цитоплазма клітин і фізіологічні рідини - сльози, піт, лімфа, сеча, кров - містять розчинені речовини. Неабиякою проблемою є те, що внаслідок техногенної діяльності людини у природних водах розчинено чимало сполук, небезпечних для здоров'я людини та довкілля. Стисло про головне У хімічних лабораторіях, на виробництві та у побуті часто виникає потреба у виготовленні розчинів із певними масовими частками розчинених речовин. Для виготовлення розчинів, окрім дистильованої води та розчинюваної речовини, потрібні: ваги, мірний посуд, посуд для розчинення, шпателі або ложечки для відбору речовин, скляні палички, лійка, фільтрувальний папір, ареометри. Порції води (а також необхідні об'єми інших рідких речовин і розчинів) зазвичай відмірюють за допомогою мірних циліндрів. Розчинювані речовини повинні мати певний ступінь чистоти й не містити помітних механічних домішок. Перед виготовленням розчинів тверді речовини зазвичай подрібнюють, аби прискорити процес розчинення. Порції твердих речовин зважують на вагах із погрішністю (для навчальних цілей) не більш 0,1-1 г. У хімічних і фармацевтичних лабораторіях використовують високоточні електронні ваги. Розчинення здійснюють у чистому посуді, який не взаємодіє з розчином. За потреби готовий розчин фільтрують. Найважливішою характеристикою рідких розчинів є густина, яку зазвичай вимірюють ареометром за 20 °С. Існують таблиці відповідності густин й кількісного складу розчинів різних речовин. їх широко застосовують для визначення кількісного складу розчинів за їхніми густинами й навпаки. Розчини зберігають за температури 15-20 °С у щільно закритих посудинах, виготовлених з інертних матеріалів. На кожній посудині з розчином має бути етикетка із зазначенням масової частки розчиненої речовини, і розчинника, дати виготовлення розчину. Тривале й неправильне зберігання може призвести до псування розчину аж до повної непридатності. Виготовлення розчинів потребує точності, акуратності й попереднього проведення правильних математичних розрахунків. Значення розчинів у природі та житті людини важко переоцінити, ці системи широко застосовують у побуті та різних галузях суспільного господарства. Застосуйте свої знання й уміння 2. Виберіть правильну послідовність операцій із виготовлення розчину з певною масовою часткою розчиненої речовини: 3. Обчисліть масу натрій хлориду і об'єм води для виготовлення розчину масою 150 г з масовою часткою солі 0,04. 4. Обчисліть масу цукру та об'єм води для виготовлення розчину масою 250 г з масовою часткою сахарози 0,2. 5. Обчисліть масу натрій карбонату та об'єм води для виготовлення розчину масою 80 г з масовою часткою солі 5 %. 6. Як дезінфікуючі засоби для полоскання ротової порожнини та горла використовують 3 %-ний розчин питної соди (натрій гідрогенкарбонату) або 5 %-ний розчин борної (боратної) кислоти. Обчисліть маси розчинюваних речовин і об'єми води для виготовлення цих розчинів об'ємом 200 мл кожний. Густини розчинів дорівнюють 1 гмл. Поясніть, чи потрібно знати хімічні формули розчинюваних речовин, аби виконати ці обчислення. 7. Схарактеризуйте значення розчинів у природі та житті людини. Скарбничка досвіду 2. Уявіть себе:
в) випробуйте себе у ролі режисера й оператора і за допомогою фотоапарата та відеокамери зніміть фільм за написаним сценарієм.
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: