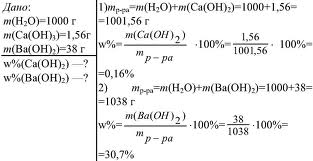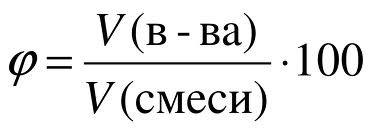|
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Массовая и объемная доли компонентов смеси. Полные уроки
Цели урока:
Задачи урока:
• обучающие: сформировать представление о массовой и объемной доли компонентов смеси, научить вычислять эти доли; • развивающие: развить у учащихся умение анализировать, решать задачи, обобщать, сравнивать и делать выводы; • воспитательные: расширение кругозора.
Основные термины:
Массовая доля – отношение массы растворенного вещества к общей массе раствора. Объемная доля – отношение объема данного вещества к общему объему смеси.
Ход урока:
1. Проверка домашнего задания. 1. Среди приведенных объектов выберите самый маленький по размеру: а) бактерия; б) молекула; в) маковое зернышко; г) песчинка. 2. В каком ряду все перечисленные вещества относятся к простым? а) мел, углерод, озон; б) алмаз, кислород, гранит; в) сера, фосфор, озон; г) крахмал, водород, железо. 3. Очень важной для живой природы особенностью физических свойств воды является то, что: а) температура кипения воды равна 100º С; б) плотность жидкой воды выше плотности льда; в) температура замерзания воды равна 0º С; г) вода обладает очень низкой электропроводностью. 4. Соединений, содержащих только атомы водорода и кислорода: а) не известно ни одного; б) известно только одно; в) известно несколько; г) известно огромное количество. 5. При взаимодействии кислорода с металлами: а) образуются соли; б) выделяется озон; в) образующиеся соединения всегда являются оксидами; г) образующиеся соединения не всегда являются оксидами.
Растворы в природе.
Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Чаще всего – вода. Вы уже знаете, что природная вода никогда не бывает совершенно чистой. Так, существует вода, которая содержит значительное количество солей кальция и магния и называется жесткой (есть также мягкая вода, например дождевая). Жесткая вода дает мало пены с мылом, а на стенках котлов и чайников при ее кипячении образуется накипь. На рисунке 1 вы можете посмотреть, как жесткая вода образует накипь. Жесткость воды зависит от количества растворенных в ней солей. Содержание растворенного вещества в растворе выражают с помощью ее массовой доли. Рис.1. Влияние жесткой воды Давайте посмотрим видео про жесткость воды:
Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество. В ювелирных и технических изделиях применяют не чистое золото, а его сплавы, чаще всего с медью и серебром. Чистое золото — металл слишком мягкий, ноготь оставляет на нем след. износостойкость его невелика. Проба, стоящая на золотых изделиях, изготовленных в нашей стране, означает массовую долю золота в сплаве, точнее, содержание его из расчета на тысячу массовых частей сплава. Проба 583°, например, означает, что в сплаве массовая доля золота составляет 0,583 или 58,3%.
Массовая доля.
Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах (рисунок 2). Рис.2. Массовая доля компонентов смеси. Посмотрев видео
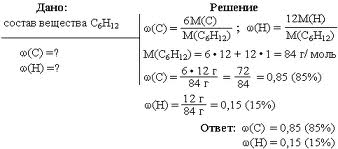
вы вникнете в понятие массовой доли и научитесь ее вычислять. Если в 100 г раствора содержится 30 г хлорида натрия, это означает, что ω(NaCl) = 0,3 или ω(NaCl) = 30 %. Можно также сказать: «имеется тридцатипроцентный раствор хлорида натрия». Массовая доля — самая распространенная в быту и большинстве отраслей промышленности концентрация. Именно массовая доля жира, например, указана на пакетах с молоком (посмотрите на рисунок 3). Рис.3. Массовая доля жира в молоке. Масса раствора складывается из массы растворителя и массы растворенного вещества, т. е.: m(раствора) = m(растворителя) + m(растворенного вещества). Предположим, массовая доля растворенного вещества равна 0,1, или 10%. Следовательно, оставшиеся 0,9, или 90%, – это массовая доля растворителя. Массовая доля растворенного вещества широко используется не только в химии, но и в медицине, биологии, физике, да и в повседневной жизни. Рассмотрим решение некоторых задач, представленных на рисунке 4 и 5. Рис.4. Задача на нахождение массовой доли. Рис.5. Задача на нахождение массовой доли (в процентах).
Объемная доля.
В состав воздуха входит несколько различных газов: кислород, азот, углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно. Для того чтобы выразить состав смеси газов в цифрах, т.е. количественно, используют особую величину, которую называют объемной долей газов в смеси. Аналогично массовой доле определяется и объемная доля газообразного вещества в газовой смеси, обозначаемая греческой буквой фи (рисунок 6): Рис. 6. Объемная доля.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рисунок 7). Рис.7. Объемная доля благородных газов в воздухе. Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать. В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле. Давайте посмотрим, как решать задачи на нахождение объемной доли (рисунок 8). Рис.8. Задача на нахождение объемной доли. Выводы.
1. Самые простые растворы состоят из двух компонентов. Один из компонентов раствора – растворитель. Для нас более привычны жидкие растворы, значит, растворитель в них – жидкое вещество. Другой компонент раствора – растворенное вещество. Им может быть и газ, и жидкое, и твердое вещество. 2. Один из самых распространенных способов выражения концентрации раствора – через массовую долю растворенного вещества. Отношение массы растворенного вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой «омега» и выражают в долях единицы или процентах. 3. Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Объемная доля газообразного вещества в газовой смеси обозначается греческой буквой фи.
Контролирующий блок.
1. Что такое массовая доля растворенного вещества? 2. Что такое объемная доля компонента в газовой смеси? 3. Сравните понятия «объемная доля» и «массовая доля» компонентов смеси. 4. Массовая доля йода в аптечной йодной настойке составляет 5%. Какую массу йода и спирта нужно взять, чтобы приготовить 200 г настойки? 5. Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона? 6. В 150 г воды растворили 25 г поваренной соли. Определите массовую долю соли в полученном растворе. 7. При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом? 8. Смешали два раствора серной кислоты: 80 г 40%-го и 160 г 10%-го. Найдите массовую долю кислоты в полученном растворе.
Домашнее задание.
1. Сделайте сообщение о чистом веществе и о растворах в природе. 2. Приведите как можно больше примеров указания объемной или массовой доли вещества в растворе. 3. Придумайте по одной задаче на нахождение массовой и объемной доли вещества.
Интересно знать, что.
Как известно, один из самых соленых водоемов в мире — Мертвое море. В нем массовая доля поваренной соли NaCl может достигать 10 %, в то время как в Черном море — не более 1,8 %. При этом молярные концентрации этой соли составляют соответственно 3,3 моль/л и 0,5 моль/л. Таким образом, массовые доли различаются примерно в 5,5 раз, а молярности — в 6,6 раз. Это объясняется тем, что воды двух морей имеют разную плотность: у Мертвого моря она настолько велика, что в нем почти невозможно утонуть; плотность человеческого тела меньше плотности такого солевого раствора (рисунок 9). Рис.9. Мертвое море и купание в нем. Именно благодаря своему высокому содержанию солей мертвое море считается лечебным, как сказано в этом видео:
Список литературы:
1. Урок на тему «Массовая и объемные доли» Панина С.Г., учитель химии, СОШ №27, г. Архангельск. 2. Урок на тему «Раствор» Денисов А.Н., учитель химии, гимназия №3, г. Москва. 3. Габриелян О.С. Химия. 8 класс: контрольные и проверочные работы к учебнику О.С. Габриеляна «Химия. 8» / О.С. Габриелян, П.Н. Березкин, А.А. Ушакова и др. – М.: Дрофа, 2006. 4. Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений – М.: Дрофа, 2008.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали: Панина С.Г. Денисов А.Н. Борисенко И.Н.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: