|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Поняття про амфотерні гідроксиди. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуСутність та номенклатура амфотерних гідроксидівАмфотерність - здатність хімічної сполуки виявляти кислотні або основні властивості залежно від природи другого компонента, який бере участь у кислотно-основній взаємодії. Щоб згадати що ж являють собою гідроксиди, пропонуємо вам переглянути наступне відео. Відео 1. Поняття про оксиди та гідроксиди.
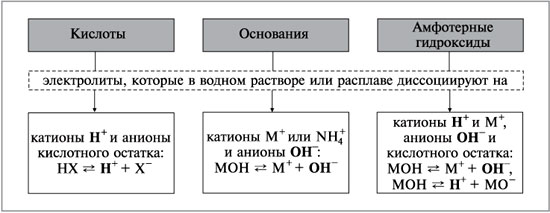
Амфотерні гідроксиди – Me(OH)x – гідрати амфотерних оксидів, які мають слабкі кислотні та основні властивості. Всі амфотерні гідроксиди погано розчиняються у воді, добуваються непрямими методами. Приклади амфотерних гідроксидів: Be(OH)2, Zn(OH)2, Au(OH)3, Pb(OH)2, Sn(OH)2, Sn(OH)4, Cu(OH)2, Fe(OH)3, Cr(OH)3, Ga(OH)3 тощо. За своїм складом амфотерні гідроксиди не відрізняються від основ, тому назви їх утворюються аналогічно, із назви катіона або металоподібної групи та слова «гідроксид», наприклад: Sn(OH)2 – гідроксид олова (ІІ), Sn(OH)4 – гідроксид олова (IV). Мал. 2. Гідроксид олова (IV). Якщо до складу сполуки входять інші іони, то в назві ії перелічують з відповідними числовими префіксами: CrO(OH) – хром оксисен гідроксид, Fe3O2(OH)5 – триферум диоксиген пентагідроксид. Мал. 3. Приклади амфотерних гідроксидів. Контролюючий блок 1
Основні хімічні властивості амфотерних гідроксидівАмфотерні гідроксиди взаємодіють з кислотами та кислотними оксидами, виявляючи основні властивості і утворюючи при цьому солі, наприклад: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O; 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O. Амфотерні гідроксиди взаємодіють з основами та основними оксидами з утворенням солей, виявляючи при цьому кислотні властивості, наприклад: Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O (при сплавлянні); Zn(OH)2 + CaO = CaZnO2 + H2O; Al(OH)3 + 3NaOH = Na3[Al(OH)6] (у розчині). Прояв амфотерності гідроксидів у водних розчинах зводиться до утворення комплексних сполук (гідроксокомплексів), а в твердофазних системах - цинкатів, мета - і ортоалюмінатів та інш. Вони здатні частково дисоціювати як основи і як кислоти. Наприклад: Al(OH)3 = Al + 3OH Al(OH)3 = 3H + AlO3 Амофтерні властивості гідроксиду алюмінію ви можете побачити на наступному відео. Відео 2. Амфотерні властивості гідроксиду алюмінію.
Напрям дисоціації амфотерного гідроксиду залежить від кислотності середовища. Багатокислотні амфотерні гідроксиди дисоціюють поступово: Al(OH)3 = Al(OH)2 + OH; Al(OH)2 = Al(OH) + OH; Al(OH) = Al + OH. Мал. 4. Дисоціація амфотерних гідроксидів. Контролюючий блок 2
Основні методи добування амфотерних гідроксидівАмфотерні гідроксиди добувають за реакціями відповідних солей з кислотами або лугами в еквівалентних кількостях (щоб уникнути розчинення гідроксиду у надлишку лугу або кислоти): Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4; 2Na[Al(OH)4] + H2SO4 = 2Al(OH)3 + Na2SO4 + 2H2O. Побачити спосіб добування та зрозуміти основні властивості амфотерного гідроксиду ви можете з наступного відео. Відео 3. Добування та властивості амфотерного гідроксиду.
2Na + 2H2O = 2NaOH + H2. Мал. 5. Гідроксид натрію – NaOH. Електроліз водних розчинів деяких солей: 2NaCl + 2H2O = H2 + Cl2 + 2NaOH. Взаємодія основних оксидів з водою: CaO + H2O = Ca(OH)2; Na2O + H2O = 2NaOH. Контролюючий блок 3
Домашнє завдання
Цікаво знати, що…Проведіть при нагоді наступний цікавий дослід. У хімічний стакан ємністю 500 мл наливають 100 мл концентрованої (ρ = 1, 508 г/см3) HNO3 і до неї обережно по скляній паличці, перемішуючи, вливають 100 мл концентрованої H2SO4. Нітруючи суміш ретельно перемішують, потім занурюють у неї великий жмут вати. Склянку з нітруючою сумішшю і ватою нагрівають до 70С на водяній бані. Через 5-8 хв. вату виймають зі склянки, промивають її великою кількістю води під краном і висушують на повітрі. Ще ви можете продемонструвати відміну між нітрованою ватою і звичайною, адже ззовні вони майже не відрізняються. На долоню кладуть жмут нітрованої вати і підпалюють її. Нітратоцелюлоза (нітроклітковина) вмить згоряє – настільки швидко, що не встигає обпекти й руку. Для порівняння на азбестовій сіточці спалюють жмут звичайної гігроскопічної вати. Остання повільно горіть і жевріє. Головку одного сірника обгортають нітрованою ватою, а головку іншого – звичайною, а потім підпалюють їх. Нітратоцелюлоза згоряє вмить, а отже, не встигає запалити головку сірника. Звичайна ж вата згоряє повільно, жевріє і головка сірника займається. Список використаних джерел1. Урок на тему «Амфотерні гідроксиди та їх характеристика» Русецької О. П., СЗШ №7, м. Ноябрськ.
Русецька О.П Князєва М.В. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: