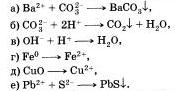|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Свойства электролитов (химический практикум)
Практическая работа № 8. Ионные реакции
Опыт 1.
Обнаружение сульфат-ионов
Налейте в пробирку раствор сульфата натрия, в другую — раствор сульфата калия. В обе пробирки по каплям добавьте раствор хлорида бария. Объясните наблюдаемое. Составьте уравнение электролитической диссоциации взятых солей и уравнение реакции обмена. Запишите нонное уравнение реакции. Какие соединении могут служить реактивом на ионы бария Ва 2 +. В чем сущность обнаружения ионов с помощью реактива?
Опыт 2
Обнаружение хлорид ионов VI
По таблице растворимости выясните, какие соли, содержащие хлорид-ион Сl - нерастворимы. При помощи имеющихся у вас реактивов докажите, что в растворе хлорида натрия присутствуют хлорид-ионы. Составьте уравнение диссоциации солей, реакции обмена и ионное уравнение проведенных реакций.
Опыт 3.
Обнаружение сульфат-ионов SO 2- 4 и хлорид-ионов Сl -
В двух пробирках содержатся растворы хлорида калия и сульфата магния. С помощью каких реакций можно доказать, что в одной пробирке находится раствор хлорида калия, а в другой — раствор сульфата магния?
Раствор из первой пробирки разделите пополам и перелейте в две пробирки. Прилейте в одну раствор нитрата свинца (II), в другую — раствор хлорида бария. В какой ни пробирок выпал осадок? Какая из солей содержится в первой пробирке?
Раствор второй пробирки испытайте на присутствие аниона, не обнаруженного в первой пробирке. Для этого к испытуемому раствору прилейте раствор нитрата свинца (ІІ).
Объясните наблюдаемое.
Составьте уравнения реакций обмени проведенных вами реакций и ионные уравнения реакций обнаружения ионов.
Опыт 4.
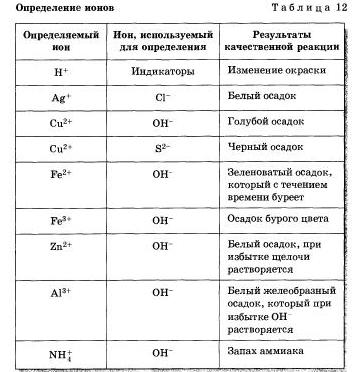
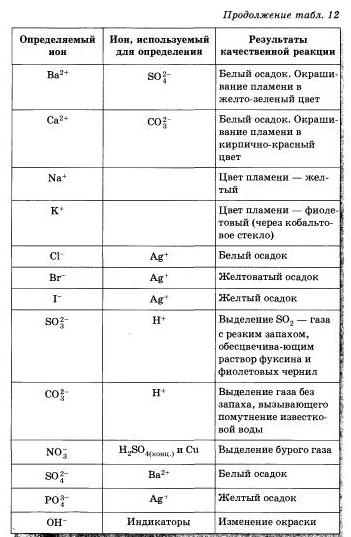
Проделайте реакции, подтверждающие качественный состав следующих веществ: а) хлорида бария; б) сульфата магния: в) карбоната аммония. Для выполнения этого опыта используйте таблицу 12.
Практическая работа № 9. Условия протекания химических реакций между растворами электролитов до конца
Опыт 1.
Возьмите три пробирки. В каждую налейте 2—3 мл раствора: в первую сульфата меди (II), во вторую хлорида калия, в третью сульфата алюминия. Затем в каждую пробирку добавьте: в первую немного раствора гидроксида натрия, во вторую — фосфата натрия, а в третью — хлорида бария. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод.
Опыт 2.
В две пробирки налейте по 2—3 мл растворов сульфита натрия и карбоната натрия, соответственно. Затем прилейте в каждую из них раствор азотной кислоты. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций. Сделайте вывод.
Опыт 3.
В одну пробирку налейте 3—4 мл раствора гидроксида натрия и добавьте две-три капли фенолфталеина. Раствор приобретает малиновый цвет. Затем прилейте раствор соляной или серной кислоты до обесцвечивания.
В другую пробирку налейте примерно 10 мл сульфата меди (II) и добавьте немного раствора гидроксида натрия. Образуется голубой осадок гидроксида меди (II). Прилейте в пробирку серную кислоту до растворении осадка.
Составьте уравнения происходящих реакций в молекулярном и ионном виде. Поясните, почему в первой пробирке произошло обесцвечивание, а во второй растворение осадка. Каким общим свойством обладают растворимые и нерастворимые основания?
Практическая работа № 10. Свойства кислот, оснований, оксидов и солей
Задание1.
0существите реакции, характеризующие свойства растворов:
а) соляной кислоты (1 вариант);
б) серной кислоты (2 вяриант).
Запишите уравнения проделанных вами реакций в молекулярной и ионной формах. Реакцию с металлом рассмотрите как окислительно-восстановительную.
Задание 2.
Проделайте реакции, характеризующие свойства раствора гндроксида натрия (I вариант).
Получите гидроксид железа (III) реакцией обмена и осуществите реакции, характеризующие его химические свойства (2 вариант).
Запишите уравнения проделанных нами реакций в молекулярной и иоццой формах.
Задание 3.
Получите оксид серы (IV) и проделайте реакции, характеризующие его свойства (I вариант).
Проделайте реакции, характеризующие свойства оксида кальция (2 вариант).
Запишите уравнения реакций в молекулярной и ионной формах, если это возможно.
Задание 4.
Проделайте реакции, характеризующие свойства:
а) хлорида железа (ІІ) (1 вариант);
б) хлорида меди (II) (2 вариант).
Запишите уравнения реакций в молекулярной и ионной формах. Реакции с участием металла рассмотрите как окислительно-восстановительные.
Практическая работа 11. Решение экспериментальных задач
1. Налейте в пробирку 1—2 мл концентрированного раствора серной кислоты и опустите в нее кусочек цинка. Составьте уравнение реакции в молекулярном, ионном и сокращенном ионном виде, покажите переход электронов. Что в этой реакции является окислителем?
2. В шести пробирках находятся растворы хлорида машин. В каждую из пробирок последовательно прилейте следующие растворы: а) гидроксид натрия; б) сульфат калия; в) карбонат натрия; г) нитрат цинка; д) фосфат калия; е) сульфид натрия.
Составьте уравнения реакций, протекающих до конца, в молекулярном, ионном и сокращенном ионном виде.
3. Даны растворы:
а) карбонат калия и соляная кислота;
б) сульфид натрия и серная кислота;
в) хлорид цинка и азотная кислота;
г) сульфит натрия и серная кислота;
д) сульфат меди (II) и азотная кислота.
Слейте попарно эти растворы, немного нагрейте и осторожно определите по запаху, в каких случаях реакции протекают до конца и почему. Составьте уравнения соответствуюших реакций в молекулярном, ионном и сокращенном ионном виде.
4. Осуществите реакции, схемы которых даны:
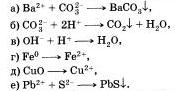
5. Проделайте реакции между следующими веществами: а) сероводородной и хлорной водой; б) раствором иодида калия и хлорной водой; в>соляной кислотой и алюминием; г) концентрированной серной кислотой и медью (при нагревании).
Составьте уравнения реакций, покажите переход электронов. Что является окислителем, и что — восстановителем?
6. Пользуясь растворами, находящимися на столе, получите: а) гидроксид железа (ІІІ); б) сульфид меди (II); в) оксид серы (IV); г) карбонат магния; д) свинец.
Составьте молекулярные, ионные и сокращенные ионные уравнения соответствующих реакций.

сборники конспектов уроков химии, методические рекомендации учителям 8 класса, дискуссионные вопросы по химии
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|