|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Склад і властивості основних класів неорганічних сполук
СКЛАД І ВЛАСТИВОСТІ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК
ВІТАЮ ВАС, ДЕВ'ЯТИКЛАСНИКИ! Цього року ви завершите опанування азів хімічної науки в основній школі. Тож по закінченні дев'ятого класу зможете більш-менш об'єктивно оцінити, чи сприяло вивчення хімії підвищенню вашої загальної ерудиції, чи допомогло ліпше пізнати себе і навколишній світ, вибрати професію до душі й навчальний заклад для подальшого навчання. Ви, безперечно, знаєте, як працювати з текстом підручника, й умієте, за потреби, знаходити пояснення нових термінів у тлумачному словничку та інших джерелах інформації - додатковій навчальній літературі, науково-популярних і художніх виданнях, Інтернеті тощо. Принагідно зауважу, що нові слова, зокрема іншомовного походження, які трапляються в тексті, запам'ятовувати необов'язково. На цих прикладах ви лише розвинете уміння використовувати довідковий апарат підручника, який правитиме за модель різноманітних джерел інформації. Терміни, значення яких треба знайти в тлумачному словничку, підкреслено. Таку форму виокремлення обрано свідомо й цілеспрямовано. Адже вам обов'язково доведеться (а багатьом уже доводилося) працювати з інформаційними джерелами на електронних носіях, зокрема у режимі «on-line». у яких гіпертекстові посилання традиційно виокремлюють саме у такий спосіб. Підручник хімії виконуватиме функції своєрідного «тренажеру», на якому ви зможете вправлятися у сприйнятті та обробці інформації різного формату - алгоритмічних приписів, табличних даних, графіків, діаграм. Вироблення навичок сприймати інформацію й після належної обробки застосовувати у практичній діяльності забезпечить зростання вашої інформаційної компетентності. Вам доведеться виокремлювати головне в інформаційному повідомленні, вчитися розуміти різні формати формулювань завдань, обґрунтовувати власні висловлення. Яке призначення рубрики «Стисло про головне»? Вона допоможе вам швидко пригадати й усвідомити найважливіше з того, про що йшлося у параграфі, здійснити самоконтроль. Для чого у підручнику наведено тестові завдання різних форм? їхнє виконання не лише сприятиме закріпленню вивченого, а й удосконаленню вмінь працювати з тестовими завданнями взагалі. Ці вміння нагодяться вам під час проходження зовнішнього незалежного оцінювання. Чи всі завдання виконувати? Завдання в основному тексті параграфів спрямовані на актуалізацію наявних і закріплення щойно здобутих знань, тому не варто залишати їх поза увагою. До того ж у такий спосіб ви змінюєте вид діяльності, це «розвантажує» мозок і сприяє розв'язанню проблем на рівні підсвідомості. Завдання, наведені у рубриці «Застосуйте свої знання й уміння», призначені для виконання як під час роботи на уроці, так і для домашньої самостійної роботи. Ви маєте самі визначити обсяг роботи - кількість завдань і різноманітність достатні, аби кожен вибрав собі ті, які йому по силах і до снаги. Приміром, завдання, позначені *, виконувати необов'язково, однак остаточне рішення - за вами. Ваш найперший порадник у цьому - вчитель хімії. Хто як не він знає рівень навчальних можливостей, схильності та уподобання своїх вихованців і охоче допоможе правильно визначити обсяг домашнього завдання. На яку кількість уроків розраховане вивчення одного параграфа? Поміж параграфів підручника переважають такі, для вивчення яких достатньо одного уроку. Деякі параграфи ви вивчатимете на кількох уроках - вони містять більшу порцію інформації й, відповідно, більшу кількість завдань. Зверніть увагу: матеріал, позначений * та виокремлений дрібнішим шрифтом, подано для ознайомлення, а не для запам'ятовування. Ви вдосконалюватимете вміння сприймати альтернативні точки зору й висловлювати обґрунтовані аргументи за й проти кожної з них. Ви знаходитимете необхідну інформацію в різних джерелах, систематизуватимете запропоновану або самостійно підібрану інформацію за певними ознаками. До того ж вам доведеться переводити зорову інформацію у словесну знакову систему й навпаки. Ці вміння неодмінно стануть вам у пригоді під час виконання завдань рубрики «Скарбничка досвіду». Зрозуміло, що всі їх виконати навряд чи можливо та й недоцільно. Вибирайте з них ті, що вам до душі. Залучайте до співпраці однокласників, друзів, членів родини, радьтеся з учителями - і скарбничка поступово наповнюватиметься. Згодом її вміст перетвориться на своєрідний «стартовий капітал», який допоможе вам стати успішною самодостатньою людиною. Цього року ви вдосконалите вміння складати план експерименту, виконувати досліди відповідно до ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ {пригадайте, яких саме), описувати спостереження та на основі їхнього аналізу робити висновки. Розрахункові задачі нових типів також є важливою складовою курсу хімії 9-го класу. Розв'язуючи задачі, ви не тільки звертатиметесь до алгоритмічних приписів підручника, а й робитимете спроби самостійно складати їх, шукатимете власні нестандартні підходи. Зміст, біографічні довідки й портрети науковців, відомості з рубрики «Цікаво? Корисно! Пізнавально!», предметний та іменний покажчики тощо допоможуть вам ефективно використовувати підручник як джерело знань, розширити ерудицію. Пам'ятайте, що гармонійний розвиток інтелекту неможливий без знань основ хімії. Тож не шкодуйте зусиль на їхнє вивчення - це допоможе вам стати конкурентоспроможними та успішними особистостями, справжніми громадянами і патріотами України. Я вірю у вас, УЧНІ, й зичу успіху!
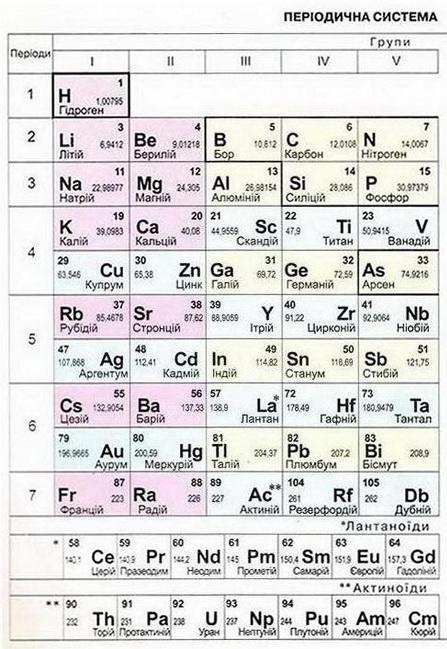
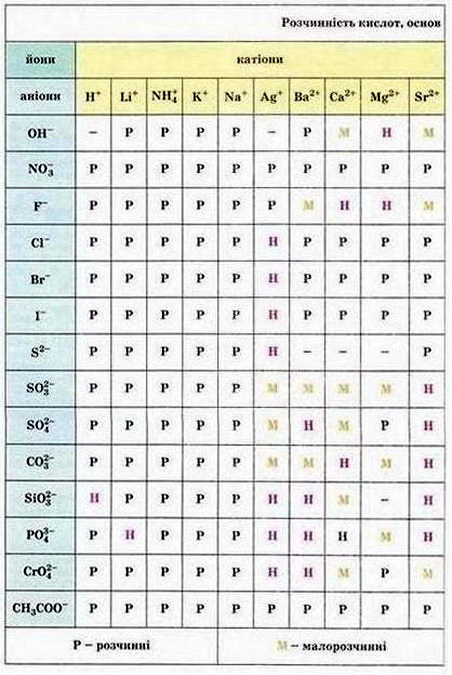
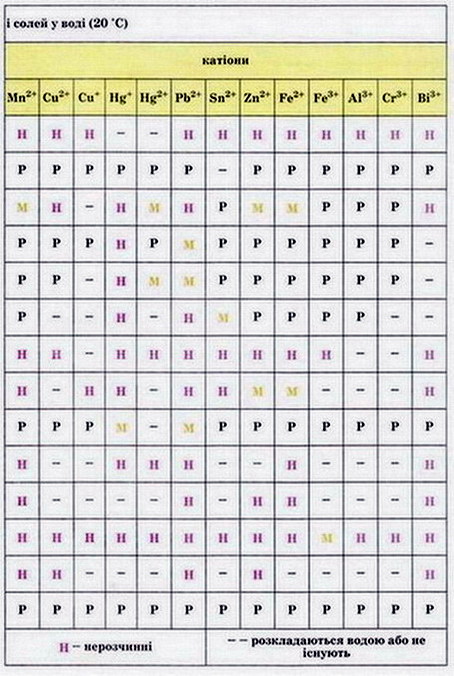
Мал. 1. Періодична система хімічних елементів. Мал. 2. Розчинність кислот, основ і солей у воді.
Склад і властивості основних класів неорганічних сполук Аби відповісти на запитання: що таке оксиди, кислоти, солі, індикатори? Де ці сполуки трапляються у природі та побуті? Як оксиди, кислоти, солі називають за сучасною науковою номенклатурою та у який спосіб класифікують? Які властивості цих сполук і чим вони зумовлені? Яким чином представники різних класів неорганічних сполук пов'язані між собою? Для чого їх застосовують і чому? - пригадайте курс хімії 8-го класу, проаналізуйте схеми, виконайте тестові завдання й здійсніть самоконтроль. Виконаймо тестове завдання - установімо відповідність між визначеннями та назвами.
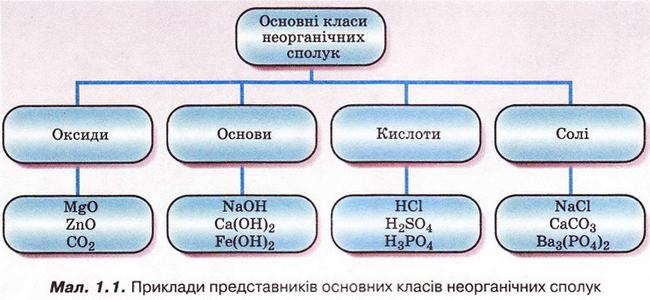
Відповідь. 1 - Б. 2 - А. З - Г. 4 - Д. Отже, ви пригадали, що таке оксиди, основи, солі та індикатори. Кислоти — це складні речовини, у молекулах яких атоми Гідрогену сполучені з кислотними залишками. Розгляньмо приклади оксидів, основ, кислот, солей, наведені на малюнку 1.1. • Де оксиди, основи, кислоти, солі трапляються у природі та побуті? Для чого їх застосовують та чому? Оксиди бувають твердими, як-от: кварц Si02, корунд А1203, гематит Fe203, рідкими, наприклад вода Н20, та газуватими - вуглекислий газ С02, сірчистий газ S02. Чимало мінералів і руд містять оксиди. Оксиди застосовують у промисловості й повсякденному житті. Багато з них є небезпечними для здоров'я людини і довкілля. Щоб ефективно й безпечно використовувати оксиди, дуже важливо знати їхні властивості та фізіологічну дію. Неорганічні кислоти також поширені у нашому житті. Приміром, шлунковий сік містить хлоридну кислоту HCl. Сульфатна кислота H2S04 - складова автомобільного акумулятора. Карбонатна Н2С03 та ортофосфатна Н3Р04 кислоти - компоненти солодких газованих напоїв. Лікувальна вода «Нафтуся» має специфічний запах сірководню - адже до її складу входить сульфідна кислота H2S. Основи у нашому житті - це засоби для прочищення каналізаційних труб і видалення жирових забруднень (містять натрій гідроксид), елементи живлення (містять гідроксиди Натрію, Калію, Літію), складові будівельних розчинів (кальцій гідроксид або гашене вапно) тощо. Солі вам теж добре відомі: кухонна сіль (натрій хлорид), питна сода (натрій гідрогенкарбонат, крейда (кальцій карбонат), «марганцівка» (калій перманганат). • Як оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою? Назвімо за сучасною науковою номенклатурою оксид, хімічна формула якого N02, за таким алгоритмом: 1. Запишемо назву неметалічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви хімічного елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «оксид». Отже, назва сполуки - нітроген(ІV) оксид. Завдання Назвіть за сучасною науковою номенклатурою оксид, хімічна формула якого S03. Назвімо за сучасною науковою номенклатурою основу, формула якої Fе(ОН)2, за таким алгоритмом: 1. Запишемо назву металічного елемента у називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо слово «гідроксид». Отже, назва сполуки - ферум(ІІ) гідроксид. Завдання Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АІ(ОН)3. Установімо відповідність між хімічними формулами та назвами найважливіших кислот, виконавши тестове завдання (зверніть увагу: у назвах кислот виокремлено назви кислотних залишків).
Відповідь. 1 - Б. 2 - Д. З - Ж. 4 - Г. 5 - 3. 6 - А. 7 - К. Формула нітратної кислоти НNО3. Назвімо за сучасною науковою номенклатурою сіль, формула якої СuСl2, за таким алгоритмом: 1. Запишемо назву металічного елемента в називному відмінку однини. 2. Для хімічних елементів зі змінною валентністю зазначимо її в дужках після назви елемента (не робімо пробілу між назвою хімічного елемента і записом у дужках). 3. Запишемо назву кислотного залишку. Отже, назва сполуки - купрум(ІІ) хлорид. Завдання Назвіть за сучасною науковою номенклатурою сполуку, хімічна формула якої АgN03. Цікаво? • У який спосіб класифікують 'оксиди, основи, кислоти, солі? Завдання Установіть відповідність між оксидами та їхнім хімічним характером.
Кислоти класифікують за основністю і за якісним складом. Основність у формулі кислоти визначають за кількістю атомів Гідрогену, здатних заміститися на атоми металічного елемента. Наприклад, нітратна кислота (HNO3) - одноосновна, сульфітна кислота (H2S03) - двохосновна, ортофосфатна кислота (Н3Р04) - трьохосновна. Порада: пригадати хімічні формули найважливіших кислот вам допоможе таблиця «Розчинність кислот, основ, солей у воді» (див. додаток). Розташуймо кислоти за зростанням їхньої основності: А Ортофосфатна кислота; Б Сульфатна кислота; В Хлоридна кислота. Відповідь. 1 - В. 2 - Б. З - А. Завдання Розташуйте кислоти за зменшенням їхньої основності: А Сульфідна кислота; Б Ортофосфатна кислота; В Нітритна кислота За якісним складом кислоти класифікують за наявністю або відсутністю атомів Оксигену в молекулах. Наприклад, нітратна кислота (HN03) - оксигеновмісна, а бромідна (НВr) - безоксигенова. Завдання Виберіть безоксигенові кислоти: А Сульфатна кислота; Б Сульфідна кислота; В Хлоридна кислота; Г Силікатна кислота Основи поділяють на луги і нерозчинні основи. Луги - йонні кристалічні речовини білого кольору, милкі на дотик, розчинні у воді, їдкі (LiOH, NaOH, КОН, Mg(OH)2, Са(ОН)2, Sr(OH)2). Нерозчинні основи - це йонні речовини різних кольорів, нерозчинні у воді (Fe(OH)2, Сг(ОН)2, Мn(ОН)2). Завдання Користуючись таблицею «Розчинність кислот, основ, солей у воді» (див. додаток), виберіть луг. А Цинк гідроксид; Б Барій гідроксид; В Нікель(ІІ) гідроксид; Г Купрум(ІІ) гідроксид • Як виявляють кислоти і луги у розчинах? Розчини кислот і лугів можна розрізнити за зміною кольору індикаторів. Наприклад, у кислому середовищі метиловий оранжевий змінює колір на рожевий, фенолфталеїн у лужному - на малиновий. Універсальний індикаторний папір у лужному середовищі стає синім, у кислому набуває червоного кольору. Установіть відповідність між речовинами та забарвленням індикаторів: а)
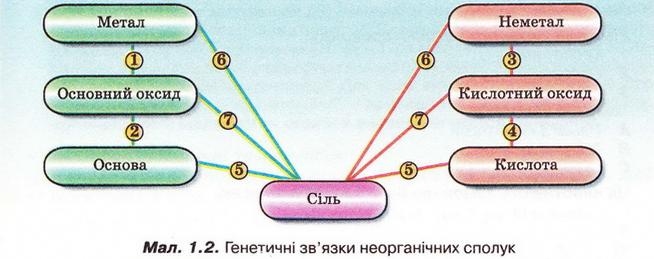
б)
Розгляньмо загальні схеми взаємодії між представниками різних класів неорганічних сполук і конкретні приклади до них. Кислота + метал → сіль + водень Н2S04 + Fе = FеS04 + Н2↑ Кислоти у розчинах не реагують із тими металами, які у ряду активності (с. 105, мал. 14.4) розташовані після водню: Н2S04 + Аu → Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. НСІ + Мg→ МgСІ2 + Н2↑ Кислота + основний або амфотерний оксид → сіль + вода 2НNO3 + MgO = Мg(NО3)2 + Н20 2НСl + ВеО = ВеСl2 + Н20 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. НСІ + СuО → СuСІ2 + Н20 Кислота + основа → сіль + вода 2НNОз + Са(ОН)2 = Са(N03)2 + 2Н20 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. Н2S04 + NaОН -> Nа2S04 + Н20 Кислота' + сіль' → сіль" + кислота" Сильні й нелеткі кислоти витісняють слабкі, леткі, нестійкі кислоти з їхніх солей: 2HN03 + СаС03 = Ca(N03)2 + C02↑ + Н20 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. HCl + Na2S → NaCl + H2S↑ Луг + кислотний або амфотерний оксид → сіль + вода 2КОН + С02 = К2С03 + Н20 2NaOH + ВеО + Н20 = Na2[Be(OH)4]* Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти, продукти. NaOH + S03 → Na2S04 + Н20 Луг' + сіль' → основа" + сіль" Реакція між солями й лугами у розчині відбувається, якщо хоча б одиг з її продуктів - нерозчинна речовина: 2КОН + CuS04 = Cu(OH)2↓+ K2S04 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. Ва(ОН)2 + Na2C03 → NaOH + ВаС03↓ Основний оксид + вода → луг З водою реагують оксиди металічних елементів ІА і ІІБ (починаючи з Магнію) груп періодичної системи: СаО + Н20 = Са(ОН)2 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. Li20 + Н20 → LiOH Кислотний оксид + вода → кислота SO2 + Н20 = H2S03 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. SO3 + Н20 → H2S04 Пригадайте літній відпочинок на пісковому пляжі й назвіть кислотний оксид, який не реагує з водою. За потреби зверніться до таблиці «Розчинність кислот, основ і солей у воді» (див. додаток). Основний оксид + кислотний оксид → сіль МgО + SО3 = МgS04 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. СаО + С02 → СаС03 Сіль' + метал' → сіль" + метал" Кожний попередній метал (починаючи від магнію) у ряду активності (с.105, мал.14.4) витісняє наступні з розчинів їхніх солей: CuCl2 + Zп = ZnCl2 + Cu↓ Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. СuS04 + Fе → FеS04 + Сu↓ Сіль' + сіль" → сіль"' + сіль"" NaСІ + АgN03 = АgСІ↓ + NaNO3 Завдання Перетворіть схему реакції на хімічне рівняння, назвіть реагенти і продукти. МgS04 + ВаСІ2 → ВаS04↓+ МgСІ2 Як представники різних класів неорганічних сполук пов'язані між собою? Розібратися у цьому допоможе малюнок 1.2. Завдання Доповніть генетичний ряд кальцію формулою основи. Са → СаО → ? → СаСІ2 Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій. Завдання Доповніть генетичний ряд сірки. S → ? → Н2SО3 → Nа2S03 Складіть рівняння реакцій. Назвіть реагенти і продукти реакцій, зазначте типи реакцій. Отже, між класами неорганічних сполук існують зв'язки, які називають генетичними. Генетичний зв'язок полягає у тому, що з речовин одного класу неорганічних сполук можна одержати речовини - представники інших класів. До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того ж хімічного елемента. Вони мають єдине походження - генезис - і пов'язані взаємоперетвореннями. Властивості речовин істотно залежать від їхнього хімічного складу. Застосування речовин зумовлене їхніми властивостями. Встановімо відповідність між складом, властивостями і застосуванням ортофосфатної кислоти. Ортофосфатна кислота: Завдання Встановіть відповідність між складом, властивостями і застосуванням магній гідроксиду. Отже, ви повторили склад і властивості представників основних класів неорганічних сполук, генетичні зв'язки між ними. Ці знання й уміння луже важливі. Вони знадобляться вам під час вивчення теми «Розчини». Стисло про головне Оксиди, основи, кислоти, солі - основні класи неорганічних сполук. Розчини кислот і лугів можна розрізнити за допомогою індикаторів. Представники основних класів неорганічних сполук трапляються й у природі, й у побуті. Оксиди, основи, кислоти, солі називають за сучасною науковою номенклатурою. її суть полягає в тому, що кожній сполуці з ід повідає лише одна назва, і навпаки. Назви неорганічних речовин ґрунтуються на українських назвах хімічних елементів. Оксиди, основи, кислоти, солі класифікують за різними ознаками -якісним і кількісним складом, фізичними та хімічними властивостями. Властивості речовин зумовлені їхнім хімічним складом і будовою. Між представниками основних класів неорганічних сполук існують генетичні зв'язки. Застосування речовин зумовлене їхніми властивостями. Застосуйте свої знання й уміння 1. З наведеного переліку виберіть формули речовин, які належать до генетичного ряду магнію: Са, Н20, Мg(N03)2, МgСІ2, S, Н2S04, Na3Р04, 02, Мg(ОН)2, SОз, Мg, МgО. 2. Проаналізуйте хімічні формули речовин з наведених переліків, назвіть їх і класифікуйте: 3. Складіть рівняння хімічних реакцій, які відображають генетичні зв'язки літію й вуглецю, та між представниками цих рядів.
Автор Г. А. Лашевська, Хімія, 9 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: