|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Соединения галогенов
Галогеноводороды и галогеноводородные кислоты. Все галогеноводороды (общую формулу их можно записать как НГ) — бесцветные газы, с резким запахом, токсичны. Очень хорошо растворяются в воде и дымятся во влажном воздухе, так как притягивают находящиеся в воздухе водяные пары, образуя при этом туманное облако.
На рисунке 18 проиллюстрирован опыт, наглядно показывающий хорошую растворимость хлороводорода в воде (при обычных условиях в одном объеме воды растворяется около 500 его объемов).
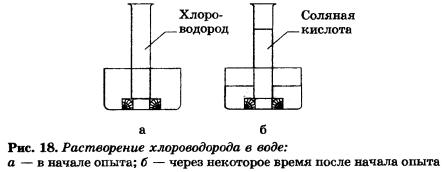
Растворы галогеноводородов в воде являются кислотами, это НF — фтороводородная, или плавиковая, кислота, НСl — хлороводородная, или соляная, кислота, НВr — бромоводородная кислота, IH — иодоводородная кислота. Способность их к электролитической диссоциации с образованием катионов водорода растет от НF к НI.
Самая сильная из галогеноводородных кислот — иодоводородная, а самая слабая — фтороводородная. Большая прочность химической связи Н—F (поэтому фтороводородная кислота слабо диссоциирует в воде) обусловлена малым размером атома F и соответственно малым расстоянием между ядрами атомов водорода и фтора. С ростом радиуса атома от F к I растет и расстояние Н—Г, прочность молекул уменьшается и соответственно способность к электролитической диссоциации увеличивается.
Наиболее технически важными являются хлороводород и соляная кислота. В промышленности хлороводород получают синтезом из водорода и хлора:
Н2 + Сl2 = 2НСl
В лабораторных условиях для получения НСl используют реакцию, проводимую при нагревании:
2NаСl(крист) + Н2SO4(конц) = 2НСl(газ) + Nа2SO4(крист)
Необратимому протеканию этой реакции способствует летучесть НСl.
Соляная кислота представляет собой бесцветную, дымящуюся на воздухе жидкость, она несколько тяжелее воды. Это типичная кислота, взаимодействует с металлами, оксидами металлов, основаниями и солями (приведите сами уравнения соответствующих реакций и охарактеризуйте их в свете тео-рии'электролитической диссоциации и процессов окисления и восстановления там, где это имеет место).
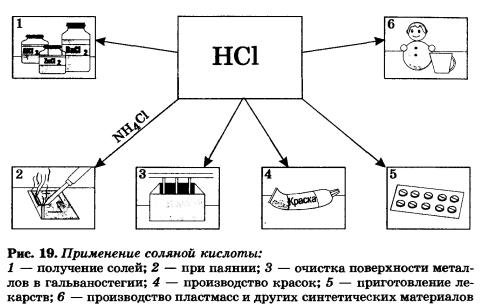
Соляная кислота находит широкое применение в промышленности страны (рис. 19).
Соли галогеноводородных кислот. Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды, иодиды. Хлориды, бромиды и иодиды многих металлов хорошо растворимы в воде.
Для определения в растворе хлорид-, бромид- и иодид-ионов и их различения используют реакцию с нитратом серебра АgNO3. В результате реакции хлоридов (и самой соляной кислоты) с этим реактивом выпадает белый творожистый осадок хлорида серебра, сокращенное ионное уравнение этой реакции записывается так:
Ag + Сl = АgCl
Белый
В реакциях с бромоводородной кислотой и ее солями и с ио-доводородной кислотой и ее солями также образуются осадки, но только желтого цвета, которые различаются оттенками:
Ag + Вr = АgВr
Светло-желтый
Аg+ I = АgI
Желтый
А вот для распознавания фтороводородной кислоты и фторидов нитрат серебра в качестве реактива непригоден, так как образующийся AgF растворим в воде. Для доказательства присутствия в растворе фторид-ионов F можно использовать реакцию с ионами Са2+, так как СаF2 выпадает в осадок.
Свое название плавиковая кислота получила из-за уникального свойства взаимодействовать с оксидом кремния, входящим в состав стекла, как бы «плавить» его.
Эту реакцию используют для изготовления надписей и рисунков на стекле. На стекло наносят тонкий слой парафина, по которому процарапывают рисунок, а затем изделие погружают в раствор плавиковой кислоты. Таким образом, например, литовский художник М. Чюрленис создал около тридцати художественных произведений, хранящихся в музее его имени в г. Каунасе.
Галогены в природе. Галогены в природе существуют только в связанном состоянии. Среди них наиболее распространены хлор (0,19% от массы земной коры) и фтор (0,03% ).
Важнейшее природное соединение хлора — галит NaCl, с которым вы подробно знакомились в прошлом году. Его добывают путем разработки залежей каменной соли — твердого хлорида натрия.
Кроме галита, встречается природный хлорид калия KCl — минерал сильвин, сильвинит — смесь KCl и NaCl, состав которой отражают формулой KCl • NaCl.
Важнейший природный минерал фтора — это флюорит, или плавиковый шпат CaF2.
Бром и иод — рассеянные элементы, своих минералов они не образуют. Они концентрируются в водах океанов и морей, в водах буровых скважин, а также в водорослях.
1. Галогеноводороды.
2. Галогеноводородные кислоты: фтороводородная, или плавиковая, хлороводородная, или соляная, бромоводородная, иодоводородная.
3. Галогениды: фториды, хлориды, бромиды, иодиды. Качественные реакции на галогенид-ионы.
4. Природные соединения галогенов: галит, сильвин, сильвинит, флюорит.
Докажите зависимость степени электролитической диссоциации от природы электролита на примере галогеново-дородных кислот.
В четырех пробирках находятся прозрачные растворы фторида, хлорида, бромида и иодида натрия. Как распознать эти вещества с помощью одного реактива?
Напишите уравнения реакций получения хлорида магния.
Напишите уравнения химических реакций, иллюстрирующие следующие превращения:
Сl2 -> НС1 -> СuСl2 -> ZnС12 -> АgСl
Укажите окислительно-восстановительные реакции и разберите их. Уравнения реакций с участием электролитов запишите также в сокращенной ионной форме.
конспекты уроков химии, химия 9 класс, рефераты по всем предметам
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













