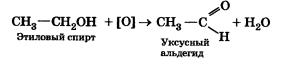|
ипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Спирты
Органические вещества, в молекулах которых углеводородный радикал связан с гидроксильной группой —ОН, составляют класс соединений, называемых спиртами.
Число гидроксильных групп в молекуле определяет атомность спирта. Спирты, содержащие в молекуле одну группу —ОН, называют одноатомными, общая их формула R—ОН (где R — углеводородный радикал).
Названия одноатомных спиртов образуются от названий соответствующих (по числу атомов углерода) углеводородов с прибавлением суффикса -ол. Представителями таких спиртов являются метиловый СН3ОН и этиловый С2Н5ОН спирты.
Метиловый спирт, или метанол СН3ОН, представляет собой бесцветную жидкость, tкип = 64,7 °С. С водой смешивается во всех отношениях. Горит бесцветным пламенем.
Применяется в технике как растворитель органических веществ.
Метанол очень ядовит. Небольшое количество его вызывает общее отравление организма и паралич зрительного нерва, что приводит к слепоте, большие его количества смертельны.
Этиловый спирт, или этанол С2Н5ОН, по физическим свойствам очень похож на метиловый. Это бесцветная жидкость со слабым запахом и жгучим вкусом. Легче воды. Температура кипения 78,3 °С. Смешивается с водой во всех отношениях и является хорошим растворителем для химических веществ. Легко воспламеняется, горит слабо светящимся голубоватым пламенем.
Небольшие количества этилового спирта вызывают опьянение, большие количества его могут вызвать потерю сознания, общее отравление, а иногда и смерть. Частое употребление спиртных напитков приводит к возникновению болезненного состояния, называемого алкоголизмом.
Характерные химические свойства этилового спирта (и всех других спиртов) обусловлены наличием в них гидроксильной группы —ОН.
Изучите свойства этилового спирта, проделав следующие лабораторные опыты.
1. Рассмотрите выданный вам в пробирке образец этилового спирта. Понюхайте его. В отдельную пробирку налейте несколько капель спирта и 2—3 мл воды. Взболтайте. Что вы можете сказать о растворимости спирта?
2. В пробирку налейте 1—2 мл воды, а во вторую — 1—2 мл спирта и добавьте по 2—3 капли растительного масла. Взболтайте. Что можно сказать о свойствах спирта как растворителя?
3. На фильтровальную бумагу капните 1 каплю воды и 1 каплю этилового спирта. Какая капля быстрее испарится? Сделайте вывод о свойствах спирта на основе этого опыта.
4. Накалите на пламени спиртовки свернутую в спираль медную проволоку и внесите ее в этиловый спирт. Зафиксируйте наблюдения: черный налет оксида меди(II) на проволоке исчез, она стала блестящей (свежая медь), а также появился специфический неприятный запах — в результате реакции образовался уксусный альдегид.
Последний опыт демонстрирует способность спиртов окисляться. В данном случае реакция окисления этилового спирта в уксусный альдегид протекает согласно уравнению:
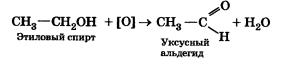
Эта реакция наряду с уже известной вам реакцией Кучерова применяется для получения уксусного альдегида.
Основной метод производства этилового спирта в промышленности — гидратация этилена. Таким методом получается технический этиловый спирт, который содержит примесь очень ядовитого метилового спирта.
Этиловый спирт в громадных количествах используется для технических нужд. Он применяется как растворитель в лакокрасочной и химико-фармацевтической промышленности, для синтеза красителей и в ряде других производств. Особенно большое значение этиловый спирт приобрел после того, как в 1930 г. наш крупнейший отечественный химик С. В. Лебедев открыл способ производства каучука, исходя из спирта.
Этиловый спирт используют в медицине для компрессов, обтираний, дезинфекции кожи перед уколом. Его широко применяют для приготовления настоек и экстрактов, а также многих лекарств.
Этиловый спирт — основное сырье ликероводочных и винных производств.
Для получения алкогольных напитков используют известный с древности способ спиртового брожения сахаристых веществ.
Выше мы рассмотрели одноатомные спирты, т. е. содержащие в молекуле одну гидроксильную группу. Существуют спирты, в молекулы которых входят две и три гидроксильные группы — это двухатомные и трехатомные спирты соответственно.
Двухатомные спирты рассмотрим на примере этиленглико-ля, который, как вы, очевидно, помните, получается при окислении этилена раствором перманганата калия.
Запишем еще раз его формулу:
СН2 - СН2
I I
ОН ОН
Из формулы видно, что этиленгликоль представляет собой производное этана, в котором один атом водорода при каждом углеродном атоме замещен на гидроксильную группу.
Этиленгликоль — бесцветная густая жидкость тяжелее воды (плотность равна 1,1 г/см3), кипящая при 197 °С и замерзающая при -13 °С. Имеет сладковатый вкус. Ядовит.
Применяют его в виде водных растворов в качестве незамерзающей охлаждающей жидкости — антифриза (заполняют радиаторы автомобилей, тракторов, комбайнов).
Трехатомные спирты рассмотрим на примере глицерина.
Глицерин представляет собой производное пропана, в котором один атом водорода при каждом атоме углерода замещен на гидроксильную группу.
Это густая сиропообразная бесцветная жидкость сладкого вкуса (р = 1,26 г/см3), tкип = 290 °С, tзам = -17 °С.
Хорошо растворяется в воде. Безводный глицерин очень гигроскопичен — притягивает влагу из воздуха. Смазанные им предметы предохраняются от высыхания, поэтому глицерин применяется при выделке кож и отделке тканей.
Водные растворы глицерина широко используют в парфюмерии и медицине. Для смягчения кожи рук и лица приме
няются только водные растворы глицерина, так как при нанесении на кожу безводного глицерина может возникнуть сильное раздражение вследствие обезвоживания им поверхности кожи.
Водные растворы глицерина используют как антифризы. Кстати, клетки растений не замерзают зимой в силу того, что в клеточном соке содержится глицерин, действующий как антифриз.
С некоторыми свойствами многоатомных спиртов можно познакомиться при выполнении следующих лабораторных опытов.
1. К 1 мл воды в пробирке прилейте равный объем глицерина и смесь взболтайте. Затем добавьте еще столько же глицерина. Что можно сказать о растворимости его в воде?
2. Глицерин, этиленгликоль и другие многоатомные спирты, в отличие от одноатомных, можно распознать с помощью следующей качественной реакции: к 2 мл раствора щелочи в пробирке прилейте несколько капель раствора медного купороса. К полученному осадку прибавьте по каплям глицерин и смесь взболтайте. Осадок растворяется, получается раствор ярко-синего цвета.
1. Спирты и их атомность.
2. Предельные одноатомные спирты: метанол и этанол.
3. Окисление этилового спирта в уксусный альдегид.
4. Двухатомный спирт этиленгликоль.
5. Трехатомный спирт глицерин.
6. Качественная реакция на многоатомные спирты.
Напишите уравнения реакций горения метилового и этилового спиртов, этиленгликоля и глицерина. Каков характер пламени у них?
Метиловый спирт, аналогично этиловому, может окисляться в муравьиный альдегид Н—С = O оксидом меди(II). Напишите уравнение этой реакции.
\
H
Какие свойства метилового и этилового спиртов находят практическое применение?
Как сместить химическое равновесие реакции гидратации этилена вправо, если известно, что прямая реакция экзотермическая и все вещества находятся в газовой фазе?
Процесс брожения глюкозы с образованием этилового спирта протекает согласно уравнению:
С6Н1206 -> 2С2Н5ОН + 2С02
Глюкоза
В каком объеме выделится при этом углекислый газ (н. у.), если подвергнуть брожению 3 моль глюкозы?
акселеративные методы к уроку химии, тренинги для 9 класса, кроссворды и цитаты
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|