|
Гипермаркет знаний>>Биология>>Биология 10 класс>> Строение и функции белков
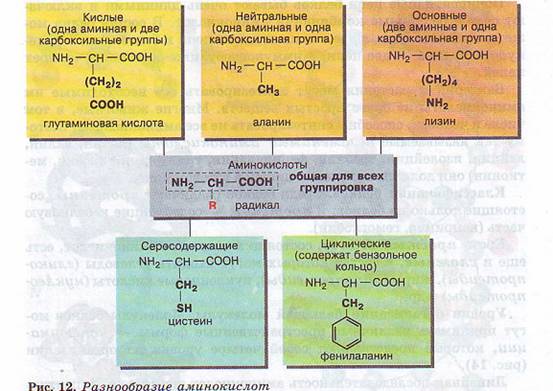
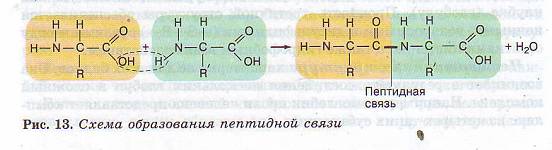
Среди органических компонентов клетки самыми важными являются белки. Они очень разнообразны и по строению, и по функциям. Содержание белков в различных клетках может колебаться от 50 до 80%. В клетках разных живых организмов встречается свыше 170 различных аминокислот, но бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Из них может быть образовано 2 432 902 008 176 640 000 комбинаций, т. е. различных белков, которые будут обладать совершенно одинаковым составом, но различным строением. Но и это огромное число не предел — белок может состоять и из большего числа аминокислотных остатков, и, кроме того, каждая аминокислота может встречаться в белке несколько раз. Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой (—СООН) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение (рис. 12).
Бактерии и растения могут синтезировать все необходимые им аминокислоты из более простых веществ. Многие животные, в том числе и человек, способны синтезировать не все аминокислоты, поэтому так называемые незаменимые аминокислоты (лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин) они должны получать с пищей в готовом виде. Классификация белков. Среди белков различают протеины, состоящие только из белков, и протеиды — содержащие небелковую часть (например, гемоглобин). Кроме простых белков, состоящих только из аминокислот, есть еще и сложные, в состав которых могут входить углеводы (гликопротеиды), жиры (липопротеиды), нуклеиновые кислоты (нуклеопротеиды) и др.
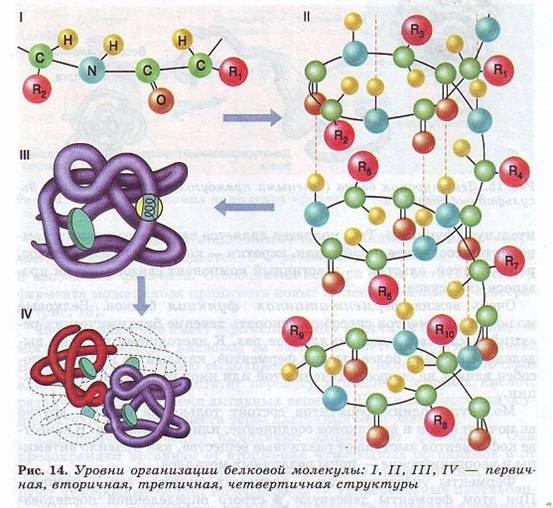
Уровни организации белковой молекулы. Молекулы белков могут принимать различные пространственные формы — конформации, которые представляют собой четыре уровня их организации (рис. 14).
Вторичная структура белков возникает в результате образования водородных связей между группами —СООН и —NH2 -разных аминокислотных остатков полипептидной цепи. Хотя водородные связи малопрочные, но благодаря их значительному количеству в комплексе они обеспечивают довольно прочную структуру. Третичная структура представляет собой причудливую, но для каждого белка специфическую конфигурацию, имеющую вид клубка (глобулу). Прочность третичной структуры обеспечивается ионными, водородными и дисульфидными ( - S-S-) связями между остатками цистеина, а также гидрофобным взаимодействием.
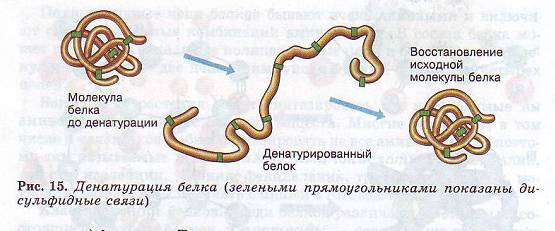
Она возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех таких субъединиц. Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникать под воздействием температуры, химических веществ, обезвоживания, облучения и других факторов. Если при денатурации не нарушена первичная структура, то при восстановлении нормальных условий белок способен воссоздавать свою структуру (рис. 15). Отсюда следует, что все особенности строения макромолекулы белка определяются его первичной структурой.
Белки выполняют целый ряд функций как в каждой клетке, так и в целом организме. Функции белков многообразны. Белки являются основой всех биологических мембран, всех органоидов клетки, таким образом они выполняют структурную (строительную ) функцию.- (Рис. 15.) . Так, коллаген является важным составным компонентом соединительной ткани, кератин — компонент перьев, волос, рогов, ногтей, эластин — эластичный компонент связок, стенок кровеносных сосудов.
Белковые молекулы ферментов способны ускорять течение биохимических реакций в клетке в сотни миллионов раз. К настоящему времени выделено и изучено более тысячи ферментов, каждый из которых способен влиять на скорость течения той или иной биохимической реакции. Молекулы одних ферментов состоят только из белков, другие включают белок и небелковое соединение, или кофермент, В качестве коферментов выступают различные вещества, как правило витамины и неорганические — ионы различных металлов. Ферменты участвуют как в процессах синтеза, так и распада. При этом ферменты действуют в строго определенной последовательности, они специфичны для каждого вещества и ускоряют только определенные реакции. Встречаются ферменты, которые катализируют несколько реакций. Избирательность действия ферментов на разные химические вещества связана с их строением. Каталитическая активность фермента определяется не всей его молекулой, а определенным участком молекулы фермента, который называется его активным центром. Субстрат взаимодействует с ферментом, причем связывание субстрата осуществляется именно в активном центре, Форма и химическое строение активного центра таковы, что с ним могут связываться только определенные молекулы в силу их пространственного соответствия, они подходят друг к другу, «как ключ к замку».
Так, гемоглобин переносит кислород из легких к клеткам других тканей. В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ. Белки-переносчики осуществляют перенос веществ через клеточные мембраны. Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов. Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы. Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет. Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков. Роль белка в жизни клетки огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счете набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Первую пробирку поместите в морозилку холодильника, вторую — на нижнюю полку холодильника, а третью — в банку с теплой водой (t = 40 °С). Через 30 мин достаньте пробирки и в каждую капните небольшое количество пероксида водорода. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. 2. Возьмите три пробирки и в каждую из них положите небольшое количество измельченного сырого картофеля. В первую пробирку с картофелем капните несколько капель воды, во вторую — несколько капель кислоты (столовый уксус), а в третью — щелочи. Пронаблюдайте, что будет происходить в каждой пробирке. Объясните полученные результаты. Сделайте выводы. Так как молекулы белков, построенные из аминокислот, необычайно велики и сложны, то для их изображения используют специальную общепринятую символику. Каждая аминокислота обозначается тремя латинскими буквами. Многие живые организмы способны вырабатывать одни аминокислоты из других и поэтому им не очень важно, какие аминокислоты содержатся в белках пищи. Но некоторые животные, в том числе человек, должны получать подавляющее число аминокислот с пищей, так как ряд аминокислот, называемых незаменимыми, в их организме не вырабатывается, но они необходимы для жизнедеятельности.
Каменский А. А., Криксунов Е. В., Пасечник В. В. Биология 10 класс
Онлайн библиотека с учениками и книгами, плани-конспекти уроков с Биологии 10 класса, книги и учебники согласно календарного плана планирование Биологии 10 класса Содержание урока
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: