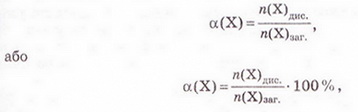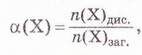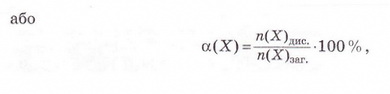|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Ступінь дисоціації. Сильні і слабкі електроліти
СТУПІНЬ ДИСОЦІАЦІЇ. СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ
Ступінь дисоціації. Сильні й слабкі електроліти
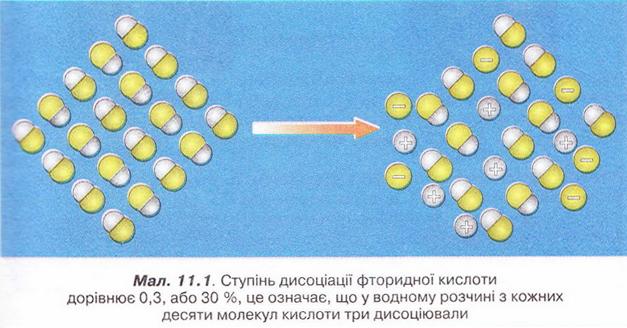
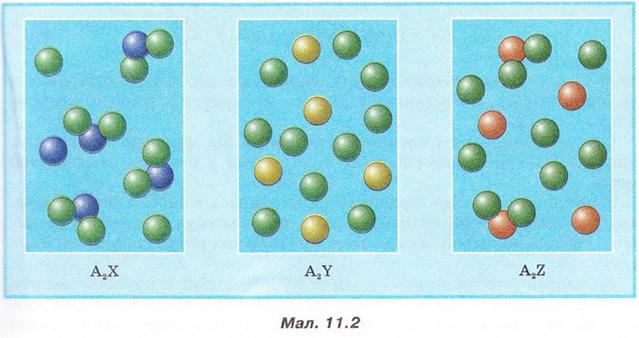
• Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Вивчаючи електролітичну дисоціацію, ми з'ясували, що це оборотний процес. Тобто поряд із розпадом кристалів або молекул на йони може відбуватися асоціація йонів. Адже гідратовані йони, які хаотично рухаються в розчині, можуть стикатися й знов сполучатися між собою. Наразі розгляньмо це питання докладніше. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули. Завдання Оцініть доцільність доповнення схеми на малюнку 3.2 компонентом «йонно-молекулярні розчини». Ступінь електролітичної дисоціації - це відношення числа молекул формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини. Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляємо «альфа»). її виражають у частках одиниці або у відсотках: де n(Х) дис. - число формульних одиниць електроліту, які розпалися на йони, а n(Х)заг. - загальне число формульних одиниць електроліту. Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1): а(НF) = 0,3(30 %) Завдання 1. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 100 молекул якої 15 розпалися на йони: А 0,15; Б 115; В 0,015; Г 1,5. 2. Виберіть співвідношення кількості дисоційованих і недисоційованих молекул кислоти, ступінь дисоціації якої 0,2 (20 %): А 1 : 5; Б 1 : 50; В 1 : 4; Г 1 : 8. Ступінь дисоціації електролітів визначають експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину. • Сильні й слабкі електроліти різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими. Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. З класифікацією кислот на сильні и слабкі ви ознайомилися минулого року (див. схему). Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів. Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С02 • Н20). Добре відомі вам з повсякденного Завдання Роздивіться малюнок 11.2 й розташуйте зображені на ньому електроліти за зростанням їхньої сили. Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води. Стисло про головне Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули. Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини. Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках: де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту. Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими. Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації. Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % . Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0. Застосуйте свої знання й уміння 1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення: A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини; 2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони: А 0,2; Б 20; В 0,02; Г 2. 3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %): A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2. 4. Виберіть слабкі електроліти: А HCl; Б H2S; В Н20; Г H2S04. 5. Виберіть сильну кислоту: А Бромідна; Б Сульфідна; В Молочна; Г Силікатна. 6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві? 7.Встановіть відповідність між електролітами та ступенем дисоціації.
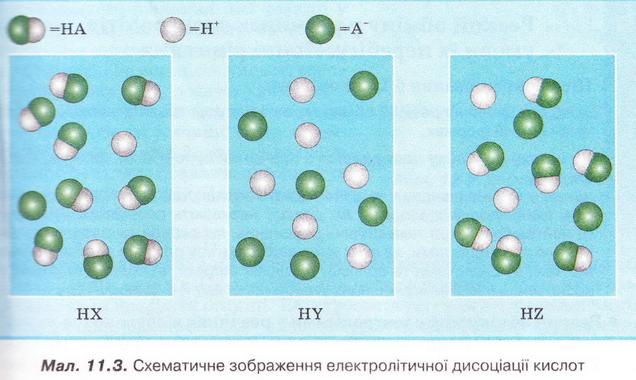
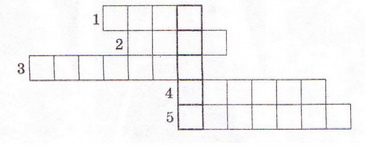
8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот. 9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом. Скарбничка досвіду Використовуючи прилад для дослідження електропровідності рідин, дослідіть електропровідність дистильованої води та розчинів, які трапляються у побуті ( див.§ 9). З'ясуйте, чи залежить електропровідність розчину від частки розчинюваної речовини у ньому, температури тощо. Які речовини, що їх розчини було досліджено, виявилися сильними електролітами? За результатами дослідження підготуйте презентацію.
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: