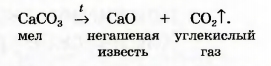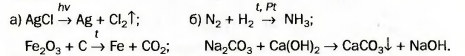|
Гипермаркет знаний>>Химия>>Химия 7 класс>> Схема химической реакции. Закон сохранения массы вещества при химической реакции. Химическое уравнение
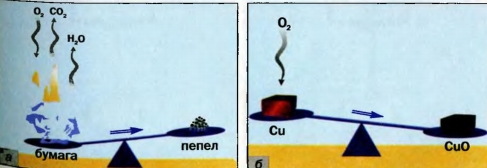
> выяснить, что такое схема химической реакции; Существует несколько способов записи химических реакций. Co «словесной» схемой реакции вы ознакомились в § 13. Приводим еще один пример: сера + кислород —> сернистый газ. Эта запись дает мало информации; она не указывает на химический состав реагентов и продуктов. Этого недостатка лишен другой способ записи — химическая схема реакции. В ней вместо названий веществ содержатся химические формулы1: S + O2 —> SO2. Химическую схему в дальнейшем будем называть просто схемой реакции. Над стрелкой часто указывают условия, при которых происходит реакция: нагревание 1Для серы здесь и далее будем использовать формулу S, а не Ss, которую в действительности имеют молекулы вещества. Если продуктом реакции является газ, то после его формулы записывают стрелку, направленную вверх Пример схемы реакции с дополнительными обозначениями и названиями веществ: ► Какими химическими элементами образовано исходное вещество и продукты этой реакции? Схема реакции дает возможность сделать важный вывод: все химические элементы во время реакции сохраняются. Общеизвестно, что после сжигания бумаги остается пепел, масса которого намного меньше массы бумаги. Если же сильно нагревать (прокаливать) порошок меди или медный предмет на воздухе, то обнаружим противоположное масса вещества будет возрастать (металл покроется черным налетом). Осуществим оба химических превращения в закрытых сосудах. Результаты опытов будут другими. Взвесив закрытые сосуды с веществами до и после каждого эксперимента, обнаружим, что суммарная масса веществ в результате реакций неизменяется. Это впервые установил в середине XVIII в. русский ученый М. В. Ломоносов. He зная об открытии Ломоносова, к аналогичному выводу пришел в 1789 г. французский ученый А.-Л. Лавуазье.
Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Он формулируется так: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. Объясним, почему массы пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания. В процессе горения бумаги принимает участие кислород, который содержится в воздухе (рис. 48, а). Следовательно, в реакцию вступают два вещества. Кроме пепла, образуются углекислый газ и вода (в виде пара), которые попадают в воздух и рассеиваются.
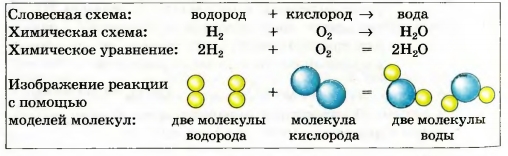
Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение — это реакция вещества с кислородом, а вода — соединение Гидрогена с Оксигеном (1774— 1777). Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химических реакциях. При нагревании меди кислород воздуха «соединяется» с ней (рис. 48, б). Металл превращается в вещество черного цвета (его формула — CuO, а на звание — купрум(П) оксид). Очевидно, что масса продукта реакции должна превышать массу меди. ► Прокомментируйте опыт, изображенный на рисунке 49, и сделайте вывод. Открытие законов в химии, физике, других науках происходит после проведения учеными многих экспериментов и анализа полученных результатов. Закон — это обобщение объективных, независимых от человека связей между явлениями, свойствами и т. д. Закон сохранения массы веществ при химической реакции — важнейший закон химии. Он распространяется на все превращения веществ, которые происходят и в лаборатории, и в природе. Химические законы дают возможность прогнозировать свойства веществ и протекание химических реакций, регулировать процессы в химической технологии. Для того чтобы объяснить закон, выдвигают гипотезы, которые проверяют с помощью соответствующих экспериментов. Если одна из гипотез подтверждается, на ее основе создают теорию. В старших классах вы ознакомитесь с несколькими теориями, которые разработали ученые-химики. Общая масса веществ при химической реакции не изменяется потому, что атомы химических элементов во время реакции не возникают и не исчезают, а происходит только их перегруппировка. Другими словами, Химическое уравнение — это запись химической реакции с помощью формул реагентов и продуктов, которая согласуется с законом сохранения массы веществ. Существует много схем реакций^ которые не соответствуют закону Ломоносова — Лавуазье. Например, схема реакции образования воды: H2 + O2 —> H2O. В обеих частях схемы содержится одинаковое количество атомов Гидрогена, но разное количество атомов Оксигена. Превратим эту схему в химическое уравнение. Для того чтобы в правой части было 2 атома Оксигена, поставим перед формулой воды коэффициент 2: H2 + O2 —> H2O. Теперь справа стало четыре атома Гидрогена. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение: 2Н2 + O2 = 2Н20. Таким образом, чтобы превратить схему реак ции в химическое уравнение, нужно подобрать коэффициенты для каждого вещества ( в случае необходимости), записать их перед химическими формулами и заменить стрелку на знак равенства. Возможно, кто-то из вас составит такое уравнение: 4Н2 + 202 = 4Н20. В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать. Химическое уравнение имеет много общего с математическим. Ниже представлены различные способы записи рассмотренной реакции. Выполним более сложное задание: превратим в химическое уравнение схему реакции В левой части схемы — I атом Алюминия, а в правой — 2. Поставим перед формулой металла коэффициент 2: Атомов Сульфура справа в три раза больше, чем слева. Запишем в левой части перед формулой соединения Сульфура коэффициент 3: Теперь в левой части количество атомов Гидрогена равно 3 • 2 = 6, а в правой — только 2. Для того чтобы и справа их было 6, поставим перед формулой водорода коэффициент 3 (6 : 2 = 3): Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 3 • 4 = 4 * 3. Заменим стрелку на знак равенства: Химические реакции записывают с помощью схем реакций и химических уравнений. Схема реакции содержит формулы реагентов и продуктов, а химическое уравнение — еще и коэффициенты. Химическое уравнение согласуется с законом сохранения массы веществ Ломоносова — Лавуазье: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. Атомы химических элементов во время реакций не появляются и не исчезают, а происходит лишь их перегруппировка. 106. Расставьте пропущенные коэффициенты в записях реакций: 107. Превратите в химические уравнения такие схемы реакций: 108. Составьте формулы продуктов реакций и соответствующие химические уравнения: 109. Вместо точек запишите формулы простых веществ и составьте хими ческие уравнения: Примите во внимание, что бор и углерод состоят из атомов; фтор, хлор, водород и кислород — из двухатомных молекул, а фосфор (белый) — из четырехатомных молекул. 110. Прокомментируйте схемы реакций и превратите их в химические уравнения: 111. Какая масса негашеной извести образовалась при длительном прока ливании 25 г мела, если известно, что выделилось 11 г углекислого газа?
Попель П. П., Крикля Л. С., Хімія: Підруч. для 7 кл. загальноосвіт. навч. закл. — К.: ВЦ «Академія», 2008. — 136 с.: іл. Содержание урока Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: