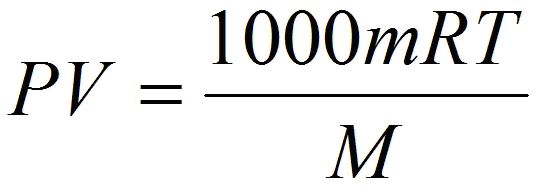|
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Уравнение состояния идеального газа
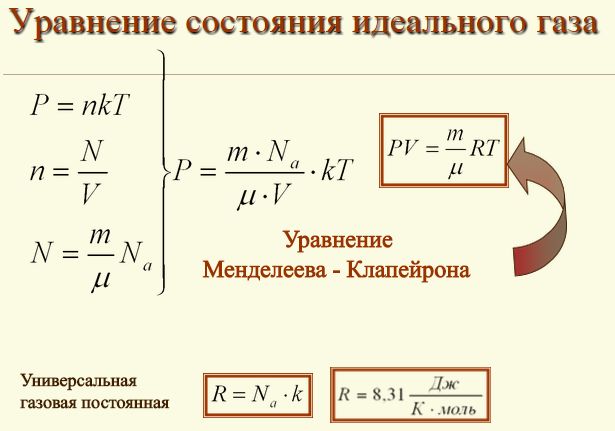
Состояние идеального газаСегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Однако, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и соответственно они немного зависимы друг от друга. При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. Поэтому газовые законы и их следствия, как правило, не нарушаются лишь для разреженных реальных газов. То есть, для газов, расстояние между частицами которых ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. При таких обстоятельствах частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. Уравнение состояния идеального газаА вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, принято называть уравнением состояния идеального газа. К таким нулевым параметрам, без которых невозможно определить состояние газа, является: • К первому параметру относится давление, которое обозначают символом - Р; А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще принято называть уравнением Клапейрона-Менделеева. Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. PV = nRT Такое уравнение и называется уравнением состояния идеального газа. где: n – является числом молей газа; Впервые уравнение, которое помогает установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот Дмитрий Иванович Менделеев, великий русский ученый, в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. Также, следует обратить внимание на то, что когда объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете понятие о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: