|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Хімічні властивості кислот: взаємодія з основними оксидами та основами, солями. Класифiкація кислот. Реакції заміщення й обміну. Використання кислот. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуВзаємодія кислот з основними оксидами, основами, солямиРеакції заміщення й обміну. Кислотами з позиції теорії електролітичної дисоціації називаються речовини, які дисоціюють у розчинах з утворенням йонів водню. Найбільш характерною хімічною властивістю кислот є їх здатність реагувати з основами (а також амфотерними оксидами) з утворенням солей, наприклад: H2SO4 + 2NaOH = Na2SO4 + 2H2O 2HNO3 + FeO = Fe(NO3)2 + H2O 2HCL + ZnO = ZnCl2 + H2O В результаті останньої реакції утворюється хлорид цинку. Мал. 1. Хлорид цинку. Процес гідролізу солей можна спостерігати при взаємодії сильної основи та слабкої кислоти. Для цього пропонуємо вам переглянути наступне відео. Відео 1. Взаємодія сильної основи і слабкої кислоти.
Взаємодія кислот з солями: В результаті останньої реакції обміну утворюється сульфат натрію. Мал. 2. Сульфат натрію. Щоб простежити та проаналізувати взаємодію кислот з розчинами солей, до вашої уваги наступне відео. Відео 2. Кислоти і розчини солей.
Контролюючий блок 1
Класифікація кислотКислоти класифікують за їх силою, за основністю та по наявності або відсутністю кисню у складі кислоти. За силою кислоти поділяють на сильні та слабкі. Найважливішими сильними кислотами є азотна HNO3, сірчана H2SO4 і соляна HCL. За наявністю кисню розрізняють оксигеновмісні кислоти (HNO3, H3PO4 і т.д.) та безоксигенні кислоти (HCL, H2S, HCN і т. д.). За основністю, тобто за кількістю атомів водню в молекулі кислоти, здатних заміщуватися атомами металу з утворенням солі, кислоти поділяють на одноосновні (наприклад, HCL, HNO3), двоосновні (H2S, H2SO4), триосновні (H3PO4) і т.д. Назви безоксигенних кислот утворюють, додаючи до кореня української назви утворюючого кислоту елемента суфікс «о» і закінчення «водень»; HCL – хлороводень, H2Se – селеноводень. Мал. 3. Структура селеноводню. Контролюючий блок 2:
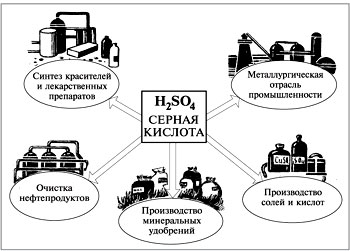
Використання кислотАзотна кислота широко використовується для виробництва добрив, барвників, лаків, пластмас, лікарських та вибухових речовин, а також хімічних волокон. Мал. 4. Азотна кислота. Сірчана кислота витрачається у великих кількостях для виробництва мінеральних добрив,барвників, хімічних волокон, пластмас,лікарських речовин. Використовується для видобування металів з руд; заповнення кислотних акумуляторів. Знаходить застосування у нафтовій промисловості для очищення нафтопродуктів. Мал.5. Використання сірчаної кислоти. Щоб краще зрозуміти властивості азотної та сірчаної кислоти, пропонуємо вам переглянути наступне відео. Відео 3. Вплив азотної та сірчаної кислоти на залізо.
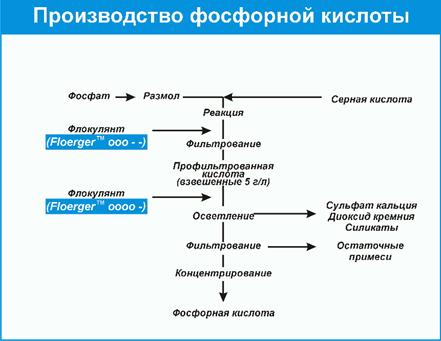
Фосфорна кислота використовується у складах для знежирення металевих поверхонь перед нанесенням захисних покриттів,входить до складу композицій для перетворення іржі перед фарбуванням, застосовується для захисту від корозії трубопроводів, що прокачують морську воду. Мал. 6. Вироблення фосфорної кислоти. Соляна кислота широко застосовується в нафтовій промисловості для обробки привибійних зон свердловин з метою збільшення нафтовіддачі пластів, використовується у складах травильних розчинів для видалення іржі і відкладень у трубопроводах і свердловинах, а також як затверджував фенол-формальдегідних смол. Контролюючий блок 3
Домашнє завданняЗнайдіть в додаткових джерелах як використовується у повсякденному житті нітратна кислота. Цікаво знати, що…Налийте у невеликий циліндр (на 250 мл) 4-5 см концентрованої сульфатної кислоти. Обережно (щоб рідини не змішались) налийте зверху приблизно таку ж кількість чистого спирту. Досипайте до рідини потроху дрібно розтертого калій перманганату. На межі між сульфатною кислотою та спиртом через кілька хвилин з’являються вогники у вигляді феєрверку – це загоряється спирт від кисню, що виділяється при взаємодії калій перманганату з кислотою. Реакція супроводжується спалахами та тріском. Список використаних джерел1. Урок на тему «Кислоти, їх основні властивості» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Сискова Р.Ф. Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: