|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Поняття про амфотерні гідроксиди
Тобі вже відомо, що метали і неметали утворюють оксиди, яким відповідають певні основи або кислоти, наприклад:
C → CO2 → H2CO3
Типовий Кислотний Кислота
неметал оксид
Хімічні елементи-неметали, оксиди й гідрати оксидів яких виявляють тільки кислотні властивості, називають типовими неметалами. Наприклад, S, N, Р, СІ тощо.
Са → СаО → Са(ОН)2
Типовий Основний Основа
метал оксид
Хімічні елементи-метали, оксиди й гідроксиди яких виявляють тільки основні властивості, називають типовими металами. Наприклад, Na, К, Ва, Са, Mg тощо.
Є ще й такі елементи, оксиди й гідроксиди яких здатні виявляти подвійні властивості — як кислотні, так і основні. До них належить Цинк. Його гідроксид, реагуючи з кислотою, виявляє основні властивості, а реагуючи з лугом, — кислотні.
Здатність речовини виявляти кислотні або основні властивості залежно від природи сполуки, з якою вона взаємодіє, називається амфотерністю.
Аби переконатися в цьому, виконай лабораторні досліди.
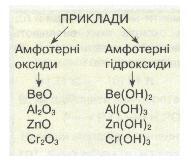
Мал. 9. Приклади амфотерності.
Дослід 1. У пробірку з розчином цинк хлориду ZnCI2 додавай краплями розчин лугу NaOH. Після додавання кожної краплі розчину лугу злегка струшуй пробірку. Незабаром вона заповниться білим осадом цинк гідроксиду Zn(OH)2 у вигляді драглистої маси або пластівців:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Дослід 2. Розділи вміст пробірки разом з утвореним осадом на дві порції, переливши половину в іншу пробірку. До однієї порції додай трохи розбавленої хлоридної кислоти, а до другої — розчин лугу. Що спостерігаєш? Чому осад зник, розчинився? Що це засвідчує? Напиши рівняння відповідних реакцій і зроби висновок про властивості (основні чи кислотні), що їх виявляє цинк гідроксид під час взаємодії з кислотою таз лугом.
Амфотерна речовина, реагуючи з сильною кислотою, виявляє основні властивості, а реагуючи з сильною основою (лугом), — кислотні
Алюміній виявляє подвійні властивості. Він реагує з виділенням водню як з кислотами, так і з лугами (у водному розчині та в розплаві)
Як було помітно, осад цинк гідроксиду розчинився в обох пробірках. Отже, цинк гідроксид Zn(OH)2 прореагував і з кислотою, і з лугом. Якщо Zn(OH)2 реагує з кислотою, то він поводить себе як основа, утворюючи сіль і воду:
Zn(OH)2 + 2НСl = ZnCl2 + 2Н2O
Цинк хлорид
Якщо ж цинк гідроксид Zn(OH)2 реагує з лугом, то він поводить себе як кислота H2Zn02. Так, під час сплавляння з типовим лугом цинк гідроксид виявляє кислотні властивості, утворюючи також сіль і воду:
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2Н2O (H2ZnO2)
Натрій цинкат
У розчинах процес зв'язаний не тільки із заміщенням атомів Гідрогену в Zn(OH)2 на метал, а переважно з приєднанням гідроксид-іонів до молекул гідроксиду. Тому утворюються гідроксоцинкати (гідроксосолі слабких кислот):
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Натрій тетрагідроксоцинкат
Отже, цинк гідроксид Zn(OH)2 легко взаємодіє і з кислотами з утворенням солей цинку, і з надлишком лугу з утворенням цинкатів. Це означає, що цинк гідроксид — амфотерна сполука.
Такі ж подвійні властивості виявляє й цинк оксид:
ZnO + 2HNO3 = Zn(NO3)2 + Н2O
Цинк нітрат
ZnO + 2КОН = K2ZnO2 + Н2O
Калій цинкат
У реакції з кислотою цинк оксид виявляє властивості основного оксиду, а в реакції з лугом — кислотного оксиду. Отже, ZnO — амфотерний оксид.
Багато хімічних елементів утворюють амфотерні оксиди, наприклад ВеО, Аl203, Сr203, і відповідні їм амфотерні гідроксиди Ве(ОН)2, Аl(ОН)3, Сr(ОН)3.
Для Алюмінію, на відміну від інших елементів, характерно, що не тільки його оксид Аl203 і гідроксид АІ(ОН)3 — амфотерні сполуки, а й сам алюміній може виявляти подвійні властивості. Він реагує з виділенням водню як з кислотами, так і з лугами (у водному розчині і в розплаві):
2Аl + 6НСl = 2АlСlз + ЗН2
Алюміній хлорид
2Аl + 6Н2O + 2NaOH = 2Na[Al(OH)4] + ЗН2
Натрій тетрагідроксоалюмінат
2Аl + 6NaOH (розплав) = 2Na3AlO3 + ЗН2
Натрій ортоалюмінат
ВИСНОВКИ
Під амфотерністю розуміють здатність хімічної сполуки виявляти кислотні або основні властивості залежно від природи іншої сполуки, яка бере участь у кислотно-основній взаємодії.
Амфотерна речовина, реагуючи з сильною кислотою, виявляє основні властивості, а реагуючи з сильною основою (лугом) — кислотні.
Типовими амфотерними гідроксидами є Zn(OH)2, Ве(ОН)2, Аl(ОН)3, Сr(ОН)3 тощо.
Завдання для самоконтролю
1. У чому полягає суть амфотерності? Поясни на конкретному прикладі.
2. Як здійснити такі перетворення: Zn → ZnO → Zn(N03)2 → Zn(OH)2 → Na2Zn02? Напиши відповідні рівняння реакцій і зазнач назви продуктів реакції.
3. Для добування цинк гідроксиду можна використати реакцію, що відбувається за схемою
(а) ZnO + Н20
(в) ZnCl2 + NaOH
нестача
(б) ZnCl2 + NaOH
надлишок
(г) ZnO + NaOH
розчин
Додаткові завдання
4*. На сплавляння берилій гідроксиду з лугом витрачено калій гідроксид масою 28 г. Кількість речовини калій берилату, що утворився при цьому, становить
(а) 1 моль; (б) 0,5 моль; (в) 0,25 моль; (г) 0,125 моль.
5*. Змішали розчин, що містить цинк нітрат кількістю речовини 2 моль, з розчином, що містить натрій гідроксид кількістю речовини 8 моль. Маса утвореної при цьому солі дорівнює
(а) 340 г; (б) 349 г; (в) 179 г; (г) 698 г.
6*. Визнач масову частку алюмінію і магнію в їхньому сплаві з міддю, якщо відомо, що внаслідок дії на сплав масою 2,6 г розчином лугу виділився водень об'ємом 1,12 л (н. у.), а при дії на таку саму масу сплаву хлоридної кислоти виділяється водень об'ємом 2,24 л (н. у.).
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Завдання та відповіді з хімії по класам, планування уроків для вчителів, конспекти та реферати для школярів
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












