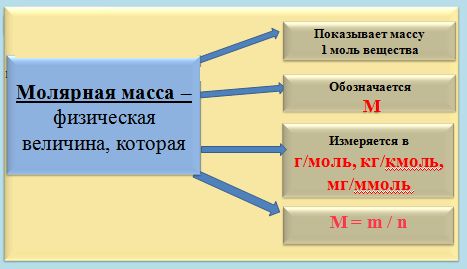
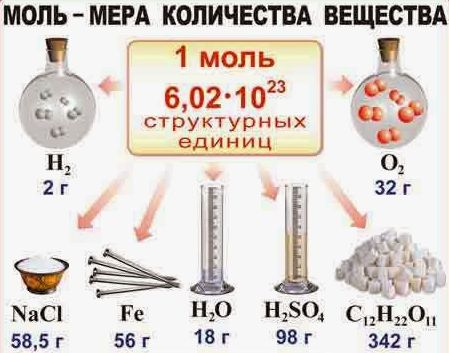
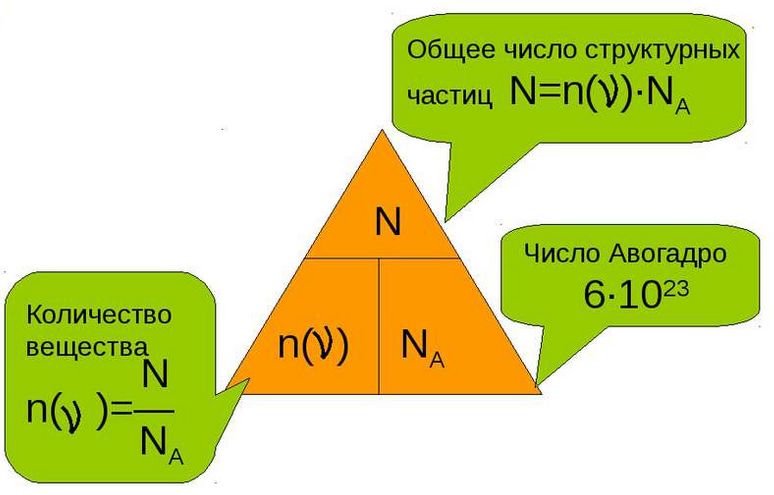
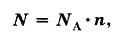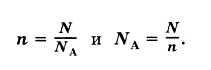Текущая версия на 11:02, 6 сентября 2015Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Количество вещества Как измерить количество вещества?Всем нам известно, что химия является той наукой, которая изучает вещества. А интересовал ли вас когда-нибудь вопрос, каким способом можно измерить вещество и в каких единицах это лучше всего делать? Сразу оговорюсь, что такие варианты, как измерять вещество в граммах, килограммах или миллиграммах – не подходит, так как это единицы измерения массы. Но мы все прекрасно понимаем, что во всех химических процессах берут участие такие мельчайшие частицы, как молекулы, атомы, электроны и ионы. А так как вещество состоит из этих частиц, то может, неплохо было бы измерять вещество просто отсчитывать нужное число молекул? Но скажу наперед, что этот вариант не проходит, так это сделать довольно таки сложно. Ведь вам уже известно, что таких частиц в веществе просто огромное количество. И чтобы избежать математических манипуляций с большими числами и чтобы определить количество вещества, которое участвует в химической реакции, придумали специальную единицу, которую назвали моль, что в переводе с французского обозначает «множество». В этой особой единице в какой-то степени объединились и число молекул, и масса вещества. Моль, молярная массаА теперь рассмотрим измерение вещества в молях более подробно. Если мы с вами, например, хотим отмерить один моль вещества, то нам необходимо столько его граммов, сколько его относительная атомная масса (Аr.) вещества или же, относительная молекулярная масса (Mr) вещества. Но чтобы было еще более понятно, давайте попробуем измерить массу вещества на конкретном примере. Так, к примеру, если: • 1 моль воды имеет массу, которая равна 18 г, то относительная молекулярная масса Мr(Н20) = 18; • 1 моль кислорода имеет массу, равную 32 г, так как Мr(02) = 32; • 1 моль железа имеет массу, равную 56 г, так как Mr(Fe) = 56. То есть, из этого следует, что если нам необходимо отмерить 2 моль воды, то нам нужно 18 × 2 и мы получим 36 г. А как нам поступить, если нужно отмерять 0,5 моль кислорода? Здесь нам известно, что масса кислорода в два раза меньше массы 1 моль, значит нам нужно 32 : 2. и мы получим 16 г. А если было отмерено 45 г воды, то сколько молей воды нам нужно взять? Оказывается, что все очень просто и в этом случае нужно взять эту массу и разделить на массу 1 моль воды. То есть, мы берем 45 г, и делим их на 18 г/моль и в итоге получается, что мы взяли 2,5 моль. Какая связь количества вещества с числом его молекул?Следует помнить, что один моль какого-либо вещества, всегда содержит одинаковое количество молекул, которой является очень удобная пропорция, равная: Это число называется постоянной Авогадро, в честь итальянского ученого А. Авогадро. А обозначают эту постоянную NA. И в том случае, если N равняется числу частиц, а именно: то нам уже известно, что их вес равен весу этих частиц в а.е.м. Из этого всего следует, что 1 моль воды равен массе в 18 г и содержит 6 × 1023 молекул воды. Тогда, когда 1 моль кислорода 02 равен массе в 32 г и точно также содержит 6 × 1023 молекул кислорода. А из этого можно сделать вывод, что в 2 моль воды и любого вещества насчитывается 12 × 1023 молекул, ну и естественно, что в 0,5 моль содержаться 3 × 1023 молекул. Поэтому, для того чтобы узнать число молекул (N), которые присутствуют в определённом количестве вещества, необходимо воспользоваться такой формулой: в которой: N – указывает на число частиц; Следуя из этой формулы, будут верными и следующие неравенства: Вот мы и подошли с вами к определению, из которого следует, что моль является тем количеством вещества, в котором содержаться 6 × 1023 молекул этого вещества. Также, вам необходимо помнить, что в молях можно измерить не только число молекул, но и число атомов, ионов, электронов и т. д.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: