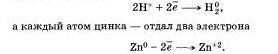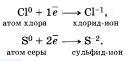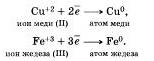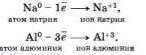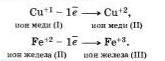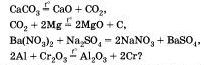|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Окислительно-восстановительные реакции Многообразие классификаций химических реакций по различным признакам (фазе, направлению, числу и характеру реагирующих и образующих веществ, использованию катализатора, тепловому эффекту) можно дополнить еще одним признаком. Этот признак — изменение степени окисления атомов химических элементов, образующих реагирующие вещества. Например, в реакции
степени окисления атомов химических элементов после реакции не изменились. А вот в другой реакции — взаимодействие соляной кислоты с цинком
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк с 0 на +2. Следовательно, в этой реакции каждый атом водорода получил по одному электрону:
Химические реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества, называют окислительно-восстановительными реакциями.
Электроны могут присоединяться и к положительным ионам, превращая их при этом в атомы:
Принимать электроны могут и положительные ионы, у которых при этом степень окисления понижается.
Атомы, ионы или молекулы, принимающие электроны, называются окислителями.
Отдавать свои электроны могут отрицательные ионы.
Терять электроны могут и некоторые положительные ионыс низшими степенями окисления.
Можно отметить, что при этом степень окисления повышается. Атомы, ионы или молекулы, отдающие электроны, называются восстановителями. Окисление всегда сопровождается восстановлением и наоборот, то есть окислительно-восстановительные реакции представляют собой единство двух противоположных процессов — окисления н восстановления. Схема взаимосвязи изменения степеней окисления с процессами окисления и восстановления может быть представлена так, как это изображено на схеме ниже.
Молекулярное уравнение этой реакции написать уже несложно, так как коэффициенты для него будут взяты из электронных уравнений.
Подчеркнем знаки химических элементов, изменивших свои степени окисления.
Составим электронные уравнения, то есть отразим процессы отдачи и присоединения электронов:
Ставим коэфициент 3 перед Cu и перед формулой нитрата меди, в котором Cu +2, так как с такими значениями степеней окисления медь встречается по одному разу.
Проверим правильность расстановки коэффициентов, подсчитав число атомов кислорода до и после реакции: до реакции — 24 атома и после реакции — 24 атома. Коэффициенты расставлены правильно, поэтому заменим в уравнении стрелку на знак равенства:
Зная формулу вещества и определив степени окисления атомов химических элементов в нем. нетрудно предсказать, какие свойства будет проявлять каждый элемент и вещество в целом: окислительные или восстановительные. Например, азот в азотной кислоте имеет максимальное значение степени окисления +5, то есть он "потерял" все электроны, поэтому азот и азотная кислота будут проявлять только окислительные свойства.
1. Окислительно-восстановнтельные реакции. 2. Окислитель и восстановитель; окисление и восстановление. 3. Метод электронного баланса. Какие из реакций, уравнения которых записаны ниже, относятся к окислительно-восстановительным:
Для окислительно-восстановительных реакций укажите окислитель и восстановитель, процессы окисления и восстановления, составьте электронные уравнения.
Назовите окислитель в реакциях взаимодействия цинка с соляной и азотной кислотами.
Содержание урока
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: