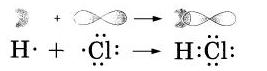|
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Степень окисления
Бинарные или двухэлементные, соединенияВы уже знакомились с бинарными соединениями, когда изучали ионные и ковалентные полярные химические связи. Также вам уже известно, что эти сложные вещества состоят из двух химических элементов, поэтому их и называют двухэлементными соединениями или бинарными, так как в переводе с латинского, приставка «би» обозначает «два». Когда мы с вами проходили изучение ионной и ковалентной связи, нам такие соединения уже встречались. Давайте для более доступного понимания механизмов образования ионной и ковалентной полярной химической связи приведем типичные примеры бинарных соединений: NaHl — хлорид натрия и НСl — хлороводород. Перед нами типичный случай ионной связи, где при образовании молекулы, атом натрия передал свой электрон атому Cl и в итоге получился ион с отрицательным зарядом -1, а атом Cl принял электрон и превратился в ион с зарядом -1. То есть, они оба превратились в ионы Na+ и Cl-. Теперь давайте посмотрим, как этот процесс будет выглядеть схематически: То есть, мы видим, что связь, образовывается в молекуле НСl за счет спаривания неспаренных внешних электронов, а также за счет образования общей электронной пары атомов водорода и хлора. Образование ковалентной связи в молекуле НСl было бы правильнее представить, как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома Сl. Схематично это будет выглядеть так: При химическом взаимодействии, то есть, при образовании молекулы HCl, как правило, общая пара электронов оказывается, смещена в сторону к атому Cl, так как он является более электроотрицательным, а на атомах появляются частичные заряды: Вот такие условные заряды и носят название степени окисления. То есть, из этого понятия следует, что связующие электроны, находящиеся в ковалентных полярных соединениях, полностью перешли к более электроотрицательному атому, а из этого следует, что данные соединения состоят только из положительно и отрицательно заряженных ионов. Из этого следует следующее определение, что степенью окисления называется такой условный заряд, который могли бы приобрести атомы, если предположить, что в такой окислительно-восстановительной реакции одним атомам свойственно отдавать данное число электронов, а другим – присоединять. Определение степени окисленияЧтобы определить степени окисления, необходимо следовать следующим правилам: • Во-первых, степень окисления может быть положительным, отрицательным или равным нулю. Как правило, такие символы принято обозначать арабской цифрой, которая может быть со знаком «+» или «-» и обычно он ставиться сверху над символом элемента. Вот как наглядно это будет выглядеть: • Во-вторых, те атомы, которые получили электроны от других атомов или же к которым электронные пары смещены, имеют отрицательное значение степени окисления. Так, например, фтор во всех видах соединений, имеет степень окисления -1. А вот, кислород, практически всегда имеет степень окисления -2, за исключением того, если он соединен с фтором: • В-третьих, атомы, отдающие свои электроны другим атомам или же атомы, которые относятся к менее электроотрицательным элементам, всегда имеют положительное значение степени окисления. Так, например, металлам свойственно всегда иметь положительную степень окисления. Металлы во всех соединениях имеют степень окисления в группах: I группа = +1, Давайте рассмотрим пример: • В-четвертых, при определении степеней окисления, в соединениях суммарная степень окисления всегда равна нулю. Из этого правила следует, что зная степень окисления одного из элементов, не составит особого труда найти степень окисления другого элемента, используя для этого формулу бинарного соединения. Давайте это более подробно рассмотрим на примере: Припустим, нам нужно найти степень окисления Сl в соединении Сl2О2. Теперь, давайте обозначим степень окисления -2 кислорода: Сl2О2. Из этого всего следует, что 7 атомов кислорода имеют общий отрицательный заряд: (-2) • 7 =14. А из этого следует, что общий заряд 2-х атомов Сl равняется +14, а 1-го атома хлора: (+14):2 = +7. • В-пятых, аналогично, степень окисления атомов будет равна нулю, соединение образовано атомами 1-го элемента. Давайте для наглядного примера составим формулу соединения карбида алюминия Al4C3. Так, как нам известно, что алюминий является металлом, то вначале пишем знак алюминия, а потом рядом АlС – углерода. Далее при помощи таблицы Менделеева определяем число внешних электронов. Смотрим, что у нас выходит: у Аl — 3 электрона, у С — 4. Мы видим, что атом алюминия отдает свои электроны, а их 3, углероду и получит степень окисления +3, которая равна заряду иона. В отличие от алюминия, атом углерода принимает недостающие четыре электрона и получит степень окисления – 4. Теперь осталось записать данные значения в формулу и найти наименьшее кратное, которое = 12. После этого можем рассчитать индексы: Химическая номенклатураДля каких же целей нужно знать степени окисления элементов? А оказывается все банально просто, их необходимо знать, чтобы правильно называть химическое соединение. А, как вам уже известно, что названия бинарных соединений состоят из двух частей. Как правило, первое слово бинарного соединения обозначает неметалл, то есть, его электроотрицательную часть. А вот второе слово обозначает металл и является электроположительным. В том случае, когда электроположительный элемент выявляет разные степени окисления, то в конце его названии степень окисления обозначают римской цифрой. Для более четкого понимания терминологии и номенклатуры химических веществ была создана такая единая система. В ее создании принимали участие известные французские химики. В данный момент этим вопросом занимается Международный союз (ИЮПАК), который координирует деятельность химиков в разных странах мира, а также издает свои рекомендации по тем терминам, которые используются в химии. Домашнее задание |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: