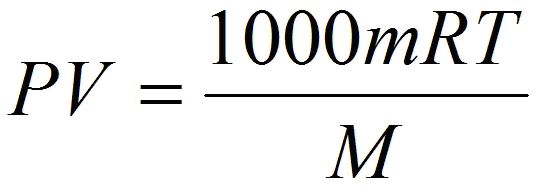|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> | | <metakeywords>Физика, 10 класс, Уравнение состояния, идеального газа</metakeywords> |
| | | | |
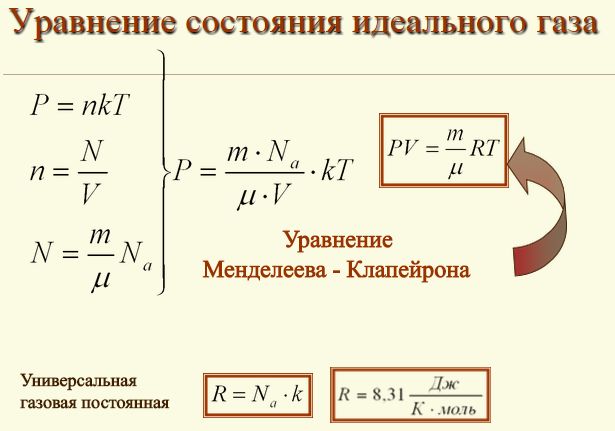
| - | Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением ''p'', объемом ''V'' и [[Определение_температуры|температурой]] ''T''. Сейчас мы найдем между ними связь, а затем посмотрим, для чего эта связь нужна.<br> '''Уравнение состояния.''' Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу 9.10). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра ''p'', ''V'' и ''T'', характеризующие состояние достаточно разреженного газа данной массы. Это уравнение называют ''уравнением состояния идеального газа.''<br> Подставим в уравнение ''p=nkT ''выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:<br>[[Image:A68-1.jpg|center|236x37px|A68-1.jpg]]где ''N<sub>A</sub>'' - постоянная [[Тема_2._Кількість_речовини._Моль_—_одиниця_кількості_речовини._Число_Авогадро|Авогадро]]; ''m'' - масса газа; ''M'' - его молярная масса.<br> После подстановки формулы (10.1) в выражение (9.10) будем иметь<br>[[Image:A68-2.jpg|center|213x32px|A68-2.jpg]] Произведение постоянной Больцмана ''k'' и постоянной Авогадро ''N<sub>A</sub>'' называют '''универсальной (молярной) газовой постоянной''' и обозначают буквой ''R'':<br>[[Image:A68-3.jpg|center|508x41px|A68-3.jpg]] Подставляя в уравнение (10.2) вместо ''kN<sub>A</sub>'' универсальную газовую постоянную ''R'', получим уравнение состояния для идеального газа произвольной массы:<br>[[Image:A68-4.jpg|center|215x47px|A68-4.jpg]] Единственная величина в этом уравнении, зависящая от рода газа, - это его молярная масса.<br> Из ''уравнения состояния'' вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях.<br> Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 - параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы<br>[[Image:A68-5.jpg|center|256x43px|A68-5.jpg]] Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:<br>[[Image:A68-6.jpg|center|289x41px|A68-6.jpg]] ''Уравнение состояния'' в форме (10.5) называется ''уравнением Клапейрона'' и представляет собой одну из форм записи уравнения состояния.<br> ''Уравнение состояния'' в форме (10.4) было впервые получено великим русским ученым Д. И. Менделеевым. Его называют уравнением [[Периодическая_система_химических_элементов_Д._И._Менделеева._Полные_уроки|Менделеева]] - Клапейрона.<br> '''Для чего нужно уравнение состояния?''' Не только идеальный газ, но и любая реальная система - газ, жидкость, твердое тело - характеризуется своим уравнением состояния. Но только эти уравнения намного сложнее, чем уравнение Менделеева - Клапейрона для идеального (достаточно разреженного) газа.<br> Знать уравнение состояния необходимо при исследовании [[Почему_тепловые_явления_изучаются_в_молекулярной_физике|тепловых явлений]]. Оно позволяет полностью или частично ответить сразу на три группы различных вопросов.<br> 1. Уравнение состояния позволяет определить одну из величин, характеризующих состояние, например температуру, если известны две другие величины. Это и используют в термометрах.<br> 2. Зная уравнение состояния, можно сказать, как протекают в системе различные процессы при определенных внешних условиях: например, как будет меняться давление газа, если увеличивать его объем при неизменной температуре, и т. д. Этому посвящен следующий параграф.<br> 3. Наконец, зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел. Об этом пойдет речь в конце раздела «Молекулярная физика. Тепловые явления».<br> Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной: ''R''=8,31Дж/(моль•К).<br><br><br> ???<br> 1. Что называют уравнением состояния?<br> 2. Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева - Клапейрона?<br> 3. Почему газовая постоянная ''R'' называется универсальной?<br>
| + | '''Уравнение состояния идеального газа''' |
| | | | |
| - | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, [[Физика,_химия,_космология|Физика]] 10 класс'' | + | <h2>Состояние идеального газа</h2> |
| | | | |
| - | <br> <sub>Материалы [[Физика и астрономия|по физике]], планирование по физике, задания и ответы по классам, планы конспектов уроков [[Физика 10 класс|по физике для 10 класса]]</sub>
| + | Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Но, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и поэтому имеют некую зависимость друг от друга. |
| | | | |
| - | '''<u>Содержание урока</u>'''
| + | При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. В связи с этим газовые законы, а также следствия из них, как правило, не нарушаются только для разреженных реальных газов. То есть, для газов, у которых расстояние между частицами ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально. |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии
| + | |
| - |
| + | |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие
| + | |
| - |
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''
| + | |
| - |
| + | |
| | | | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют. |
| | | | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. В этом случае частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой. |
| | + | |
| | + | <h2>Уравнение состояния идеального газа</h2> |
| | + | |
| | + | А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, называют уравнением состояния идеального газа. |
| | + | |
| | + | К таким нулевым параметрам, без которых невозможно определить состояние газа, является: |
| | + | |
| | + | • К первому параметру относится давление, которое обозначают символом - Р;<br> |
| | + | • Второй параметр – это объем –V;<br> |
| | + | • И к третьему параметру относится температура – Т.<br> |
| | + | |
| | + | Как вам уже известно, из предыдущего раздела нашего урока, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных. |
| | + | |
| | + | А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще имеет и другое название, его еще называют уравнением Клапейрона-Менделеева. |
| | + | |
| | + | Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа. |
| | + | |
| | + | PV = nRT |
| | + | |
| | + | Такое уравнение и называется уравнением состояния идеального газа. |
| | + | |
| | + | где: |
| | + | |
| | + | n – является числом молей газа;<br> |
| | + | P – давление газа, Па;<br> |
| | + | V – объем газа, м3;<br> |
| | + | T – абсолютная температура газа, К;<br> |
| | + | R – универсальная газовая постоянная 8,314 Дж/моль×K.<br> |
| | + | |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz01.jpg|500x500px|уравнение газа]] |
| | + | <br> |
| | + | |
| | + | Впервые уравнение, с помощью которого можно было установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот великий русский ученый Дмитрий Иванович Менделеев в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон. |
| | + | |
| | + | Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона. |
| | + | |
| | + | Также, следует обратить внимание на то, что если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид: |
| | + | |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz02.jpg|500x500px|уравнение газа]] |
| | + | <br> |
| | + | <br> |
| | + | [[Image:10kl_IdealGaz03.jpg|500x500px|уравнение газа]] |
| | + | <br> |
| | + | |
| | + | Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете представление о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям. |
Версия 12:21, 6 сентября 2015
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Уравнение состояния идеального газа
Уравнение состояния идеального газа
Состояние идеального газа
Сегодняшний урок физики мы посвятим рассмотрению темы об уравнении состояния идеального газа. Но, вначале, попробуем разобраться с таким понятием, как состояние идеального газа. Нам известно, что частицы реально существующих газов, такие как атомы и молекулы имеют свои размеры и естественно, что заполняют какой-то объем в пространстве, и поэтому имеют некую зависимость друг от друга.
При взаимодействии между частицами газа, физические силы обременяют их перемещение и за счет этого ограничивают их маневренность. В связи с этим газовые законы, а также следствия из них, как правило, не нарушаются только для разреженных реальных газов. То есть, для газов, у которых расстояние между частицами ощутимо превосходят собственный размер частиц газа. Кроме того, взаимодействие между такими частицами, как правило, минимально.
Поэтому, газовые законы при естественном атмосферном давлении имеют приблизительное значение и если это давление высокое, то законы не действуют.
Поэтому в физике принято рассматривать такое понятие, как состояние идеального газа. В этом случае частицы принято расценивать, как некие геометрические точки, которые имеют микроскопические размеры и не имеют никакого взаимодействия между собой.
Уравнение состояния идеального газа
А вот, уравнение, которое связывает эти микроскопические параметры, и определяет состояние газа, называют уравнением состояния идеального газа.
К таким нулевым параметрам, без которых невозможно определить состояние газа, является:
• К первому параметру относится давление, которое обозначают символом - Р;
• Второй параметр – это объем –V;
• И к третьему параметру относится температура – Т.
Как вам уже известно, из предыдущего раздела нашего урока, что газы могут выступать в роли реагентов или быть продуктами в химических реакциях, поэтому, при нормальных условиях, газы сложно заставить реагировать между собой, и для этого необходимо уметь определять число молей газов в условиях, которые отличаются от нормальных.
А вот для этих целей и используют уравнение состояния идеального газа. Это уравнение еще имеет и другое название, его еще называют уравнением Клапейрона-Менделеева.
Такое уравнение состояния идеального газа можно легко получить из формулы зависимости давления и температуры, расписав в этой формуле концентрацию газа.
PV = nRT
Такое уравнение и называется уравнением состояния идеального газа.
где:
n – является числом молей газа;
P – давление газа, Па;
V – объем газа, м3;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Впервые уравнение, с помощью которого можно было установить связь между давлением, объемом и температурой газов, получил и сформулировал в 1834 году знаменитый французский физик Бенуа Клапейрон, который длительное время работал в Петербурге. А вот великий русский ученый Дмитрий Иванович Менделеев в 1874 году впервые его применил, но перед тем он получил формулу методом объединения закона Авогадро с законом, который сформулировал Клапейрон.
Поэтому, закон, позволяющий сделать выводы о характере поведения газов, в Европе было принято называть законом Менделеева—Клапейрона.
Также, следует обратить внимание на то, что если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева будет иметь такой вид:
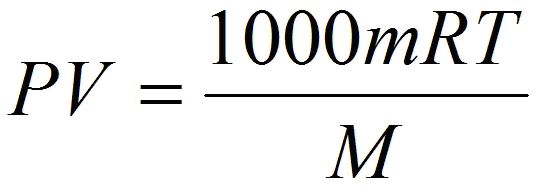

Надеюсь, что у вас не возникли проблемы при изучении этой темы и теперь вы имеете представление о том, что такое уравнение состояния идеального газа и знаете, что с его помощью можно проводить расчеты параметров реальных газов в том случае, когда физические условия газов приближены к нормальным условиям.
|