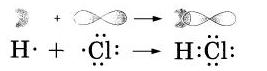|
|
|
| (2 промежуточные версии не показаны) | | Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>Химия: Степень окисления<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Степень окисления</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Степень окисления'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Степень окисления</metakeywords> |
| | | | |
| - | При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
| + | <h2>Бинарные или двухэлементные, соединения</h2> |
| | | | |
| - | <br>Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи: NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:<br> [[Image:him8-51.jpg]]
| + | Вы уже знакомились с бинарными соединениями, когда изучали ионные и ковалентные полярные химические связи. Также вам уже известно, что эти сложные вещества состоят из двух химических элементов, поэтому их и называют двухэлементными соединениями или бинарными, так как в переводе с латинского, приставка «би» обозначает «два». |
| | | | |
| - | <br>В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
| + | Когда мы с вами проходили изучение ионной и ковалентной связи, нам такие соединения уже встречались. |
| | | | |
| - | <br>Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
| + | Давайте для более доступного понимания механизмов образования ионной и ковалентной полярной химической связи приведем типичные примеры бинарных соединений: |
| | | | |
| - | [[Image:him8-52.jpg]]
| + | NaHl — хлорид натрия и НСl — хлороводород. |
| | | | |
| | + | Перед нами типичный случай ионной связи, где при образовании молекулы, атом натрия передал свой электрон атому Cl и в итоге получился ион с отрицательным зарядом -1, а атом Cl принял электрон и превратился в ион с зарядом -1. То есть, они оба превратились в ионы Na+ и Cl-. |
| | | | |
| | + | Теперь давайте посмотрим, как этот процесс будет выглядеть схематически: |
| | | | |
| - | При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:
| + | <br>[[Image:Him8-51.jpg|Степень окисления]]<br> |
| | + | |
| | + | То есть, мы видим, что связь, образовывается в молекуле НСl за счет спаривания неспаренных внешних электронов, а также за счет образования общей электронной пары атомов водорода и хлора. |
| | | | |
| - | [[Image:him8-53.jpg]]
| + | Образование ковалентной связи в молекуле НСl было бы правильнее представить, как |
| | + | перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком |
| | + | атома Сl. Схематично это будет выглядеть так: |
| | | | |
| | + | <br>[[Image:Him8-52.jpg|химия]]<br> |
| | | | |
| | + | При химическом взаимодействии, то есть, при образовании молекулы HCl, как правило, общая пара электронов оказывается, смещена в сторону к атому Cl, так как он |
| | + | является более электроотрицательным, а на атомах появляются частичные заряды: |
| | | | |
| - | Такие условные заряды называются ''степенью окисления''. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
| + | <br>[[Image:Him8-53.jpg|химия]]<br> |
| | | | |
| - | <br><u>''Степень окисления''</u> — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.<br><br>Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:<br>[[Image:him8-54.jpg]]
| + | Вот такие условные заряды и носят название степени окисления. То есть, из этого понятия следует, что связующие электроны, находящиеся в ковалентных полярных соединениях, полностью перешли к более электроотрицательному атому, а из этого следует, что данные соединения состоят только из положительно и отрицательно заряженных ионов. |
| | | | |
| | + | Из этого следует следующее определение, что степенью окисления называется такой условный заряд, который могли бы приобрести атомы, если предположить, что в такой окислительно-восстановительной реакции одним атомам свойственно отдавать данное число электронов, а другим – присоединять. |
| | | | |
| | + | <h2>Определение степени окисления</h2> |
| | | | |
| - | Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород, второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
| + | Чтобы определить степени окисления, необходимо следовать следующим правилам: |
| | | | |
| - | [[Image:him8-55.jpg]]
| + | • Во-первых, степень окисления может быть положительным, отрицательным или равным нулю. Как правило, такие символы принято обозначать арабской цифрой, которая может быть со знаком «+» или «-» и обычно он ставиться сверху над символом элемента.<br> |
| | | | |
| - | Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
| + | Вот как наглядно это будет выглядеть: |
| | | | |
| - | I группы во всех соединениях степень окисления равна +1,<br>II группы равна +2. III группы — +3, например:<br>
| + | <br>[[Image:Him8-54.jpg|химия]]<br> |
| | + | |
| | + | • Во-вторых, те атомы, которые получили электроны от других атомов или же к которым электронные пары смещены, имеют отрицательное значение степени окисления.<br> |
| | | | |
| - | [[Image:him8-56.jpg]]
| + | Так, например, фтор во всех видах соединений, имеет степень окисления -1. А вот, кислород, практически всегда имеет степень окисления -2, за исключением того, если он соединен с фтором: |
| | | | |
| - | В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2<br>кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:<br>(+14):2 = +7.
| + | <br>[[Image:Him8-55.jpg|химия]]<br> |
| | + | |
| | + | • В-третьих, атомы, отдающие свои электроны другим атомам или же атомы, которые относятся к менее электроотрицательным элементам, всегда имеют положительное значение степени окисления.<br> |
| | | | |
| - | <br>Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4.
| + | Так, например, металлам свойственно всегда иметь положительную степень окисления. |
| | | | |
| - | Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
| + | Металлы во всех соединениях имеют степень окисления в группах: |
| | | | |
| - | [[Image:him8-57.jpg]]
| + | I группа = +1,<br> |
| | + | II группа = +2,<br> |
| | + | III группа = +3.<br> |
| | | | |
| - | <br>Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
| + | Давайте рассмотрим пример: |
| | | | |
| - | <br>''Названия бинарных соединений'' состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.
| + | [[Image:Him8-56.jpg|химия]] |
| | + | |
| | + | • В-четвертых, при определении степеней окисления, в соединениях суммарная степень окисления всегда равна нулю.<br> |
| | | | |
| | + | Из этого правила следует, что зная степень окисления одного из элементов, не составит особого труда найти степень окисления другого элемента, используя для этого формулу бинарного соединения. |
| | | | |
| | + | Давайте это более подробно рассмотрим на примере: |
| | | | |
| - | [[Image:him8-58.jpg]]
| + | Припустим, нам нужно найти степень окисления Сl в соединении Сl2О2. Теперь, давайте обозначим степень окисления -2 кислорода: Сl2О2. Из этого всего следует, что 7 атомов кислорода имеют общий отрицательный заряд: (-2) • 7 =14. А из этого следует, что общий заряд 2-х атомов Сl равняется +14, а 1-го атома хлора: (+14):2 = +7. |
| | | | |
| | + | • В-пятых, аналогично, степень окисления атомов будет равна нулю, соединение образовано атомами 1-го элемента.<br> |
| | | | |
| | + | Давайте для наглядного примера составим формулу соединения карбида алюминия Al4C3. Так, как нам известно, что алюминий является металлом, то вначале пишем знак алюминия, а потом рядом АlС – углерода. Далее при помощи таблицы Менделеева определяем число внешних электронов. Смотрим, что у нас выходит: у Аl — 3 электрона, у С — 4. |
| | | | |
| - | Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
| + | Мы видим, что атом алюминия отдает свои электроны, а их 3, углероду и получит степень окисления +3, которая равна заряду иона. В отличие от алюминия, атом углерода принимает недостающие четыре электрона и получит степень окисления – 4. |
| | | | |
| - | <br>1. Бинарные или двухэлементные, соединения. 2. Степень окисления. 3. Химический номенклатура.
| + | Теперь осталось записать данные значения в формулу и найти наименьшее кратное, которое = 12. |
| | | | |
| - | <br>Запишите формулы оксидов яэотя (II, V, I. III. IV).<br>
| + | После этого можем рассчитать индексы: |
| | | | |
| - | [[Image:him8-59.jpg]] | + | <br>[[Image:Him8-57.jpg|химия]]<br> |
| | | | |
| - | <br> <sub>полный [[Гипермаркет_знаний_-_первый_в_мире!|список тем]] по классам, креативные [[Химия_8_класс|задания для 8 класса]], конспекты для урока [[Химия|химии]]</sub> | + | <h2>Химическая номенклатура</h2> |
| | | | |
| - | '''<u>Содержание урока</u>'''
| + | Для каких же целей нужно знать степени окисления элементов? А оказывается все банально просто, их необходимо знать, чтобы правильно называть химическое соединение. |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас
| + | А, как вам уже известно, что названия бинарных соединений состоят из двух частей. Как правило, первое слово бинарного соединения обозначает неметалл, то есть, его электроотрицательную часть. А вот второе слово обозначает металл и является электроположительным. |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы
| + | В том случае, когда электроположительный элемент выявляет разные степени окисления, то в конце его названии степень окисления обозначают римской цифрой. |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии
| + | |
| - |
| + | <br>[[Image:Him8-58.jpg|химия]]<br> |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие
| + | |
| - | '''<u></u>'''
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''<u>
| + | |
| - | </u>
| + | |
| | | | |
| - | <br>
| + | Для более четкого понимания терминологии и номенклатуры химических веществ была создана такая единая система. В ее создании принимали участие известные французские химики. В данный момент этим вопросом занимается Международный союз (ИЮПАК), который координирует деятельность химиков в разных странах мира, а также издает свои рекомендации по тем терминам, которые используются в химии. |
| | | | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | <h2>Домашнее задание</h2> |
| | | | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | <br>[[Image:Him8-59.jpg|химия]]<br> |
Текущая версия на 12:18, 20 августа 2015
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Степень окисления
Бинарные или двухэлементные, соединения
Вы уже знакомились с бинарными соединениями, когда изучали ионные и ковалентные полярные химические связи. Также вам уже известно, что эти сложные вещества состоят из двух химических элементов, поэтому их и называют двухэлементными соединениями или бинарными, так как в переводе с латинского, приставка «би» обозначает «два».
Когда мы с вами проходили изучение ионной и ковалентной связи, нам такие соединения уже встречались.
Давайте для более доступного понимания механизмов образования ионной и ковалентной полярной химической связи приведем типичные примеры бинарных соединений:
NaHl — хлорид натрия и НСl — хлороводород.
Перед нами типичный случай ионной связи, где при образовании молекулы, атом натрия передал свой электрон атому Cl и в итоге получился ион с отрицательным зарядом -1, а атом Cl принял электрон и превратился в ион с зарядом -1. То есть, они оба превратились в ионы Na+ и Cl-.
Теперь давайте посмотрим, как этот процесс будет выглядеть схематически:
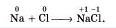
То есть, мы видим, что связь, образовывается в молекуле НСl за счет спаривания неспаренных внешних электронов, а также за счет образования общей электронной пары атомов водорода и хлора.
Образование ковалентной связи в молекуле НСl было бы правильнее представить, как
перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком
атома Сl. Схематично это будет выглядеть так:
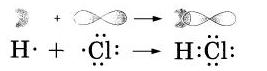
При химическом взаимодействии, то есть, при образовании молекулы HCl, как правило, общая пара электронов оказывается, смещена в сторону к атому Cl, так как он
является более электроотрицательным, а на атомах появляются частичные заряды:

Вот такие условные заряды и носят название степени окисления. То есть, из этого понятия следует, что связующие электроны, находящиеся в ковалентных полярных соединениях, полностью перешли к более электроотрицательному атому, а из этого следует, что данные соединения состоят только из положительно и отрицательно заряженных ионов.
Из этого следует следующее определение, что степенью окисления называется такой условный заряд, который могли бы приобрести атомы, если предположить, что в такой окислительно-восстановительной реакции одним атомам свойственно отдавать данное число электронов, а другим – присоединять.
Определение степени окисления
Чтобы определить степени окисления, необходимо следовать следующим правилам:
• Во-первых, степень окисления может быть положительным, отрицательным или равным нулю. Как правило, такие символы принято обозначать арабской цифрой, которая может быть со знаком «+» или «-» и обычно он ставиться сверху над символом элемента.
Вот как наглядно это будет выглядеть:
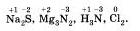
• Во-вторых, те атомы, которые получили электроны от других атомов или же к которым электронные пары смещены, имеют отрицательное значение степени окисления.
Так, например, фтор во всех видах соединений, имеет степень окисления -1. А вот, кислород, практически всегда имеет степень окисления -2, за исключением того, если он соединен с фтором:
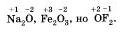
• В-третьих, атомы, отдающие свои электроны другим атомам или же атомы, которые относятся к менее электроотрицательным элементам, всегда имеют положительное значение степени окисления.
Так, например, металлам свойственно всегда иметь положительную степень окисления.
Металлы во всех соединениях имеют степень окисления в группах:
I группа = +1,
II группа = +2,
III группа = +3.
Давайте рассмотрим пример:

• В-четвертых, при определении степеней окисления, в соединениях суммарная степень окисления всегда равна нулю.
Из этого правила следует, что зная степень окисления одного из элементов, не составит особого труда найти степень окисления другого элемента, используя для этого формулу бинарного соединения.
Давайте это более подробно рассмотрим на примере:
Припустим, нам нужно найти степень окисления Сl в соединении Сl2О2. Теперь, давайте обозначим степень окисления -2 кислорода: Сl2О2. Из этого всего следует, что 7 атомов кислорода имеют общий отрицательный заряд: (-2) • 7 =14. А из этого следует, что общий заряд 2-х атомов Сl равняется +14, а 1-го атома хлора: (+14):2 = +7.
• В-пятых, аналогично, степень окисления атомов будет равна нулю, соединение образовано атомами 1-го элемента.
Давайте для наглядного примера составим формулу соединения карбида алюминия Al4C3. Так, как нам известно, что алюминий является металлом, то вначале пишем знак алюминия, а потом рядом АlС – углерода. Далее при помощи таблицы Менделеева определяем число внешних электронов. Смотрим, что у нас выходит: у Аl — 3 электрона, у С — 4.
Мы видим, что атом алюминия отдает свои электроны, а их 3, углероду и получит степень окисления +3, которая равна заряду иона. В отличие от алюминия, атом углерода принимает недостающие четыре электрона и получит степень окисления – 4.
Теперь осталось записать данные значения в формулу и найти наименьшее кратное, которое = 12.
После этого можем рассчитать индексы:
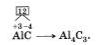
Химическая номенклатура
Для каких же целей нужно знать степени окисления элементов? А оказывается все банально просто, их необходимо знать, чтобы правильно называть химическое соединение.
А, как вам уже известно, что названия бинарных соединений состоят из двух частей. Как правило, первое слово бинарного соединения обозначает неметалл, то есть, его электроотрицательную часть. А вот второе слово обозначает металл и является электроположительным.
В том случае, когда электроположительный элемент выявляет разные степени окисления, то в конце его названии степень окисления обозначают римской цифрой.

Для более четкого понимания терминологии и номенклатуры химических веществ была создана такая единая система. В ее создании принимали участие известные французские химики. В данный момент этим вопросом занимается Международный союз (ИЮПАК), который координирует деятельность химиков в разных странах мира, а также издает свои рекомендации по тем терминам, которые используются в химии.
Домашнее задание

|