|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Кислоти, їх склад, назви''' <metakeywords>Хімія, клас, урок, на Тему, Кислоти, їх склад, назви кислот </metakeywords> <br><br> | | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Кислоти, їх склад, назви''' <metakeywords>Хімія, клас, урок, на Тему, Кислоти, їх склад, назви кислот </metakeywords> <br><br> |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | <u>Тобі треба<br>мати уявлення:</u> про поширення кислот у природі; кислотний залишок; основність кислот;<br><u>знати:</u> формули і назви кислот; класифікацію кислот; правила поводження з кислотами;<br><u>уміти обчислювати:</u> валентність кислотного залишку.<br><br><br>'''Склад кислот.''' Тобі вже відомі формули деяких кислот, наприклад НСl — хлоридна кислота, H<sub>2</sub>S0<sub>4</sub> — сульфатна кислота, Н<sub>3</sub>Р0<sub>4</sub> — ортофосфатна кислота. Зверни увагу, у формулах кислот на першому місці стоїть символ Гідрогену, а далі — атом або група атомів, що називаються кислотним залишком. Під час хімічних реакцій кислотний залишок переходить без змін з однієї сполуки в іншу.<br><br>[[Файл:Мал. 4. Перевірка водню на чистоту.jpg]]<br>Мал. 4. Перевірка водню на чистоту<br><br>Дослід. У демонстраційну пробірку наливаємо розчин сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>, вмішуємо туди дві гранули цинку і закриваємо пробірку пробкою, в яку вставлена скляна трубочка з відтягнутим кінцем. Відбувається реакція, внаслідок якої виділяється газ. Це — водень Н<sub>2</sub>. Він горючий. Перевіримо водень на чистоту, перш ніж підпалювати його. Адже суміш водню з киснем або повітрям здатна вибухати, а чистий водень горить спокійно (мал. 4).<br>Що ж відбулось у пробірці? Запиши рівняння реакції: | + | <u>Тобі треба<br>мати уявлення:</u> про поширення кислот у природі; кислотний залишок; основність кислот;<br><u>знати:</u> формули і назви кислот; класифікацію кислот; правила поводження з кислотами;<br><u>уміти обчислювати:</u> валентність кислотного залишку.<br><br><br>'''Склад кислот.''' Тобі вже відомі формули деяких кислот, наприклад НСl — хлоридна кислота, H<sub>2</sub>S0<sub>4</sub> — сульфатна кислота, Н<sub>3</sub>Р0<sub>4</sub> — ортофосфатна кислота. Зверни увагу, у формулах кислот на першому місці стоїть символ Гідрогену, а далі — атом або група атомів, що називаються кислотним залишком. Під час хімічних реакцій кислотний залишок переходить без змін з однієї сполуки в іншу.<br><br>[[Image:Мал. 4. Перевірка водню на чистоту.jpg]]<br>Мал. 4. Перевірка водню на чистоту<br><br>Дослід. У демонстраційну пробірку наливаємо розчин сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>, вмішуємо туди дві гранули цинку і закриваємо пробірку пробкою, в яку вставлена скляна трубочка з відтягнутим кінцем. Відбувається реакція, внаслідок якої виділяється газ. Це — водень Н<sub>2</sub>. Він горючий. Перевіримо водень на чистоту, перш ніж підпалювати його. Адже суміш водню з киснем або повітрям здатна вибухати, а чистий водень горить спокійно (мал. 4).<br>Що ж відбулось у пробірці? Запиши рівняння реакції: |
| | | | |
| | Zn + H<sub>2</sub>S0<sub>4</sub> = ZnSO<sub>4</sub> + H<sub>2</sub><sub></sub> | | Zn + H<sub>2</sub>S0<sub>4</sub> = ZnSO<sub>4</sub> + H<sub>2</sub><sub></sub> |
| | | | |
| - | Як бачиш, група атомів SO4, не змінюючись, перейшла з однієї сполуки в іншу. Отже, S0<sub>4</sub> — кислотний залишок сульфатної кислоти.<br>Як правило, кислотні залишки утворюють елементи-неметали. За формулами кислот можна визначати валентність кислотних залишків.<br>Валентність кислотних залишків дорівнює числу атомів Гідрогену в молекулі кислоти, здатних заміщуватися на метал.<br>Оце число атомів Гідрогену в кислоті називається основністю кислоти. Наприклад, сульфатна кислота H<sub>2</sub>S0<sub>4</sub> двохосновна, а валентність її кислотного залишку S0<sub>4</sub> дорівнює 2 (табл. 3). | + | Як бачиш, група атомів SO4, не змінюючись, перейшла з однієї сполуки в іншу. Отже, S0<sub>4</sub> — кислотний залишок сульфатної кислоти.<br>Як правило, кислотні залишки утворюють елементи-неметали. За формулами кислот можна визначати валентність кислотних залишків.<br>Валентність кислотних залишків дорівнює числу атомів Гідрогену в молекулі кислоти, здатних заміщуватися на метал.<br>Оце число атомів Гідрогену в кислоті називається основністю кислоти. Наприклад, сульфатна кислота H<sub>2</sub>S0<sub>4</sub> двохосновна, а валентність її кислотного залишку S0<sub>4</sub> дорівнює 2 (табл. 3). |
| | | | |
| - | Таблиця 3. Склад, назви і властивості кислот<br>[[Файл:Таблиця 3. Склад, назви і властивості кислот.jpg]]<br><br>Примітка. У дужках наведено традиційні назви кислот, які ще трапляються в літературі.<br>Чи знаєш ти, що першою кислотою, про яку дізналась людина, була, мабуть, оцтова кислота? Вона утворюється внаслідок скисання виноградного вина | + | Таблиця 3. Склад, назви і властивості кислот<br>[[Image:Таблиця 3. Склад, назви і властивості кислот.jpg]]<br><br>Примітка. У дужках наведено традиційні назви кислот, які ще трапляються в літературі.<br>Чи знаєш ти, що першою кислотою, про яку дізналась людина, була, мабуть, оцтова кислота? Вона утворюється внаслідок скисання виноградного вина |
| | | | |
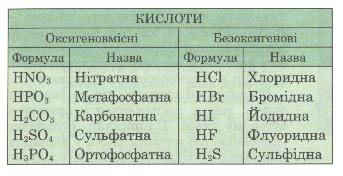
| - | <br>'''Класифікація кислот.''' Кислоти поділяють:<br>а) ''за основністю'' на одно-, двох-, три-і багатоосновні (табл. 4). | + | <br>'''Класифікація кислот.''' Кислоти поділяють:<br>а) ''за основністю'' на одно-, двох-, три-і багатоосновні (табл. 4). |
| | | | |
| - | Таблиця 4. Класифікація кислот за основністю<br>[[Файл:Таблиця 4. Класифікація кислот за основністю.jpg]]<br> <br>б) ''за складом'' на оксигеновмісні й без-оксигенові (табл. 5). | + | Таблиця 4. Класифікація кислот за основністю<br>[[Image:Таблиця 4. Класифікація кислот за основністю.jpg]]<br> <br>б) ''за складом'' на оксигеновмісні й без-оксигенові (табл. 5). |
| | | | |
| - | Таблиця 5. Класифікація кислот за складом кислоти <br> | + | Таблиця 5. Класифікація кислот за складом кислоти <br> |
| | | | |
| - | [[Файл:Таблиця 5. Класифікація кислот за складом кислоти.jpg]]<br> | + | [[Image:Таблиця 5. Класифікація кислот за складом кислоти.jpg]]<br> |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | Звичайний оцет — це розчин оцтової кислоти<br>
| + | <br> |
| | | | |
| - | [[Файл:Звичайний оцет — це розчин оцтової кислоти.jpg]]<br> | + | [[Image:Звичайний оцет — це розчин оцтової кислоти.jpg]]<br> |
| | | | |
| - | <br>
| + | Звичайний оцет — це розчин оцтової кислоти |
| | | | |
| - | '''<br>Фізичні властивості кислот.''' За стандартних умов багато кислот — рідини (H<sub>2</sub>S0<sub>4</sub>, HN0<sub>3</sub>), але є й тверді кислоти — ортофосфатна Н<sub>3</sub>Р0<sub>4</sub>, метафосфатна НРОз, силікатна (драглиста маса) H<sub>2</sub>Si0<sub>3</sub>. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN0<sub>3</sub>), вони мають задушливий запах. Майже всі кислоти безбарвні.<br>Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту. | + | '''<br>Фізичні властивості кислот.''' За стандартних умов багато кислот — рідини (H<sub>2</sub>S0<sub>4</sub>, HN0<sub>3</sub>), але є й тверді кислоти — ортофосфатна Н<sub>3</sub>Р0<sub>4</sub>, метафосфатна НРОз, силікатна (драглиста маса) H<sub>2</sub>Si0<sub>3</sub>. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN0<sub>3</sub>), вони мають задушливий запах. Майже всі кислоти безбарвні.<br>Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту. |
| | | | |
| - | <br>'''Поширення у природі.''' Мабуть, ти знаєш, що багато харчових продуктів кислі на смак. Такого смаку їм надають органічні кислоти (вивчатимуться пізніше). Кислий смак лимона зумовлений наявністю лимонної кислоти, яблука — яблучної кислоти, кислого молока — молочної кислоти. Щавель має кислий смак, бо в його листі міститься щавлева кислота. Оцет є розчином оцтової кислоти.<br>Неорганічні кислоти, які ти зараз вивчаєш, також трапляються у природі у вільному стані. Наприклад, сульфідна (сірководнева) кислота H<sub>2</sub>S є у вулканічних газах і у водах мінеральних джерел (Мацеста — Сочі на Чорноморському узбережжі Кавказу, в Україні — Немирів). Хлоридна кислота НСl входить до складу шлункового соку. Карбонатна кислота Н<sub>2</sub>С0<sub>3</sub> — до складу природних мінеральних вод (Боржомі, Єсентуки, Нарзан на Кавказі, в Україні — Миргородська, Лужанська, Свалява, Трускавецька). Нітратна HN0<sub>3</sub> і сульфітна H<sub>2</sub>S0<sub>3</sub> кислоти трапляються в дощовій воді («кислотні дощі»). | + | <br>'''Поширення у природі.''' Мабуть, ти знаєш, що багато харчових продуктів кислі на смак. Такого смаку їм надають органічні кислоти (вивчатимуться пізніше). Кислий смак лимона зумовлений наявністю лимонної кислоти, яблука — яблучної кислоти, кислого молока — молочної кислоти. Щавель має кислий смак, бо в його листі міститься щавлева кислота. Оцет є розчином оцтової кислоти.<br>Неорганічні кислоти, які ти зараз вивчаєш, також трапляються у природі у вільному стані. Наприклад, сульфідна (сірководнева) кислота H<sub>2</sub>S є у вулканічних газах і у водах мінеральних джерел (Мацеста — Сочі на Чорноморському узбережжі Кавказу, в Україні — Немирів). Хлоридна кислота НСl входить до складу шлункового соку. Карбонатна кислота Н<sub>2</sub>С0<sub>3</sub> — до складу природних мінеральних вод (Боржомі, Єсентуки, Нарзан на Кавказі, в Україні — Миргородська, Лужанська, Свалява, Трускавецька). Нітратна HN0<sub>3</sub> і сульфітна H<sub>2</sub>S0<sub>3</sub> кислоти трапляються в дощовій воді («кислотні дощі»). |
| | | | |
| - | <br>'''Застосування кислот.''' Найбільше значення має сульфатна кислота H<sub>2</sub>S0<sub>4</sub>. Її використовують для добування інших кислот, солей, мінеральних добрив, пластмас, штучного волокна, ліків, фарб, вибухових речовин тощо. Серед найважливіших кислот — хлоридна НСl й нітратна HN0<sub>3</sub>. Їх застосовують для добування солей, ліків, мінеральних добрив, багатьох органічних сполук.<br>У життєдіяльності організмів кислоти відіграють важливу роль. Тому споживання їх у невеликих кількостях необхідне. В організм людини кислоти потрапляють з овочами, фруктами та іншими продуктами.<br>Чи знаєш ти, що сульфатну кислоту H<sub>2</sub>S0<sub>4</sub> називають хлібом хімічної промисловості? Без неї неможливо виробництво кислот, солей, добрив, барвників та багатьох інших речовин, а також здійснення майже всіх органічних синтезів<br><br>Приклади використання кислот у побуті:<br>[[Файл:Автомобільний акумулятор.jpg]]<br>Автомобільний акумулятор містить сульфатну кислоту | + | <br>'''Застосування кислот.''' Найбільше значення має сульфатна кислота H<sub>2</sub>S0<sub>4</sub>. Її використовують для добування інших кислот, солей, мінеральних добрив, пластмас, штучного волокна, ліків, фарб, вибухових речовин тощо. Серед найважливіших кислот — хлоридна НСl й нітратна HN0<sub>3</sub>. Їх застосовують для добування солей, ліків, мінеральних добрив, багатьох органічних сполук.<br>У життєдіяльності організмів кислоти відіграють важливу роль. Тому споживання їх у невеликих кількостях необхідне. В організм людини кислоти потрапляють з овочами, фруктами та іншими продуктами.<br>Чи знаєш ти, що сульфатну кислоту H<sub>2</sub>S0<sub>4</sub> називають хлібом хімічної промисловості? Без неї неможливо виробництво кислот, солей, добрив, барвників та багатьох інших речовин, а також здійснення майже всіх органічних синтезів<br><br>Приклади використання кислот у побуті:<br>[[Image:Автомобільний акумулятор.jpg]]<br>Автомобільний акумулятор містить сульфатну кислоту |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | <br><u>ВИСНОВКИ</u><br>Кислоти — складні речовини, що містять у своєму складі Гідроген, здатний заміщуватися на метал, і кислотний залишок.<br>За складом кислоти бувають оксигеновмісні та безоксигенові, а за основністю — одно-, двох-, три- і багатоосновні.<br>Основність кислоти визначається числом атомів Гідрогену, які заміщуються металом.<br>Від основності кислоти залежить валентність кислотного залишку — атома або групи атомів, що під час хімічної реакції переходить без змін з молекули кислоти до іншої сполуки.<br><br> | + | <br><u>ВИСНОВКИ</u><br>Кислоти — складні речовини, що містять у своєму складі Гідроген, здатний заміщуватися на метал, і кислотний залишок.<br>За складом кислоти бувають оксигеновмісні та безоксигенові, а за основністю — одно-, двох-, три- і багатоосновні.<br>Основність кислоти визначається числом атомів Гідрогену, які заміщуються металом.<br>Від основності кислоти залежить валентність кислотного залишку — атома або групи атомів, що під час хімічної реакції переходить без змін з молекули кислоти до іншої сполуки.<br><br> |
| | | | |
| | ---- | | ---- |
| | | | |
| - | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> | + | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> |
| | | | |
| - | <br> <sub>Планування уроків з хімії, книги та підручники по всім предметам, учням та вчителям на допомогу </sub> <br> | + | <br> <sub>Планування уроків з [[Хімія|хімії]], книги та підручники по всім [[Гіпермаркет_Знань_-_перший_в_світі!|предметам]], учням та вчителям на допомогу </sub> <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
Версия 06:35, 1 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Кислоти, їх склад, назви
Тобі треба
мати уявлення: про поширення кислот у природі; кислотний залишок; основність кислот;
знати: формули і назви кислот; класифікацію кислот; правила поводження з кислотами;
уміти обчислювати: валентність кислотного залишку.
Склад кислот. Тобі вже відомі формули деяких кислот, наприклад НСl — хлоридна кислота, H2S04 — сульфатна кислота, Н3Р04 — ортофосфатна кислота. Зверни увагу, у формулах кислот на першому місці стоїть символ Гідрогену, а далі — атом або група атомів, що називаються кислотним залишком. Під час хімічних реакцій кислотний залишок переходить без змін з однієї сполуки в іншу.
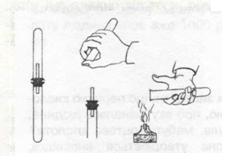
Мал. 4. Перевірка водню на чистоту
Дослід. У демонстраційну пробірку наливаємо розчин сульфатної кислоти H2S04, вмішуємо туди дві гранули цинку і закриваємо пробірку пробкою, в яку вставлена скляна трубочка з відтягнутим кінцем. Відбувається реакція, внаслідок якої виділяється газ. Це — водень Н2. Він горючий. Перевіримо водень на чистоту, перш ніж підпалювати його. Адже суміш водню з киснем або повітрям здатна вибухати, а чистий водень горить спокійно (мал. 4).
Що ж відбулось у пробірці? Запиши рівняння реакції:
Zn + H2S04 = ZnSO4 + H2
Як бачиш, група атомів SO4, не змінюючись, перейшла з однієї сполуки в іншу. Отже, S04 — кислотний залишок сульфатної кислоти.
Як правило, кислотні залишки утворюють елементи-неметали. За формулами кислот можна визначати валентність кислотних залишків.
Валентність кислотних залишків дорівнює числу атомів Гідрогену в молекулі кислоти, здатних заміщуватися на метал.
Оце число атомів Гідрогену в кислоті називається основністю кислоти. Наприклад, сульфатна кислота H2S04 двохосновна, а валентність її кислотного залишку S04 дорівнює 2 (табл. 3).
Таблиця 3. Склад, назви і властивості кислот
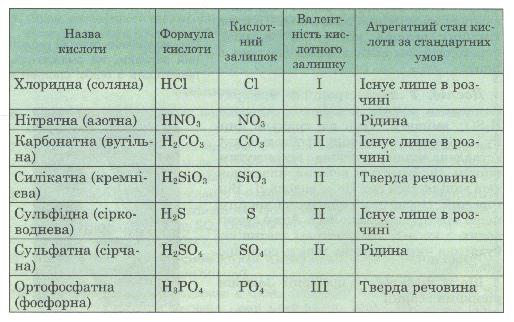
Примітка. У дужках наведено традиційні назви кислот, які ще трапляються в літературі.
Чи знаєш ти, що першою кислотою, про яку дізналась людина, була, мабуть, оцтова кислота? Вона утворюється внаслідок скисання виноградного вина
Класифікація кислот. Кислоти поділяють:
а) за основністю на одно-, двох-, три-і багатоосновні (табл. 4).
Таблиця 4. Класифікація кислот за основністю

б) за складом на оксигеновмісні й без-оксигенові (табл. 5).
Таблиця 5. Класифікація кислот за складом кислоти

Звичайний оцет — це розчин оцтової кислоти
Фізичні властивості кислот. За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна Н3Р04, метафосфатна НРОз, силікатна (драглиста маса) H2Si03. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN03), вони мають задушливий запах. Майже всі кислоти безбарвні.
Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту.
Поширення у природі. Мабуть, ти знаєш, що багато харчових продуктів кислі на смак. Такого смаку їм надають органічні кислоти (вивчатимуться пізніше). Кислий смак лимона зумовлений наявністю лимонної кислоти, яблука — яблучної кислоти, кислого молока — молочної кислоти. Щавель має кислий смак, бо в його листі міститься щавлева кислота. Оцет є розчином оцтової кислоти.
Неорганічні кислоти, які ти зараз вивчаєш, також трапляються у природі у вільному стані. Наприклад, сульфідна (сірководнева) кислота H2S є у вулканічних газах і у водах мінеральних джерел (Мацеста — Сочі на Чорноморському узбережжі Кавказу, в Україні — Немирів). Хлоридна кислота НСl входить до складу шлункового соку. Карбонатна кислота Н2С03 — до складу природних мінеральних вод (Боржомі, Єсентуки, Нарзан на Кавказі, в Україні — Миргородська, Лужанська, Свалява, Трускавецька). Нітратна HN03 і сульфітна H2S03 кислоти трапляються в дощовій воді («кислотні дощі»).
Застосування кислот. Найбільше значення має сульфатна кислота H2S04. Її використовують для добування інших кислот, солей, мінеральних добрив, пластмас, штучного волокна, ліків, фарб, вибухових речовин тощо. Серед найважливіших кислот — хлоридна НСl й нітратна HN03. Їх застосовують для добування солей, ліків, мінеральних добрив, багатьох органічних сполук.
У життєдіяльності організмів кислоти відіграють важливу роль. Тому споживання їх у невеликих кількостях необхідне. В організм людини кислоти потрапляють з овочами, фруктами та іншими продуктами.
Чи знаєш ти, що сульфатну кислоту H2S04 називають хлібом хімічної промисловості? Без неї неможливо виробництво кислот, солей, добрив, барвників та багатьох інших речовин, а також здійснення майже всіх органічних синтезів
Приклади використання кислот у побуті:

Автомобільний акумулятор містить сульфатну кислоту
ВИСНОВКИ
Кислоти — складні речовини, що містять у своєму складі Гідроген, здатний заміщуватися на метал, і кислотний залишок.
За складом кислоти бувають оксигеновмісні та безоксигенові, а за основністю — одно-, двох-, три- і багатоосновні.
Основність кислоти визначається числом атомів Гідрогену, які заміщуються металом.
Від основності кислоти залежить валентність кислотного залишку — атома або групи атомів, що під час хімічної реакції переходить без змін з молекули кислоти до іншої сполуки.
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Планування уроків з хімії, книги та підручники по всім предметам, учням та вчителям на допомогу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|
















