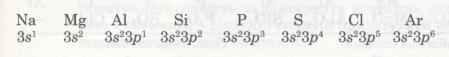|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Поняття про електронегативність елементів''' <metakeywords>Хімія, клас, урок, на Тему, Поняття про електронегативність елементів </metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Поняття про електронегативність елементів''' <metakeywords>Хімія, клас, урок, на Тему, Поняття про електронегативність елементів </metakeywords> <br> |
| - | <br> | + | |
| - | Тут буде текст
| + | |
| | + | |
| | + | '''Електронегативність.''' Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.<br>Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).<br>Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд: |
| | + | |
| | + | F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs<br> |
| | + | |
| | + | [[Image:Лайнус Карл Полінг.jpg]]<br>Лайнус Карл Полінг (1901—1994)<br>Американський фізик і хімік, громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)<br><br>Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.<br>Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі: |
| | + | |
| | + | '''''у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.'''''<br> |
| | + | |
| | + | <br>Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.<br>Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.<br>Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів. |
| | + | |
| | + | [[Image:Ряд 1.jpg]]<br>В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються. |
| | + | |
| | + | Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію.<br>Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:<br> |
| | + | |
| | + | [[Image:Ряд 2.jpg]] |
| | + | |
| | + | |
| | + | |
| | + | ---- |
| | + | |
| | + | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту |
| | + | |
| | + | <br> <sub>[[Гіпермаркет_Знань_-_перший_в_світі!|Онлайн]] бібліотека з підручниками і книгами, курс [[Хімія_8_клас|хімії]] для учнів 8 класу, реферати з хімії</sub> <br> |
| | | | |
| - | <br>
| |
| - | <sub>Онлайн бібліотека з підручниками і книгами, курс хімії для учнів 8 класу, реферати з хімії</sub>
| |
| - | <br>
| |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас |
| Строка 42: |
Строка 63: |
| | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| - | | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Версия 11:51, 2 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Поняття про електронегативність елементів
Електронегативність. Відносна легкість відривання електронів є головною особливістю елементів з металічними властивостями. Атоми металів порівняно легко віддають валентні електрони і не можуть приєднувати їх для добудови свого зовнішнього енергетичного рівня до його завершення. В цьому разі говорять, що для атомів металів електронегативність не характерна.
Електронегативністю елемента називають властивість його атомів відтягувати на себе електронну густину (порівняно з іншими елементами сполуки).
Чим вище електронегативність елемента, тим яскравіше виявлені у нього неметалічні властивості. За зниженням електронегативності елементи розміщуються у такий ряд:
F > O > N > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Лайнус Карл Полінг (1901—1994)
Американський фізик і хімік, громадський діяч, академік Національної академії наук США. Автор перших фундаментальних досліджень із застосування квантової механіки до вивчення хімічного зв'язку. Досліджував структуру білків, імунохімію, молекулярну генетику. Розрахував величини йонних радіусів, сформулював загальні правила утворення йонних кристалічних структур, пояснив напрям-леність валентностей. Виступав проти випробування ядерної зброї. Учасник руху прихильників миру в США. Лауреат Нобелівської премії з хімії (1954), Нобелівської премії миру (1962), Міжнародної Ленінської премії (1970)
Отже, найбільша здатність до притягання електронів у Флуору, а найменша — у Цезію.
Уперше шкалу електронегативностей елементів розробив американський хімік Лайнус Полінг (1932 p.). Він виявив загальну тенденцію зміни електронегативностей елементів у періодичній системі:
у періодах електронегативність елементів зростає зліва направо, а в групах — знизу вгору.
Як пояснити таку закономірність? Вона пояснюється тим, що в періодах у міру зростання зарядів ядер атомів кількість валентних електронів збільшується, радіус атомів зменшується, а їх здатність до приєднання електронів, яких не вистачає до завершення зовнішнього рівня, зростає. Отже, електронегативність збільшується. А в головних підгрупах навпаки: радіус атомів зростає, зв'язок валентних електронів з ядром послаблюється і приєднання нових електронів утруднюється, тобто електронегативність зменшується.
Зміна металічних і неметалічних властивостей елементів. Металічний або неметалічний характер елемента залежить від електронної будови його атома.
Розглянемо, наприклад, елементи 3-го періоду. Зверни увагу, як закономірно змінюється електронна конфігурація їх атомів.
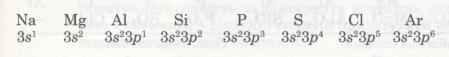
В атомах елементів від Na до Аl на зовнішньому рівні мало електронів (1, 2, 3). Радіус атомів зменшується. Отже, зв'язок зовнішніх електронів з ядром поступово посилюється за рахунок притягання до ядра, і здатність атомів віддавати ці електрони зменшується. Це означає, що металічні властивості елементів від Na до Аl послаблюються (Алюміній — перехідний елемент). Неметалічні ж властивості навпаки посилюються від Силіцію до Фосфору і Сульфуру. Найяскравіше вони виражені у Хлору — галогену. Це пояснюється тим, що зростає кількість електронів зовнішнього рівня, радіус атомів зменшується, отже, притягання до ядра посилюється й посилюється електронегативність, тобто здатність до приєднання електронів. А це означає, що неметалічні властивості посилюються.
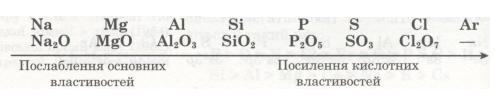
Завершується 3-й період інертним елементом Аргоном, який повторює головним чином властивості Неону. В атомі Аргону зовнішній енергетичний рівень (8 електронів) так само завершений. Тому при переході до наступного періоду властивості елементів різко змінюються, і 4-й період знову починається лужним металом Калієм, який повторює переважно властивості Натрію.
Відповідно змінам електронної будови зовнішнього енергетичного рівня закономірно змінюється значення вищої валентності елементів, отже, й склад їх оксидів:
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Онлайн бібліотека з підручниками і книгами, курс хімії для учнів 8 класу, реферати з хімії
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|