|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Електронні формули молекул речовин''' <metakeywords>Хімія, клас, урок, на Тему, Електронні формули молекул речовин </metakeywords> | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 8 клас|Хімія 8 клас]]>>Хімія: Електронні формули молекул речовин''' <metakeywords>Хімія, клас, урок, на Тему, Електронні формули молекул речовин </metakeywords> <br><br> |
| - | <br> | + | |
| - | Тут буде текст
| + | <br> |
| | + | |
| | + | Для прикладу розглянемо утворення молекули водню Н<sub>2</sub>. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу. |
| | + | |
| | + | <br>Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:<br> |
| | + | |
| | + | [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%90%D1%82%D0%BE%D0%BC%D0%B8_%D0%93%D1%96%D0%B4%D1%80%D0%BE%D0%B3%D0%B5%D0%BD%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D0%B2%D0%BE%D0%B4%D0%BD%D1%8E.jpg|[[Image:|Image:Атоми Гідрогену в молекулі водню.jpg]]]]<br> |
| | + | |
| | + | [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D1%96%D0%B4%D0%B2%D0%B8%D1%89%D0%B5%D0%BD%D0%B0_%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0_%D0%B3%D1%83%D1%81%D1%82%D0%B8%D0%BD%D0%B0.jpg|[[Image:|Image:Підвищена електронна густина.jpg]]]]<br> |
| | + | |
| | + | Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н. |
| | + | |
| | + | <br> |
| | + | |
| | + | <br> |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F<sub>2</sub>. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:<br> |
| | + | |
| | + | [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A3%D1%82%D0%B2%D0%BE%D1%80%D0%B5%D0%BD%D0%BD%D1%8F_%D0%BA%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D0%B3%D0%BE_%D0%B7%D0%B2%27%D1%8F%D0%B7%D0%BA%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D1%84%D1%82%D0%BE%D1%80%D1%83_F.jpg|[[Image:|Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg]]]]<br>У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:<br> |
| | + | |
| | + | [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D0%B5%D1%80%D0%B5%D0%BA%D1%80%D0%B8%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%85%D0%BC%D0%B0%D1%80_%D0%B4%D0%B2%D0%BE%D1%85_%D0%BD%D0%B5%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D1%85_%D1%80-%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D1%96%D0%B2.jpg|[[Image:|Image:Перекривання хмар двох неспарених р-електронів.jpg]]]] |
| | + | |
| | + | [[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A1%D0%BF%D1%96%D0%BB%D1%8C%D0%BD%D0%B0_%D0%B5%D0%BB._%D0%BF%D0%B0%D1%80%D0%B0_-2.jpg|[[Image:|Image:Спільна ел. пара -2.jpg]]]] |
| | + | |
| | + | У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів. |
| | + | |
| | + | <br> |
| | + | |
| | + | <br> |
| | + | |
| | + | |
| | + | |
| | + | Схеа утворення потрійного ковалентного зв'язку в молекулі азоту N<sub>2</sub>:<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N.jpg]]<br>[[Image:Утворення потрійного ковалентного зв'язку в молекулі азоту N - 2.jpg]] |
| | + | |
| | + | <br> |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | Ковалентний полярний зв'язок у молекулі флуороводню HF:<br> |
| | + | |
| | + | [[Image:Ковалентний полярний зв'язок у молекулі флуороводню HF.jpg]] |
| | + | |
| | + | [[Image:Молекула флуороводню HF- 2 .jpg]] |
| | + | |
| | + | <br> |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | |
| | + | Згадаємо електронну формулу Карбону:<br><sub>6</sub>С 1s<sup>2</sup>2s<sup>2</sup>2p<sup>2</sup><br>Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:<br> |
| | + | |
| | + | [[Image:Розпаровування електронної пари атом Карбону.jpg]]<br>Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами, наприклад:<br> |
| | + | [[Image:4 ковалентні зв'язки Карбону з іншими атомами .jpg]] |
| | + | |
| | + | |
| | + | ---- |
| | + | |
| | + | Н.М. Буринська, Хімія, 8 клас<br>Вислано читачами інтернет-сайту<br> |
| | + | |
| | + | <br> <sub>Матеріали та завдання з хімії, допомога школяру, готуємось до школи онлайн</sub> <br> |
| | | | |
| - | <br>
| |
| - | <sub>Матеріали та завдання з хімії, допомога школяру, готуємось до школи онлайн</sub>
| |
| - | <br>
| |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас |
| Строка 42: |
Строка 105: |
| | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| - | | + | <br> |
| | | | |
| | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br>Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| + | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Версия 12:35, 2 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 8 клас>>Хімія: Електронні формули молекул речовин
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двохелектронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.
Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%90%D1%82%D0%BE%D0%BC%D0%B8_%D0%93%D1%96%D0%B4%D1%80%D0%BE%D0%B3%D0%B5%D0%BD%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D0%B2%D0%BE%D0%B4%D0%BD%D1%8E.jpg|[[Image:|Image:Атоми Гідрогену в молекулі водню.jpg]]]]
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D1%96%D0%B4%D0%B2%D0%B8%D1%89%D0%B5%D0%BD%D0%B0_%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%B0_%D0%B3%D1%83%D1%81%D1%82%D0%B8%D0%BD%D0%B0.jpg|[[Image:|Image:Підвищена електронна густина.jpg]]]]
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню Н—Н.
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений:
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A3%D1%82%D0%B2%D0%BE%D1%80%D0%B5%D0%BD%D0%BD%D1%8F_%D0%BA%D0%BE%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D0%BE%D0%B3%D0%BE_%D0%B7%D0%B2%27%D1%8F%D0%B7%D0%BA%D1%83_%D0%B2_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D1%96_%D1%84%D1%82%D0%BE%D1%80%D1%83_F.jpg|[[Image:|Image:Утворення ковалентного зв'язку в молекулі фтору F.jpg]]]]
У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%9F%D0%B5%D1%80%D0%B5%D0%BA%D1%80%D0%B8%D0%B2%D0%B0%D0%BD%D0%BD%D1%8F_%D1%85%D0%BC%D0%B0%D1%80_%D0%B4%D0%B2%D0%BE%D1%85_%D0%BD%D0%B5%D1%81%D0%BF%D0%B0%D1%80%D0%B5%D0%BD%D0%B8%D1%85_%D1%80-%D0%B5%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D1%96%D0%B2.jpg|[[Image:|Image:Перекривання хмар двох неспарених р-електронів.jpg]]]]
[[../../../../index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:%D0%A1%D0%BF%D1%96%D0%BB%D1%8C%D0%BD%D0%B0_%D0%B5%D0%BB._%D0%BF%D0%B0%D1%80%D0%B0_-2.jpg|[[Image:|Image:Спільна ел. пара -2.jpg]]]]
У наведеному прикладі зовнішній енергетичний рівень завершується до октету — восьми електронів.
Схеа утворення потрійного ковалентного зв'язку в молекулі азоту N2:

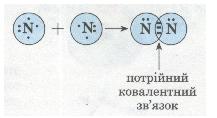
Ковалентний полярний зв'язок у молекулі флуороводню HF:
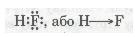
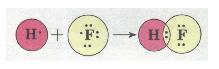
Згадаємо електронну формулу Карбону:
6С 1s22s22p2
Додаткові два неспарені електрони з'являються в результаті розпаровування 28-електронної пари, яке відбувається безпосередньо в процесі взаємодії атомів Карбону з іншими атомами. При цьому атом переходить з основного стану у збуджений:
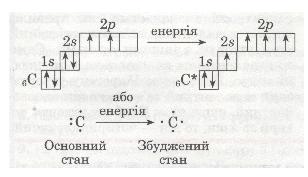
Як бачиш, за рахунок розпаровування електронної пари атом Карбону може утворювати 4 ковалентні зв'язки з іншими атомами, наприклад:
Файл:4 ковалентні зв'язки Карбону з іншими атомами .jpg
Н.М. Буринська, Хімія, 8 клас
Вислано читачами інтернет-сайту
Матеріали та завдання з хімії, допомога школяру, готуємось до школи онлайн
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|













