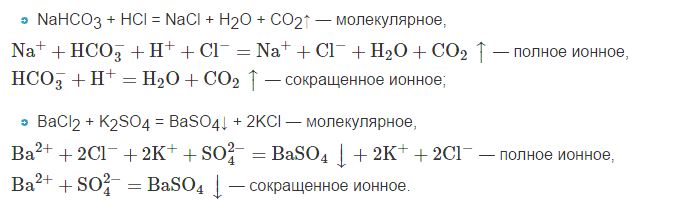|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Ионные уравнения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ионные уравнения, уравнения</metakeywords>''' Большинство [[Скорость_химических_реакций|химических реакций]] протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.<br><br>Реакции между ионами называют [[Классификация_химических_реакций|ионными реакциями]], а уравнения таких реакций - ионными уравнениями.<br><br>При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде. | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Ионные уравнения<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Ионные уравнения, уравнения</metakeywords>''' |
| | | | |
| - | <br>Бели вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх. | + | <h2>Ионные уравнения</h2> |
| | | | |
| - | [[Image:Him8-117.jpg|химия 8 класс]]
| + | Как вам уже известно из предыдущих уроков химии, большая часть химических реакций происходит в растворах. А так как все растворы электролитов включают ионы, то можно говорить о том, что реакции в растворах электролитов сводятся к реакциям между ионами. |
| | | | |
| - | <br>
| + | Вот такие реакции, которые происходят между ионами, носят название ионных реакций. |
| | + | А ионные уравнения – это, как раз и есть уравнения этих реакций. |
| | | | |
| - | Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции - в виде молекул:
| + | Как правило, ионные уравнения реакций получают из молекулярных уравнений, но это происходит при соблюдении таких правил: |
| | | | |
| - | [[Image:Him8-118.jpg|химия 8 класс]]
| + | • Во-первых, формулы слабых электролитов, а также нерастворимых и малорастворимых веществ, газов, оксидов и т.д. в виде ионов не записывают, исключением из этого правила является ион HSO−4, и то в разбавленном виде.<br> |
| | | | |
| - | <br> | + | • Во-вторых, в виде ионов, как правило, представляют формулы сильных кислот, щелочей, а также растворимых в воде солей. Так же следует отметить, что такая формула, как Са(ОН)2 представлена в виде ионов, в том случае, если используется известковая вода. Если же используется известковое молоко, которое содержит нерастворимые частицы Ca(OH)2, то формула в виде ионов, также не записывается.<br> |
| | | | |
| - | Мы записали, таким обратом, полное ионное уравнение реакции.
| + | При составлении ионных уравнений, как правило, используют полное ионное и сокращенное, то есть краткое ионное уравнения реакции. Если рассматривать ионное уравнение, которое имеет сокращенный вид, то в нем мы не наблюдаем ионов, то есть они отсутствуют обеих частях полного ионного уравнения. |
| | | | |
| - | <br>Если исключить из обеих частей равенства одинаковые ионы, то есть не участвующие в реакции в левой и правой часто уравнения), то получим сокращенное ионное уравнение реакции:<br>[[Image:Him8-119.jpg|химия 8 класс]]
| + | Давайте рассмотрим на примерах, как записываются молекулярные, полные и сокращенные ионные уравнения: |
| | | | |
| - | <br> | + | <br> |
| | + | [[Image:8kl_Ionnye.yravnenn01.jpg|500x500px|ионные уравнения]] |
| | + | <br> |
| | + | |
| | + | Поэтому следует помнить, что формулы веществ, которые не распадаются, а также нерастворимые и газообразные, при составлении ионных уравнений принято записывать в молекулярном виде. |
| | | | |
| - | [[Image:Him8-120.jpg|химия 8 класс]]
| + | Также, следует помнить, что в том случае, если вещество выпадает в осадок, то рядом с такой формулой изображают направленную вниз стрелку (↓). Ну, а в том случае, когда в ходе реакции выделяется газообразное вещество, то рядом с формулой должен стоять такой значок, как стрелка направленная вверх (↑). |
| | | | |
| - | <br>
| + | Давайте более подробно рассмотрим на примере. Если у нас есть раствор сульфата натрия Na2SO4, и мы к нему добавим раствор хлорида бария ВаСl2 (рис. 132), то увидим, что у нас образовался белый осадок сульфата бария BaSO4. |
| | | | |
| - | Таким образом, сокращенные ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции п показывают, какие ионы реагируют и какое вещество образуется в результате.
| + | Посмотрите внимательно на изображение, на котором показано взаимодействие сульфата натрия и хлорида бария: |
| | | | |
| - | <br>Реакции ионного обмена протекают до конца в тех случаях, когда образуется или осадок, или малодиссоциирующее вещество, например вода. Беля к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты, то раствор обесцветится, что послужит сигналом протекания химической реакции:<br>[[Image:Him8-121.jpg|химия 8 класс]] | + | <br> |
| | + | [[Image:8kl_Ionnye.yravnenn02.jpg|500x500px|ионные уравнения]] |
| | + | <br> |
| | + | |
| | + | Теперь давайте запишем молекулярное уравнение реакции: |
| | | | |
| - | <br> | + | <br> |
| - | | + | [[Image:8kl_Ionnye.yravnenn03.jpg|150x150px|ионные уравнения]] |
| - | Оно показывает, что взаимодействие сильной [[Кислоты._Полные_уроки|кислоты]] п щелочи сводится к взаимодействию ионов Н+ и ионов ОН -, в результате которого образуется малодиссоцвирующее вещество — вода.
| + | <br> |
| - | | + | |
| - | <br>Указанная реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации. Это частный случай реакции обмена. | + | Ну, а сейчас давайте перепишем это уравнение, где будут изображены сильные электролиты в виде ионов, а реакции, которые уходят из сферы, представлены в виде молекул: |
| | | | |
| | + | <br> |
| | + | [[Image:8kl_Ionnye.yravnenn04.jpg|150x150px|ионные уравнения]] |
| | <br> | | <br> |
| | | | |
| - | Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди і II і со щелочью:
| + | Перед нами записано полное ионное уравнение реакции. |
| | | | |
| - | [[Image:Him8-123.jpg|химия 8 класс]]
| + | Теперь попробуем убрать из одной м другой части равенства одинаковые ионы, то есть, те ионы, которые не принимают участия в реакции 2Na+ и 2Сl, то у нас получится сокращённое ионное уравнение реакции, которое будет иметь такой вид: |
| | | | |
| - | а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке раствор соляной кислоты, а к осадку в третьей пробирке раствор [[Азотные,_калийные_и_фосфорные_удобрения|азотной]] кислоты, то во всех трех пробирках осадок растворится. Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
| + | <br> |
| | + | [[Image:8kl_Ionnye.yravnenn05.jpg|150x150px|ионные уравнения]] |
| | + | <br> |
| | + | |
| | + | Из этого уравнения мы видим что вся сущность данной реакции сводится к взаимодействию ионов бария Ва2+ и сульфат-ионов <br> |
| | + | [[Image:8kl_Ionnye.yravnenn03.jpg|150x150px|ионные уравнения]] |
| | + | <br> и что в результате образуется осадок BaSO4, даже не зависимо от того, в состав каких электролитов входили эти ионы до реакции. |
| | | | |
| - | <br> | + | <h2>Как решать ионные уравнения</h2> |
| | | | |
| - | [[Image:Him8-122.jpg|химия 8 класс]]<br>
| + | И напоследок, давайте подведем итоги нашего урока и определим, как же нужно решать ионные уравнения. Мы с вами уже знаем, что все реакции, которые происходят в растворах электролитов между ионами, являются ионными реакциями. Эти реакции принято решать или описывать с помощью ионных уравнений. |
| | | | |
| - | Чтобы в этом убедиться, запишите молекулярные, полные и сокращенные ионные уравнения приведенных реакций.
| + | Также, следует помнить, что все те соединения, которые относятся к летучим, трудно растворимым или малодиссоциированным, находят решение в молекулярной форме. Также, следует не забывать, что в том случае, когда при взаимодействии растворов электролитов не образуется ни одного из вышеперечисленных видов соединения, то это означает, что реакции практически не протекают. |
| | | | |
| - | <br>Рассмотрим ионные реакции, которые протекают с образованием газа. В две пробирки нальем по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильем раствор соляной, а во вторую — азотной кислоты. В обоих случаях мы заметим характерное "вскипание" из-за выделяющегося углекислого газа. Запишем уравнения реакций для первого случая:<br>[[Image:Him8-124.jpg|химия 8 класс]] | + | <h2>Правила решения ионных уравнений</h2> |
| | | | |
| - | <br>Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода.<br> <br>1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений.<br>Они проще молекулярных и носят более общий характер.
| + | Для наглядного примера возьмем такое образование труднорастворимого соединения, как: |
| | | | |
| - | <br>2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество.<br><br>1. Молекулярное и ионное уравнения реакций.
| + | Nа2SО4 + ВаСl2 = ВаSО4 + 2NаСl |
| | | | |
| - | 2. Реакции нониого обмена.
| + | В ионном виде это выражение будет иметь вид: |
| | | | |
| - | 3. Реакции нейтрализации.
| + | 2Nа+ +SО42- + Ва2+ + 2Сl- = BаSО4 + 2Nа+ + 2Сl- |
| | | | |
| - | <br>Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой н хлоридом бария. В чем суть обеих реакций?
| + | Так как мы с вами наблюдаем, что в реакцию вступили лишь ионы бария и сульфат-ионы, а остальные ионы не прореагировали и их состояние осталось прежним. Из этого следует, что мы можем это уравнение упростить и записать в сокращенном виде: |
| | | | |
| - | <br>Запишите молекулярное п ионное уравнения реакций, о которых говорилось во второй части параграфа. — между гидроксидом меди (II) и соляной кислотой, между гид-роксидом меди (II) и азотной кислотой. В чем суть обеих реакций?
| + | Ва2+ + SО42- = ВаSО4 |
| | | | |
| - | <br>Запишите молекулярное и ионное уравнения реакций между карбонатом калия и [[Азотные, калийные и фосфорные удобрения|фосфорной кислотой]]. Что объединяет ату реакцию и те реакции, о которых говорилось в конце параграфа?
| + | Теперь вспомним, что нам следует предпринять при решении ионных уравнений: |
| - | | + | |
| - | <br>Предложите свои примеры ионных реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.<br>
| + | |
| - | | + | |
| - | [[Image:Him8-125.jpg|химия 8 класс]]
| + | |
| - | | + | |
| - | <br> <sub>рефераты к [[Химия|уроку химии]], цитаты для [[Химия 8 класс|8 класса]], [[Гипермаркет знаний - первый в мире!|учебники и пособия]]</sub>
| + | |
| - | | + | |
| - | '''<u>Содержание урока</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии
| + | |
| - |
| + | |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие
| + | |
| - | '''<u></u>'''
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''<u>
| + | |
| - | </u>
| + | |
| - | | + | |
| - | <br>
| + | |
| | | | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | • во-первых, необходимо исключить из обеих частей уравнения одинаковые ионы;<br> |
| | | | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | • во-вторых, не следует забывать о том, что сумма электрических зарядов уравнения должна быть одинаковой, и в его правой части, и также в левой.<br> |
Версия 17:06, 19 сентября 2015
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Ионные уравнения
Ионные уравнения
Как вам уже известно из предыдущих уроков химии, большая часть химических реакций происходит в растворах. А так как все растворы электролитов включают ионы, то можно говорить о том, что реакции в растворах электролитов сводятся к реакциям между ионами.
Вот такие реакции, которые происходят между ионами, носят название ионных реакций.
А ионные уравнения – это, как раз и есть уравнения этих реакций.
Как правило, ионные уравнения реакций получают из молекулярных уравнений, но это происходит при соблюдении таких правил:
• Во-первых, формулы слабых электролитов, а также нерастворимых и малорастворимых веществ, газов, оксидов и т.д. в виде ионов не записывают, исключением из этого правила является ион HSO−4, и то в разбавленном виде.
• Во-вторых, в виде ионов, как правило, представляют формулы сильных кислот, щелочей, а также растворимых в воде солей. Так же следует отметить, что такая формула, как Са(ОН)2 представлена в виде ионов, в том случае, если используется известковая вода. Если же используется известковое молоко, которое содержит нерастворимые частицы Ca(OH)2, то формула в виде ионов, также не записывается.
При составлении ионных уравнений, как правило, используют полное ионное и сокращенное, то есть краткое ионное уравнения реакции. Если рассматривать ионное уравнение, которое имеет сокращенный вид, то в нем мы не наблюдаем ионов, то есть они отсутствуют обеих частях полного ионного уравнения.
Давайте рассмотрим на примерах, как записываются молекулярные, полные и сокращенные ионные уравнения:
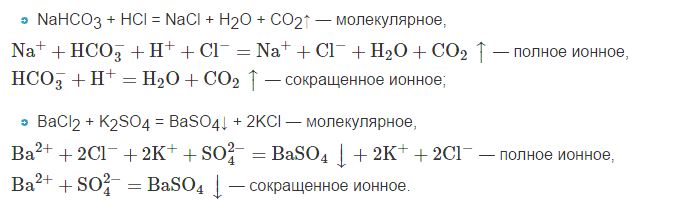
Поэтому следует помнить, что формулы веществ, которые не распадаются, а также нерастворимые и газообразные, при составлении ионных уравнений принято записывать в молекулярном виде.
Также, следует помнить, что в том случае, если вещество выпадает в осадок, то рядом с такой формулой изображают направленную вниз стрелку (↓). Ну, а в том случае, когда в ходе реакции выделяется газообразное вещество, то рядом с формулой должен стоять такой значок, как стрелка направленная вверх (↑).
Давайте более подробно рассмотрим на примере. Если у нас есть раствор сульфата натрия Na2SO4, и мы к нему добавим раствор хлорида бария ВаСl2 (рис. 132), то увидим, что у нас образовался белый осадок сульфата бария BaSO4.
Посмотрите внимательно на изображение, на котором показано взаимодействие сульфата натрия и хлорида бария:
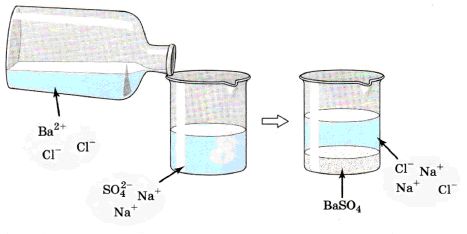
Теперь давайте запишем молекулярное уравнение реакции:
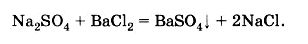
Ну, а сейчас давайте перепишем это уравнение, где будут изображены сильные электролиты в виде ионов, а реакции, которые уходят из сферы, представлены в виде молекул:
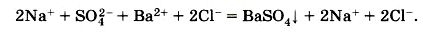
Перед нами записано полное ионное уравнение реакции.
Теперь попробуем убрать из одной м другой части равенства одинаковые ионы, то есть, те ионы, которые не принимают участия в реакции 2Na+ и 2Сl, то у нас получится сокращённое ионное уравнение реакции, которое будет иметь такой вид:
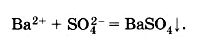
Из этого уравнения мы видим что вся сущность данной реакции сводится к взаимодействию ионов бария Ва2+ и сульфат-ионов
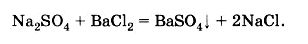
и что в результате образуется осадок BaSO4, даже не зависимо от того, в состав каких электролитов входили эти ионы до реакции.
Как решать ионные уравнения
И напоследок, давайте подведем итоги нашего урока и определим, как же нужно решать ионные уравнения. Мы с вами уже знаем, что все реакции, которые происходят в растворах электролитов между ионами, являются ионными реакциями. Эти реакции принято решать или описывать с помощью ионных уравнений.
Также, следует помнить, что все те соединения, которые относятся к летучим, трудно растворимым или малодиссоциированным, находят решение в молекулярной форме. Также, следует не забывать, что в том случае, когда при взаимодействии растворов электролитов не образуется ни одного из вышеперечисленных видов соединения, то это означает, что реакции практически не протекают.
Правила решения ионных уравнений
Для наглядного примера возьмем такое образование труднорастворимого соединения, как:
Nа2SО4 + ВаСl2 = ВаSО4 + 2NаСl
В ионном виде это выражение будет иметь вид:
2Nа+ +SО42- + Ва2+ + 2Сl- = BаSО4 + 2Nа+ + 2Сl-
Так как мы с вами наблюдаем, что в реакцию вступили лишь ионы бария и сульфат-ионы, а остальные ионы не прореагировали и их состояние осталось прежним. Из этого следует, что мы можем это уравнение упростить и записать в сокращенном виде:
Ва2+ + SО42- = ВаSО4
Теперь вспомним, что нам следует предпринять при решении ионных уравнений:
• во-первых, необходимо исключить из обеих частей уравнения одинаковые ионы;
• во-вторых, не следует забывать о том, что сумма электрических зарядов уравнения должна быть одинаковой, и в его правой части, и также в левой.
|