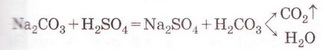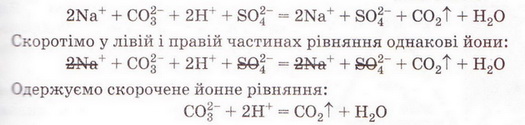|
|
|
| Строка 3: |
Строка 3: |
| | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Розв'язування розрахункових задач №4.</metakeywords>РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №4 | | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Розв'язування розрахункових задач №4.</metakeywords>РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №4 |
| | | | |
| - | | + | <br> |
| | | | |
| | ''<u>Завдання</u>''<br> | | ''<u>Завдання</u>''<br> |
| Строка 13: |
Строка 13: |
| | Розгляньмо ще один випадок перебігу до кінця реакції між електролітами у розчині. Змішаймо розчин натрій карбонату з розбавленою сульфатною кислотою.<br> | | Розгляньмо ще один випадок перебігу до кінця реакції між електролітами у розчині. Змішаймо розчин натрій карбонату з розбавленою сульфатною кислотою.<br> |
| | | | |
| - | ''<u>Завдання</u>'' | + | ''<u>Завдання</u>'' |
| | | | |
| - | За малюнком 12.4 опишіть на макрорівні хімічну реакцію між натрій карбонатом і сульфатною кислотою у розчині. Поясніть, чому не можна для проведення досліду брати розчини соди та кислоти у більших (мал. 12.4, 1), ніж вказано в інструкції (мал. 12.4, 2), кількостях. | + | За малюнком 12.4 опишіть на макрорівні хімічну реакцію між натрій карбонатом і сульфатною кислотою у розчині. Поясніть, чому не можна для проведення досліду брати розчини соди та кислоти у більших (мал. 12.4, 1), ніж вказано в інструкції (мал. 12.4, 2), кількостях. |
| | | | |
| - | [[Image:Chemistry_83.jpg]] | + | [[Image:Chemistry 83.jpg]] |
| | | | |
| | Скориставшись таблицею розчинності і див. додаток), запишімо рівняння реакції (пам'ятаймо, карбонатна кислота нестійка, існує у розчині як гідрат: | | Скориставшись таблицею розчинності і див. додаток), запишімо рівняння реакції (пам'ятаймо, карбонатна кислота нестійка, існує у розчині як гідрат: |
| | | | |
| - | [[Image:Chemistry_83_1.jpg]] | + | [[Image:Chemistry 83 1.jpg]] |
| - | | + | |
| - | З-поміж п'яти речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій карбонат, сульфатна кислота і натрій сульфат. Вода - дуже слабкий електроліт, а карбон(IV) оксид (вуглекислий газ) видаляється зі сфери реакції.
| + | |
| | | | |
| - | [[Image:Chemistry_83_2.jpg]]
| + | З-поміж п'яти речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій карбонат, сульфатна кислота і натрій сульфат. Вода - дуже слабкий електроліт, а карбон(IV) оксид (вуглекислий газ) видаляється зі сфери реакції. |
| | | | |
| - | Очевидно, що утворення молекул води й вуглекислого газу є наслідком взаємодії між катіонами Гідрогену й карбонат-аніонами у розчині. Ця реакція необоротна (відбувається до кінця), оскільки вода - дуже слабкий електроліт, а вуглекислий газ видаляється зі сфери реакції.
| + | [[Image:Chemistry 83 2.jpg]] |
| | | | |
| | + | Очевидно, що утворення молекул води й вуглекислого газу є наслідком взаємодії між катіонами Гідрогену й карбонат-аніонами у розчині. Ця реакція необоротна (відбувається до кінця), оскільки вода - дуже слабкий електроліт, а вуглекислий газ видаляється зі сфери реакції. |
| | | | |
| | + | <br> |
| | | | |
| | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| - | <br> <sub>Повний перелік тем з хімії, календарний план по всім предметам згідно шкільної програми, домашня робота, курси та завдання з хімії для 9 класу</sub> | + | <br> <sub>Повний перелік тем [[Хімія|з хімії]], [[Гіпермаркет_Знань_-_перший_в_світі!|календарний план]] по всім предметам згідно шкільної програми, домашня робота, курси та завдання [[Хімія_9_клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
Версия 13:18, 2 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розв'язування розрахункових задач №4
РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №4
Завдання
Виберіть ті пари електролітів, реакції між якими у розчині відбуваються практично до кінця (необоротно):
А Н2S04 і КОН; Б К2SiO3 і НN03; В НСІ і КN03; Г КN03 і NaОН.
Розгляньмо ще один випадок перебігу до кінця реакції між електролітами у розчині. Змішаймо розчин натрій карбонату з розбавленою сульфатною кислотою.
Завдання
За малюнком 12.4 опишіть на макрорівні хімічну реакцію між натрій карбонатом і сульфатною кислотою у розчині. Поясніть, чому не можна для проведення досліду брати розчини соди та кислоти у більших (мал. 12.4, 1), ніж вказано в інструкції (мал. 12.4, 2), кількостях.

Скориставшись таблицею розчинності і див. додаток), запишімо рівняння реакції (пам'ятаймо, карбонатна кислота нестійка, існує у розчині як гідрат:
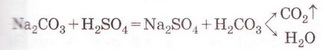
З-поміж п'яти речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій карбонат, сульфатна кислота і натрій сульфат. Вода - дуже слабкий електроліт, а карбон(IV) оксид (вуглекислий газ) видаляється зі сфери реакції.
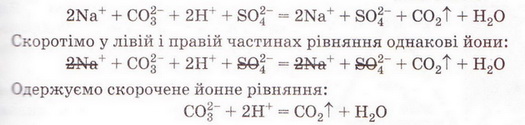
Очевидно, що утворення молекул води й вуглекислого газу є наслідком взаємодії між катіонами Гідрогену й карбонат-аніонами у розчині. Ця реакція необоротна (відбувається до кінця), оскільки вода - дуже слабкий електроліт, а вуглекислий газ видаляється зі сфери реакції.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Повний перелік тем з хімії, календарний план по всім предметам згідно шкільної програми, домашня робота, курси та завдання з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|