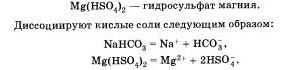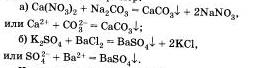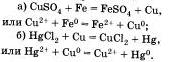|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Соли, их классификация и свойства<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Соли, их классификация и свойства, свойства солей</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Соли, их классификация и свойства<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Соли, их классификация и свойства, свойства солей</metakeywords>''' |
| - | Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
| |
| | | | |
| - | <br> | + | Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде. |
| | + | |
| | + | <br> |
| | | | |
| | ---- | | ---- |
| | | | |
| - | <u>''Соли''</u> — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка. | + | <u>''Соли''</u> — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка. |
| | | | |
| | ---- | | ---- |
| | | | |
| | + | <br> |
| | | | |
| | + | В начале XIX в. шведский химик И. Верцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные. |
| | | | |
| - | В начале XIX в. шведский химик И. Верцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
| + | <br>''Средние, или нормальные, соли'' — это продукты полного замещения атомов водорода в кислоте на металл.<br> |
| | | | |
| - | <br>''Средние, или нормальные, соли'' — это продукты полного замещения атомов водорода в кислоте на металл.<br>
| + | Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например: |
| | | | |
| - | Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
| + | <br>Na2С03 — карбонат натрия, СuSO4 — сульфат меди (II) и т. д.<br> |
| | | | |
| - | <br>Na2С03 — карбонат натрия, СuSO4 — сульфат меди (II) и т. д.<br>
| + | Диссоциируют такие соли на катионы металла и анионы кислотного остатка: |
| | | | |
| - | Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
| + | <br> |
| | | | |
| | + | [[Image:Him8-144.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| - | [[Image:him8-144.jpg]]
| + | <u>''Кислые соли''</u> — это продукты неполного замещения атомов водорода в кислоте на металл. |
| | | | |
| | + | <br> |
| | | | |
| | + | К кислым солям относят, например, питьевую соду, которая состоит из катиона металла и кислотного однозарядного остатка НСО3. Для кислой кальциевой соли формула записывается так: Са(НСО3)2. |
| | | | |
| - | <u>''Кислые соли''</u> — это продукты неполного замещения атомов водорода в кислоте на металл. | + | <br>Названия этих солей складываются из названий солей с прибавлением слова гидро, например: |
| | | | |
| | + | [[Image:Him8-145.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| - | К кислым солям относят, например, питьевую соду, которая состоит из катиона металла и кислотного однозарядного остатка НСО3. Для кислой кальциевой соли формула записывается так: Са(НСО3)2.
| + | ''Основные соли'' — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. |
| | | | |
| - | <br>Названия этих солей складываются из названий солей с прибавлением слова гидро, например: | + | <br> |
| | | | |
| - | [[Image:him8-145.jpg]]
| + | Например, к таким солям относится знаменитый малахит (СиОН)2 С03, о котором вы читали в сказах И. Бажова. Он состоит нз двух основных катионов СиОН и двухзарядного аниона кислотного остатка СО 2- 3. |
| | | | |
| | + | <br>Катион СuОН+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион СО объединены в электронейтральную соль. |
| | | | |
| | + | <br>Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например (СuОН)2 СО3 — гидроксокарбонат меди (II) или АlOНСl2 — гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы. Последние диссоциируют так:<br>[[Image:Him8-146.jpg]] |
| | | | |
| - | Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
| + | <br>''Типичные реакции солей'' |
| | | | |
| | + | [[Image:Him8-147.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| - | Например, к таким солям относится знаменитый малахит (СиОН)2 С03, о котором вы читали в сказах И. Бажова. Он состоит нз двух основных катионов СиОН и двухзарядного аниона кислотного остатка СО 2- 3.
| + | 4. Coль + металл —> другая соль + другой металл.<br><br>Первые две реакции обмена уже были подробно рассмотрены ранее. |
| | | | |
| - | <br>Катион СuОН+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион СО объединены в электронейтральную соль. | + | <br>Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием оселка, например:<br> |
| | | | |
| - | <br>Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например (СuОН)2 СО3 — гидроксокарбонат меди (II) или АlOНСl2 — гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы. Последние диссоциируют так:<br>[[Image:him8-146.jpg]]
| + | [[Image:Him8-148.jpg]] |
| | | | |
| - | <br>''Типичные реакции солей'' | + | <br>Четвертая реакция солей связана с именем крупнейшего русского химика Н.Н.Бекетова, который в 1865 г. изучал способность металлов вытеснять из растворов солей другие металлы. Например, медь tu растворов ее солей можно вытеснять такими металлами, как магний, алюминий Al, цинк и другими металлами. А вот ртутью, серебром Аg, золотом Аu медь не вытесняется, так как атм металлы в ряду напряжений расположены правее, чем медь. Зато медь вытесняет их из растворов солей:<br>[[Image:Him8-149.jpg]] |
| | | | |
| - | [[Image:him8-147.jpg]]
| + | <br>H. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при атом водород, так же как и некоторые другие металлы, вытесняет ртуть и серебро из их солей. |
| | | | |
| | + | <br>Располагая металлы, я также водород по их способности вытеснять друг друга ял растворов солей. Бекетов составил ряд. который он назвал вытеенительным рядом металлов. Позднее (1802 г. В. Нерист) было доказано, что вытесни тельный ряд Векетовп практически совпадает с рядом, в котором металлы и водород расположены (направо) в порядке уменьшения их восствнояятеяьяой способности и молярной концентрации ионов металла, равна 1 моль/л. Этот ряд называют алектрохимычесиим рядам напряжений металлов. Вы уже знакомились с этим рядом, когда рассматривали взаимодействие кислот с металлами и выяснили, что с растворами кислот взаимодействуют металлы, которые расположены левее водорода. Это первое при вило ряда напряжений Оно выполняется с соблюдением ряда условий, о которых мы говорили ранее. |
| | | | |
| - | | + | <br>Второе правило ряда напряжений заключается в следующем: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило также соблюдается при выполнении условий: |
| - | 4. Coль + металл —> другая соль + другой металл.<br><br>Первые две реакции обмена уже были подробно рассмотрены ранее.
| + | |
| - | | + | |
| - | <br>Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием оселка, например:<br>
| + | |
| - | | + | |
| - | [[Image:him8-148.jpg]]
| + | |
| - | | + | |
| - | <br>Четвертая реакция солей связана с именем крупнейшего русского химика Н.Н.Бекетова, который в 1865 г. изучал способность металлов вытеснять из растворов солей другие металлы. Например, медь tu растворов ее солей можно вытеснять такими металлами, как магний, алюминий Al, цинк и другими металлами. А вот ртутью, серебром Аg, золотом Аu медь не вытесняется, так как атм металлы в ряду напряжений расположены правее, чем медь. Зато медь вытесняет их из растворов солей:<br>[[Image:him8-149.jpg]]
| + | |
| - | | + | |
| - | <br>H. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при атом водород, так же как и некоторые другие металлы, вытесняет ртуть и серебро из их солей.
| + | |
| - | | + | |
| - | <br>Располагая металлы, я также водород по их способности вытеснять друг друга ял растворов солей. Бекетов составил ряд. который он назвал вытеенительным рядом металлов. Позднее (1802 г. В. Нерист) было доказано, что вытесни тельный ряд Векетовп практически совпадает с рядом, в котором металлы и водород расположены (едем направо) в порядке уменьшения их восствнояятеяьяой способности и молярной концентрации ионов металла, равна 1 моль/л. Этот ряд называют алектрохимычесиим рядам напряжений металлов. Вы уже знакомились с этим рядом, когда рассматривали взаимодействие кислот с металлами и выяснили, что с растворами кислот взаимодействуют металлы, которые расположены левее водорода. Это первое при вило ряда напряжений Оно выполняется с соблюдением ряда условий, о которых мы говорили ранее.
| + | |
| - | | + | |
| - | <br>Второе правило ряда напряжений заключается в следующем: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило также соблюдается при выполнении условий: | + | |
| | | | |
| | <br>а) обе соли (и реагирующая, и образующяяся в результате реакции) должны быть растворимыми;<br>б) металлы ие должны аза имодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) ие вытесняют другие металлы на растворов солей.<br><br>1. Соли средние (нормальные), кислые и основные. | | <br>а) обе соли (и реагирующая, и образующяяся в результате реакции) должны быть растворимыми;<br>б) металлы ие должны аза имодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) ие вытесняют другие металлы на растворов солей.<br><br>1. Соли средние (нормальные), кислые и основные. |
| Строка 78: |
Строка 79: |
| | 4. Два правила ряда напряжений металлов. | | 4. Два правила ряда напряжений металлов. |
| | | | |
| - | 5. Условия протекания реакций солей с металлами.<br> | + | 5. Условия протекания реакций солей с металлами.<br> |
| - | | + | |
| - | Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
| + | |
| | | | |
| - | [[Image:him8-150.jpg]]
| + | Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения: |
| | | | |
| - | <br>Если реакция не может быть осуществлена, объясните почему.<br>
| + | [[Image:Him8-150.jpg]] |
| | | | |
| - | К 980 г 5% -го раствора сорной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
| + | <br>Если реакция не может быть осуществлена, объясните почему.<br> |
| | | | |
| - | <br>Запишите уравнения реакций всех возможных способов получения сульфата железа (II).<br>
| + | К 980 г 5% -го раствора сорной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка. |
| | | | |
| - | [[Image:him8-151.jpg]]
| + | <br>Запишите уравнения реакций всех возможных способов получения сульфата железа (II).<br> |
| | | | |
| | + | [[Image:Him8-151.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| - | Дайте названия солей. | + | Дайте названия солей. |
| | | | |
| - | <br> <sub>притчи [[Химия|к уроку химии]], картинки к уроку [[Химия_8_класс|химии 8 класса]], [[Гипермаркет_знаний_-_первый_в_мире!|рефераты]] для школьников </sub> | + | <br> <sub>притчи [[Химия|к уроку химии]], картинки к уроку [[Химия 8 класс|химии 8 класса]], [[Гипермаркет знаний - первый в мире!|рефераты]] для школьников </sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
Версия 09:57, 15 июня 2010
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Соли, их классификация и свойства
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде.
Соли — это класс химических соединений, состоящих из ионов металла и ионов кислотного остатка.
В начале XIX в. шведский химик И. Верцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные.
Средние, или нормальные, соли — это продукты полного замещения атомов водорода в кислоте на металл.
Именно с этими солями вы уже знакомы и знаете их номенклатуру. Например:
Na2С03 — карбонат натрия, СuSO4 — сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
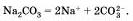
Кислые соли — это продукты неполного замещения атомов водорода в кислоте на металл.
К кислым солям относят, например, питьевую соду, которая состоит из катиона металла и кислотного однозарядного остатка НСО3. Для кислой кальциевой соли формула записывается так: Са(НСО3)2.
Названия этих солей складываются из названий солей с прибавлением слова гидро, например:
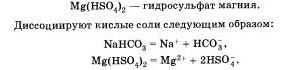
Основные соли — это продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Например, к таким солям относится знаменитый малахит (СиОН)2 С03, о котором вы читали в сказах И. Бажова. Он состоит нз двух основных катионов СиОН и двухзарядного аниона кислотного остатка СО 2- 3.
Катион СuОН+ имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион СО объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением слова гидроксо-, например (СuОН)2 СО3 — гидроксокарбонат меди (II) или АlOНСl2 — гидроксохлорид алюминия. Подавляющее большинство основных солей нерастворимы или малорастворимы. Последние диссоциируют так:
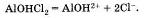
Типичные реакции солей

4. Coль + металл —> другая соль + другой металл.
Первые две реакции обмена уже были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием оселка, например:
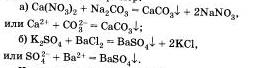
Четвертая реакция солей связана с именем крупнейшего русского химика Н.Н.Бекетова, который в 1865 г. изучал способность металлов вытеснять из растворов солей другие металлы. Например, медь tu растворов ее солей можно вытеснять такими металлами, как магний, алюминий Al, цинк и другими металлами. А вот ртутью, серебром Аg, золотом Аu медь не вытесняется, так как атм металлы в ряду напряжений расположены правее, чем медь. Зато медь вытесняет их из растворов солей:
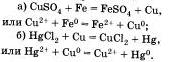
H. Бекетов, действуя газообразным водородом под давлением на растворы солей ртути и серебра, установил, что при атом водород, так же как и некоторые другие металлы, вытесняет ртуть и серебро из их солей.
Располагая металлы, я также водород по их способности вытеснять друг друга ял растворов солей. Бекетов составил ряд. который он назвал вытеенительным рядом металлов. Позднее (1802 г. В. Нерист) было доказано, что вытесни тельный ряд Векетовп практически совпадает с рядом, в котором металлы и водород расположены (направо) в порядке уменьшения их восствнояятеяьяой способности и молярной концентрации ионов металла, равна 1 моль/л. Этот ряд называют алектрохимычесиим рядам напряжений металлов. Вы уже знакомились с этим рядом, когда рассматривали взаимодействие кислот с металлами и выяснили, что с растворами кислот взаимодействуют металлы, которые расположены левее водорода. Это первое при вило ряда напряжений Оно выполняется с соблюдением ряда условий, о которых мы говорили ранее.
Второе правило ряда напряжений заключается в следующем: каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это правило также соблюдается при выполнении условий:
а) обе соли (и реагирующая, и образующяяся в результате реакции) должны быть растворимыми;
б) металлы ие должны аза имодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) ие вытесняют другие металлы на растворов солей.
1. Соли средние (нормальные), кислые и основные.
2. Диссоциация различных груп солей.
3. Типичные свойства нормальных солей: взаимодействие их с кислотами, щелочами, другими солями и металлами.
4. Два правила ряда напряжений металлов.
5. Условия протекания реакций солей с металлами.
Закончите молекулярные уравнения возможных реакций, протекающих в растворах, и запишите соответствующие им ионные уравнения:
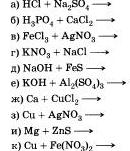
Если реакция не может быть осуществлена, объясните почему.
К 980 г 5% -го раствора сорной кислоты прилили избыток раствора нитрата бария. Найдите массу выпавшего осадка.
Запишите уравнения реакций всех возможных способов получения сульфата железа (II).
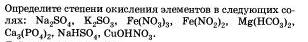
Дайте названия солей.
притчи к уроку химии, картинки к уроку химии 8 класса, рефераты для школьников
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|