|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 10 класс, Идеальный газ, в молекулярно-кинетической теории</metakeywords> | | <metakeywords>Физика, 10 класс, Идеальный газ, в молекулярно-кинетической теории</metakeywords> |
| | | | |
| - | Качественное объяснение основных свойств вещества на основе молекулярно-кинетической теории не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами (давлением, температурой и др.) и свойствами самих молекул, их числом и скоростью движения, весьма сложна.<br> '''Идеальный газ.''' У газа при обычных давлениях расстояние между молекулами во много раз превышает их размеры. В этом случае силы взаимодействия молекул пренебрежимо малы и кинетическая энергия молекул много больше потенциальной энергии взаимодействия. Молекулы газа можно рассматривать как материальные точки или очень маленькие твердые шарики. Вместо ''реального газа'', между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его ''модель - идеальный газ''.<br> '''Идеальный газ''' - это газ, взаимодействие между молекулами которого пренебрежимо мало. Естественно, при столкновении молекул идеального газа на них действует сила отталкивания. Так как молекулы газа мы можем согласно модели считать материальными точками, то размерами молекул мы пренебрегаем, считая, что объем, который они занимают, гораздо меньше объема сосуда.<br> Напомним, что в физической модели принимают во внимание лишь те свойства реальной системы, учет которых совершенно необходим для объяснения исследуемых закономерностей поведения этой системы. Ни одна модель не может передать все свойства системы. Сейчас нам предстоит решить довольно узкую задачу: вычислить с помощью молекулярно-кинетической теории давление идеального газа на стенки сосуда. Для этой задачи модель идеального газа оказывается вполне удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.<br> '''Давление газа в молекулярно-кинетической теории.''' Пусть газ находится в закрытом сосуде. Манометр показывает давление газа ''p<sub>0</sub>''. Как возникает это давление?<br> Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с некоторой силой. В результате беспорядочных ударов о стенку давление быстро меняется со временем примерно так, как показано на рисунке 8.12. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента - мембраны. Несмотря на небольшие изменения давления, среднее значение давления ''p<sub>0</sub> ''практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.<br>[[Image:a8.12.jpg|center]] Идеальный газ - модель реального газа. Согласно этой модели молекулы газа можно рассматривать как материальные точки, взаимодействие которых происходит только при их столкновении. Сталкиваясь со стенкой, молекулы газа оказывают на нее давление.<br><br><br> ???<br> 1. Чем пренебрегают, когда реальный газ рассматривают как идеальный?<br> 2. Газ оказывает давление на стенки сосуда. А давит ли один слой газа на другой?<br> | + | Качественное объяснение основных свойств вещества на основе молекулярно-кинетической теории не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами (давлением, температурой и др.) и свойствами самих молекул, их числом и скоростью движения, весьма сложна.<br> '''Идеальный газ.''' У газа при обычных давлениях расстояние между молекулами во много раз превышает их размеры. В этом случае силы взаимодействия молекул пренебрежимо малы и кинетическая энергия молекул много больше потенциальной энергии взаимодействия. Молекулы газа можно рассматривать как материальные точки или очень маленькие твердые шарики. Вместо ''реального газа'', между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его ''модель - идеальный газ''.<br> '''Идеальный газ''' - это газ, взаимодействие между молекулами которого пренебрежимо мало. Естественно, при столкновении молекул идеального газа на них действует сила отталкивания. Так как молекулы газа мы можем согласно модели считать материальными точками, то размерами молекул мы пренебрегаем, считая, что объем, который они занимают, гораздо меньше объема сосуда.<br> Напомним, что в физической модели принимают во внимание лишь те свойства реальной системы, учет которых совершенно необходим для объяснения исследуемых закономерностей поведения этой системы. Ни одна модель не может передать все свойства системы. Сейчас нам предстоит решить довольно узкую задачу: вычислить с помощью молекулярно-кинетической теории давление идеального газа на стенки сосуда. Для этой задачи модель идеального газа оказывается вполне удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.<br> '''Давление газа в молекулярно-кинетической теории.''' Пусть газ находится в закрытом сосуде. Манометр показывает давление газа ''p<sub>0</sub>''. Как возникает это давление?<br> Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с некоторой силой. В результате беспорядочных ударов о стенку давление быстро меняется со временем примерно так, как показано на рисунке 8.12. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента - мембраны. Несмотря на небольшие изменения давления, среднее значение давления ''p<sub>0</sub> ''практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.<br>[[Image:A8.12.jpg|center|183x129px]] Идеальный газ - модель реального газа. Согласно этой модели молекулы газа можно рассматривать как материальные точки, взаимодействие которых происходит только при их столкновении. Сталкиваясь со стенкой, молекулы газа оказывают на нее давление.<br><br><br> ???<br> 1. Чем пренебрегают, когда реальный газ рассматривают как идеальный?<br> 2. Газ оказывает давление на стенки сосуда. А давит ли один слой газа на другой?<br> |
| | | | |
| - | | + | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' |
| - | ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' | + | |
| | | | |
| | <br> <sub>[[Гипермаркет знаний - первый в мире!|Учебники и книги по всем предметам]], домашняя работа, онлайн библиотека книг, планы конспектов уроков [[Физика и астрономия|по физике]], рефераты и конспекты уроков [[Физика 10 класс|по физике для 10 класса]]</sub> | | <br> <sub>[[Гипермаркет знаний - первый в мире!|Учебники и книги по всем предметам]], домашняя работа, онлайн библиотека книг, планы конспектов уроков [[Физика и астрономия|по физике]], рефераты и конспекты уроков [[Физика 10 класс|по физике для 10 класса]]</sub> |
Версия 21:33, 20 августа 2010
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Идеальный газ в молекулярно-кинетической теории
Качественное объяснение основных свойств вещества на основе молекулярно-кинетической теории не является особенно сложным. Однако теория, устанавливающая количественные связи между измеряемыми на опыте величинами (давлением, температурой и др.) и свойствами самих молекул, их числом и скоростью движения, весьма сложна.
Идеальный газ. У газа при обычных давлениях расстояние между молекулами во много раз превышает их размеры. В этом случае силы взаимодействия молекул пренебрежимо малы и кинетическая энергия молекул много больше потенциальной энергии взаимодействия. Молекулы газа можно рассматривать как материальные точки или очень маленькие твердые шарики. Вместо реального газа, между молекулами которого действуют сложные силы взаимодействия, мы будем рассматривать его модель - идеальный газ.
Идеальный газ - это газ, взаимодействие между молекулами которого пренебрежимо мало. Естественно, при столкновении молекул идеального газа на них действует сила отталкивания. Так как молекулы газа мы можем согласно модели считать материальными точками, то размерами молекул мы пренебрегаем, считая, что объем, который они занимают, гораздо меньше объема сосуда.
Напомним, что в физической модели принимают во внимание лишь те свойства реальной системы, учет которых совершенно необходим для объяснения исследуемых закономерностей поведения этой системы. Ни одна модель не может передать все свойства системы. Сейчас нам предстоит решить довольно узкую задачу: вычислить с помощью молекулярно-кинетической теории давление идеального газа на стенки сосуда. Для этой задачи модель идеального газа оказывается вполне удовлетворительной. Она приводит к результатам, которые подтверждаются опытом.
Давление газа в молекулярно-кинетической теории. Пусть газ находится в закрытом сосуде. Манометр показывает давление газа p0. Как возникает это давление?
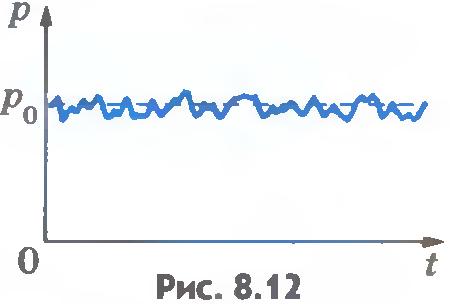
Каждая молекула газа, ударяясь о стенку, в течение малого промежутка времени действует на нее с некоторой силой. В результате беспорядочных ударов о стенку давление быстро меняется со временем примерно так, как показано на рисунке 8.12. Однако действия, вызванные ударами отдельных молекул, настолько слабы, что манометром они не регистрируются. Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности его чувствительного элемента - мембраны. Несмотря на небольшие изменения давления, среднее значение давления p0 практически оказывается вполне определенной величиной, так как ударов о стенку очень много, а массы молекул очень малы.
Идеальный газ - модель реального газа. Согласно этой модели молекулы газа можно рассматривать как материальные точки, взаимодействие которых происходит только при их столкновении. Сталкиваясь со стенкой, молекулы газа оказывают на нее давление.
???
1. Чем пренебрегают, когда реальный газ рассматривают как идеальный?
2. Газ оказывает давление на стенки сосуда. А давит ли один слой газа на другой?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Учебники и книги по всем предметам, домашняя работа, онлайн библиотека книг, планы конспектов уроков по физике, рефераты и конспекты уроков по физике для 10 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|