|
|
|
| Строка 3: |
Строка 3: |
| | Розглянемо приклади сумішей. | | Розглянемо приклади сумішей. |
| | | | |
| - | <br> | + | [[Image:him7_4_1,jpg]]<br> |
| | | | |
| | ''Малюнок 1. Кисень '' | | ''Малюнок 1. Кисень '' |
| | | | |
| - | <br> | + | [[Image:him7_4_2.jpg]]<br> |
| | | | |
| - | ''Малюнок 2. Морська вода <br><br>Малюнок 3. Молоко <br> <br>Малюнок 4. Металеві вироби''<br><br>Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилася вище певної межі. Не потрібно думати, що чисті речовини абсолютно у всіх випадках краще за суміші. Наприклад, не можна дихати чистим киснем. Якби з атмосфери раптом по якихось причинах зник азот, що “розбавляє ” кисень до безпечного рівня, всі живі організми на суші загинули б протягом декількох годин, а рослинність на всіх континентах була б повністю знищена жахливою пожежею.<br>Хімічні речовини характеризуються строго певними властивостями. При тиску 101,3 кПа, вода кипить при 100°С, замерзає при 0°С, але морська вода замерзає при температурі -1,9°С, оскільки в ній розчинені солі. Таким чином, властивість суміші може відрізнятися від властивостей компонентів. Вам відомо, що алюміній пластичний метал. Адже в минулому столітті вважали, що алюміній важко витягнути в дріт і прокатати в тонкі листи. Як виявилось, у той час мали справу не з чистим металом, а з металом забрудненим домішками. З тієї ж причини хром вважали крихким металом, поки не виділи його з вмістом домішок не більше 10 -5 %, тоді і була виявлена його пластичність. Чисті речовини - це речовини з постійними фізичними властивостями. У сучасній хімії навчилися отримувати особливо чисті речовини, що містять 1-10 % домішок. Це речовини, що містять на 300 мільярдів атомів всього 1 атом домішки. <br>Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилося вище певної межі.<br>Особливо чисті речовини потрібні в атомній енергетиці, напівпровідниковій промисловості, скловолоконовій оптиці. Тому одним з найважливіших завдань хімії є здобуття чистих речовин. Їх можна або синтезувати, або виділити в результаті розділення сумішей. У хімії використовують і інші способи розділення сумішей. Вони засновані на тому, що і в сумішах речовини зберігають свої фізичні властивості. Розглянемо деякі способи розділення сумішей:<br>1. ВІДСТОЮВАННЯ. <br>а) Наллємо брудну воду в хімічну склянку і залишимо у спокої на деякий час.<br><br>''Малюнок 5а. Відстоювання''<br><br>б) Та ж сама склянка через 30 хвилин.<br><br>Найбільш крупні частки домішок осіли на дно. Рідина у верхній частині склянки посвітлішала. Якщо на поверхні є тонка веселкова плівка - значить, вода забруднена не лише частинками грунту, мула, але і нафтопродуктами.<br><br> 2. ФІЛЬТРУВАННЯ. <br>Потрібно обережно злити рідину з осаду у воронку, в яку вставлений фільтр з пористого паперу. <br>''<br>Малюнок 6. Фільтрування''<br>Воронка знаходиться в іншій судині, в якій скупчується вже набагато чистіша вода. На фільтрі залишаються дрібні частки домішок. Отримана вода ще не придатна для пиття, оскільки в ній містяться бактерії, а також розчинені органічні речовини і солі. Але вона вже сповна придатна для того, щоб помити дошку або полити квітку.<br><br>3. ПЕРЕГОНКА або ДИСТИЛЯЦІЯ. <br>''<br>Малюнок 7. Дисталяція''<br>Зберемо прилад, показаний на малюнку, переллємо забруднену воду в перегінну колбу, помістимо туди ж кипілки (дрібні шматочки фарфору або цеглини, які потрібні для спокійного кипіння рідини), включимо скляний холодильник (охолоджується водопровідною водою) і нагріватимемо рідину в колбі до кипіння. Вода перетворюється на пару, яка через скляну насадку потрапляє у холодильник і конденсується. Термометр у верхній частині колби повинен показувати 100 градусів - температуру кипіння води. Перші 1-2 мл дистиляту слід відкинути, тому що у воді можуть знаходитися домішки легких нафтопродуктів (бензину). Коли перегонка добігає кінця, слід бути уважним і залишити трохи рідини в колбі, щоб не перегналися інші, більш висококиплячі домішки (сліди важких нафтопродуктів). Залишок в колбі містить усі раніше розчинені у воді солі, залишки механічних забруднень і виглядає не дуже привабливо. Зате воду, зібрану на виході з приладу, можна не боязливо пити. | + | ''Малюнок 2. Морська вода <br>[[Image:him7_4_3.jpg]]<br>Малюнок 3. Молоко <br> [[Image:him7_4_4.jpg]]<br>Малюнок 4. Металеві вироби''<br><br>Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилася вище певної межі. Не потрібно думати, що чисті речовини абсолютно у всіх випадках краще за суміші. Наприклад, не можна дихати чистим киснем. Якби з атмосфери раптом по якихось причинах зник азот, що “розбавляє ” кисень до безпечного рівня, всі живі організми на суші загинули б протягом декількох годин, а рослинність на всіх континентах була б повністю знищена жахливою пожежею.<br>Хімічні речовини характеризуються строго певними властивостями. При тиску 101,3 кПа, вода кипить при 100°С, замерзає при 0°С, але морська вода замерзає при температурі -1,9°С, оскільки в ній розчинені солі. Таким чином, властивість суміші може відрізнятися від властивостей компонентів. Вам відомо, що алюміній пластичний метал. Адже в минулому столітті вважали, що алюміній важко витягнути в дріт і прокатати в тонкі листи. Як виявилось, у той час мали справу не з чистим металом, а з металом забрудненим домішками. З тієї ж причини хром вважали крихким металом, поки не виділи його з вмістом домішок не більше 10 -5 %, тоді і була виявлена його пластичність. Чисті речовини - це речовини з постійними фізичними властивостями. У сучасній хімії навчилися отримувати особливо чисті речовини, що містять 1-10 % домішок. Це речовини, що містять на 300 мільярдів атомів всього 1 атом домішки. <br>Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилося вище певної межі.<br>Особливо чисті речовини потрібні в атомній енергетиці, напівпровідниковій промисловості, скловолоконовій оптиці. Тому одним з найважливіших завдань хімії є здобуття чистих речовин. Їх можна або синтезувати, або виділити в результаті розділення сумішей. У хімії використовують і інші способи розділення сумішей. Вони засновані на тому, що і в сумішах речовини зберігають свої фізичні властивості. Розглянемо деякі способи розділення сумішей:<br>1. ВІДСТОЮВАННЯ. <br>а) Наллємо брудну воду в хімічну склянку і залишимо у спокої на деякий час.<br>[[Image:him7_4_5.jpg]]<br>''Малюнок 5а. Відстоювання''<br><br>б) Та ж сама склянка через 30 хвилин.<br><br>Найбільш крупні частки домішок осіли на дно. Рідина у верхній частині склянки посвітлішала. Якщо на поверхні є тонка веселкова плівка - значить, вода забруднена не лише частинками грунту, мула, але і нафтопродуктами.<br><br> 2. ФІЛЬТРУВАННЯ. <br>Потрібно обережно злити рідину з осаду у воронку, в яку вставлений фільтр з пористого паперу. <br>''[[Image:him7_4_6.jpg]]<br>Малюнок 6. Фільтрування''<br>Воронка знаходиться в іншій судині, в якій скупчується вже набагато чистіша вода. На фільтрі залишаються дрібні частки домішок. Отримана вода ще не придатна для пиття, оскільки в ній містяться бактерії, а також розчинені органічні речовини і солі. Але вона вже сповна придатна для того, щоб помити дошку або полити квітку.<br><br>3. ПЕРЕГОНКА або ДИСТИЛЯЦІЯ. <br>''[[Image:him7_4_7.jpg]]<br>Малюнок 7. Дисталяція''<br>Зберемо прилад, показаний на малюнку, переллємо забруднену воду в перегінну колбу, помістимо туди ж кипілки (дрібні шматочки фарфору або цеглини, які потрібні для спокійного кипіння рідини), включимо скляний холодильник (охолоджується водопровідною водою) і нагріватимемо рідину в колбі до кипіння. Вода перетворюється на пару, яка через скляну насадку потрапляє у холодильник і конденсується. Термометр у верхній частині колби повинен показувати 100 градусів - температуру кипіння води. Перші 1-2 мл дистиляту слід відкинути, тому що у воді можуть знаходитися домішки легких нафтопродуктів (бензину). Коли перегонка добігає кінця, слід бути уважним і залишити трохи рідини в колбі, щоб не перегналися інші, більш висококиплячі домішки (сліди важких нафтопродуктів). Залишок в колбі містить усі раніше розчинені у воді солі, залишки механічних забруднень і виглядає не дуже привабливо. Зате воду, зібрану на виході з приладу, можна не боязливо пити. |
| | | | |
| | <br>http://www.youtube.com/watch?v=li0jzuQu8Vg<br>''Відео'' | | <br>http://www.youtube.com/watch?v=li0jzuQu8Vg<br>''Відео'' |
| | | | |
| - | <br>4. ДІЯ МАГНІТОМ<br>За допомогою магніту можна легко відокремити залізну тирсу від порошку сірки. Таке розділення засноване на особливій властивості заліза – здатності притягуватися до магніту.<br><br>''Малюнок 8. Дія магнітом.'' | + | <br>4. ДІЯ МАГНІТОМ<br>За допомогою магніту можна легко відокремити залізну тирсу від порошку сірки. Таке розділення засноване на особливій властивості заліза – здатності притягуватися до магніту.<br>[[Image:him7_4_8.jpg]]<br>''Малюнок 8. Дія магнітом.'' |
| | | | |
| | <br>http://www.youtube.com/watch?v=8b9jdZYwKug<br>''Відео'' | | <br>http://www.youtube.com/watch?v=8b9jdZYwKug<br>''Відео'' |
| | | | |
| - | <br>5. РОЗДІЛЕННЯ ЗА ДОПОМОГОЮ ДІЛИЛЬНОЇ ВОРОНКИ<br> У плоскодонну колбу наливають рівні об'єми води і рослинної олії. <br>''<br>Малюнок 9. Ділильна воронка''<br><br>При інтенсивному збовтуванні вода і масло розбиваються на дрібні крапельки і перемішуються, утворюється каламутна суміш. Дуже швидко ця суміш знову розшаровується на важчий водний шар і масло, спливаюче вгору. Відокремити повністю верхній шар досить складний. А ось за допомогою ділильної воронки розділення такої суміші дуже легко. | + | <br>5. РОЗДІЛЕННЯ ЗА ДОПОМОГОЮ ДІЛИЛЬНОЇ ВОРОНКИ<br> У плоскодонну колбу наливають рівні об'єми води і рослинної олії. <br>''[[Image:him7_4_9.jpg]]<br>Малюнок 9. Ділильна воронка''<br><br>При інтенсивному збовтуванні вода і масло розбиваються на дрібні крапельки і перемішуються, утворюється каламутна суміш. Дуже швидко ця суміш знову розшаровується на важчий водний шар і масло, спливаюче вгору. Відокремити повністю верхній шар досить складний. А ось за допомогою ділильної воронки розділення такої суміші дуже легко. |
| | | | |
| | <br>http://www.youtube.com/watch?v=w5BA852Qb-M&feature=related<br>Відео | | <br>http://www.youtube.com/watch?v=w5BA852Qb-M&feature=related<br>Відео |
| | | | |
| - | <br>6. ВИПАРОВУВАННЯ<br> Виділення розчинених в рідині твердих речовин способом її перетворення на пару.<br><br>''Малюнок 10. Випаровування''<br><br>У стакані з водою сіль не зникла, хоча стала невидимою – розчин прозорий. Випаровування дозволило виділити з суміші речовин (води і солі) розчинену у воді речовину. На склі видно кристали куховарської солі. При цьому підтверджується вивід про те, що кожна речовина (і вода, і сіль) суміші зберігає свої властивості. | + | <br>6. ВИПАРОВУВАННЯ<br> Виділення розчинених в рідині твердих речовин способом її перетворення на пару.<br>[[Image:him7_4_10.jpg]]<br>''Малюнок 10. Випаровування''<br><br>У стакані з водою сіль не зникла, хоча стала невидимою – розчин прозорий. Випаровування дозволило виділити з суміші речовин (води і солі) розчинену у воді речовину. На склі видно кристали куховарської солі. При цьому підтверджується вивід про те, що кожна речовина (і вода, і сіль) суміші зберігає свої властивості. |
| | | | |
| | <br>http://www.youtube.com/watch?v=Fs-RtQUXxqg<br>''Відео'' | | <br>http://www.youtube.com/watch?v=Fs-RtQUXxqg<br>''Відео'' |
Версия 15:47, 24 октября 2010
Гіпермаркет Знань>>Хімія>>Хімія 7 клас. Повні уроки>>Хімія: Речовини. Чисті речовини і суміші
Мета уроку:
1. Сформувати уявлення про чисті речовини і суміші, способи розділення сумішей.
2. Вивчити відмінності чистих речовин і сумішей;
3. Вивчити класифікації сумішей;
4. Вивчити деякі способи розділення сумішей і властивості, лежачі в основі розділення;
5. Формування прийомів розумової діяльності: аналізу, синтезу, порівняння, узагальнення;
6. Розвивати уміння правильно спостерігати і робити виводи із спостережень.
Хід уроку:
Чисті речовини в природі зустрічаються дуже рідко, частіше речовини зустрічаються у вигляді сумішей. Повітря є суміш кисню, вуглекислого газу, азоту і деяких інших газів; морська вода - суміш води і солей; молоко - суміш води, жиру, білка; металеві вироби - суміші різних металів, які називаються сплавами.
Слово "суміш" сталося від слів "змішувати", "перемішувати". Суміш складається з двох і більш за компоненти, що знаходяться в безпосередньому контакті один з одним.
Розглянемо приклади сумішей.
Файл:Him7 4 1,jpg
Малюнок 1. Кисень

Малюнок 2. Морська вода

Малюнок 3. Молоко

Малюнок 4. Металеві вироби
Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилася вище певної межі. Не потрібно думати, що чисті речовини абсолютно у всіх випадках краще за суміші. Наприклад, не можна дихати чистим киснем. Якби з атмосфери раптом по якихось причинах зник азот, що “розбавляє ” кисень до безпечного рівня, всі живі організми на суші загинули б протягом декількох годин, а рослинність на всіх континентах була б повністю знищена жахливою пожежею.
Хімічні речовини характеризуються строго певними властивостями. При тиску 101,3 кПа, вода кипить при 100°С, замерзає при 0°С, але морська вода замерзає при температурі -1,9°С, оскільки в ній розчинені солі. Таким чином, властивість суміші може відрізнятися від властивостей компонентів. Вам відомо, що алюміній пластичний метал. Адже в минулому столітті вважали, що алюміній важко витягнути в дріт і прокатати в тонкі листи. Як виявилось, у той час мали справу не з чистим металом, а з металом забрудненим домішками. З тієї ж причини хром вважали крихким металом, поки не виділи його з вмістом домішок не більше 10 -5 %, тоді і була виявлена його пластичність. Чисті речовини - це речовини з постійними фізичними властивостями. У сучасній хімії навчилися отримувати особливо чисті речовини, що містять 1-10 % домішок. Це речовини, що містять на 300 мільярдів атомів всього 1 атом домішки.
Реальні речовини завжди містять якісь домішки. Навіть лікарські речовини, до чистоти яких пред'являються особливі вимоги, завжди містять незначні домішки інших речовин. Але ці домішок так мало, що наш організм їх просто не помічає. В той же час ліки з минулим терміном придатності можуть стати неактивними або навіть надати побічну дію, оскільки кількість домішок в нім накопичилося вище певної межі.
Особливо чисті речовини потрібні в атомній енергетиці, напівпровідниковій промисловості, скловолоконовій оптиці. Тому одним з найважливіших завдань хімії є здобуття чистих речовин. Їх можна або синтезувати, або виділити в результаті розділення сумішей. У хімії використовують і інші способи розділення сумішей. Вони засновані на тому, що і в сумішах речовини зберігають свої фізичні властивості. Розглянемо деякі способи розділення сумішей:
1. ВІДСТОЮВАННЯ.
а) Наллємо брудну воду в хімічну склянку і залишимо у спокої на деякий час.

Малюнок 5а. Відстоювання
б) Та ж сама склянка через 30 хвилин.
Найбільш крупні частки домішок осіли на дно. Рідина у верхній частині склянки посвітлішала. Якщо на поверхні є тонка веселкова плівка - значить, вода забруднена не лише частинками грунту, мула, але і нафтопродуктами.
2. ФІЛЬТРУВАННЯ.
Потрібно обережно злити рідину з осаду у воронку, в яку вставлений фільтр з пористого паперу.

Малюнок 6. Фільтрування
Воронка знаходиться в іншій судині, в якій скупчується вже набагато чистіша вода. На фільтрі залишаються дрібні частки домішок. Отримана вода ще не придатна для пиття, оскільки в ній містяться бактерії, а також розчинені органічні речовини і солі. Але вона вже сповна придатна для того, щоб помити дошку або полити квітку.
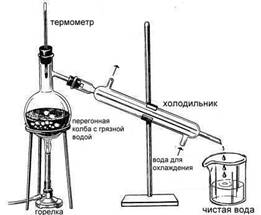
3. ПЕРЕГОНКА або ДИСТИЛЯЦІЯ.

Малюнок 7. Дисталяція
Зберемо прилад, показаний на малюнку, переллємо забруднену воду в перегінну колбу, помістимо туди ж кипілки (дрібні шматочки фарфору або цеглини, які потрібні для спокійного кипіння рідини), включимо скляний холодильник (охолоджується водопровідною водою) і нагріватимемо рідину в колбі до кипіння. Вода перетворюється на пару, яка через скляну насадку потрапляє у холодильник і конденсується. Термометр у верхній частині колби повинен показувати 100 градусів - температуру кипіння води. Перші 1-2 мл дистиляту слід відкинути, тому що у воді можуть знаходитися домішки легких нафтопродуктів (бензину). Коли перегонка добігає кінця, слід бути уважним і залишити трохи рідини в колбі, щоб не перегналися інші, більш висококиплячі домішки (сліди важких нафтопродуктів). Залишок в колбі містить усі раніше розчинені у воді солі, залишки механічних забруднень і виглядає не дуже привабливо. Зате воду, зібрану на виході з приладу, можна не боязливо пити.
http://www.youtube.com/watch?v=li0jzuQu8Vg
Відео
4. ДІЯ МАГНІТОМ
За допомогою магніту можна легко відокремити залізну тирсу від порошку сірки. Таке розділення засноване на особливій властивості заліза – здатності притягуватися до магніту.
Малюнок 8. Дія магнітом.
http://www.youtube.com/watch?v=8b9jdZYwKug
Відео
5. РОЗДІЛЕННЯ ЗА ДОПОМОГОЮ ДІЛИЛЬНОЇ ВОРОНКИ
У плоскодонну колбу наливають рівні об'єми води і рослинної олії.

Малюнок 9. Ділильна воронка
При інтенсивному збовтуванні вода і масло розбиваються на дрібні крапельки і перемішуються, утворюється каламутна суміш. Дуже швидко ця суміш знову розшаровується на важчий водний шар і масло, спливаюче вгору. Відокремити повністю верхній шар досить складний. А ось за допомогою ділильної воронки розділення такої суміші дуже легко.
http://www.youtube.com/watch?v=w5BA852Qb-M&feature=related
Відео
6. ВИПАРОВУВАННЯ
Виділення розчинених в рідині твердих речовин способом її перетворення на пару.

Малюнок 10. Випаровування
У стакані з водою сіль не зникла, хоча стала невидимою – розчин прозорий. Випаровування дозволило виділити з суміші речовин (води і солі) розчинену у воді речовину. На склі видно кристали куховарської солі. При цьому підтверджується вивід про те, що кожна речовина (і вода, і сіль) суміші зберігає свої властивості.
http://www.youtube.com/watch?v=Fs-RtQUXxqg
Відео
Контролюючий блок
1. Які бувають суміші?
2. Розгорніть поняття – чиста речовина.
3. Перерахуйте способи розділення сумішей
4. Який спосіб знадобиться щоб розділити рослинну олію і воду?
Список використаних джерел:
Алікберова Л.Ю. Цікава хімія. М.: АСТ-прес, 2001; ;
Тильдсепп А.А., Корк В.А. Ми вивчаємо хімію. М.: Освіта, 1999.
Кузнецов В.І. Загальна хімія. Тенденції розвитку. М., 2003.
Кузнецов В.І., Ідліс ГМ., Гутіна В.Н. Природознавство. М., 2006.
Піліпенко А. Т., Пятніцкий І. В. Аналітічеськая хімія. — М.: Хімія, 2000. Кн. 1, 2. В.П. Васильев Аналітична хімія – М.: Дрохва 2004 р.
Основи аналітичної хімії / Під ред. академіка Ю. А. Золотова. — М.: Вища школа, 2002. Кн. 1, 2.
Евдокиомв Ю., кандидат химіч. наук. До історії періодичного закону. Наука і життя № 5 (2009), С. 12-15
Відредаговано та вислано Горбатко С. М.
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
Предмети > Хімія > Хімія 7 клас
|



















