|
Гіпермаркет Знань>>Хімія>>Хімія 8 клас. Повні уроки>>Хімія: Розрахунки за хімічними рівняннями маси та кількості речовини. Повні уроки
Тема
Мета уроку
Задачі уроку
Основні терміни
Хід урокуУзагальнення знань понять маси та кількості речовини.Суть атомно-молекулярного вчення М.В. Ломоносова (1741 р.) можна звести до таких положень: Мал. 1. Ломоносов М.В. Докладніше щодо атомно-молекулярного вчення ви можете дізнатися з наступного відео. Відео 1. Атомно-молекулярне вчення.
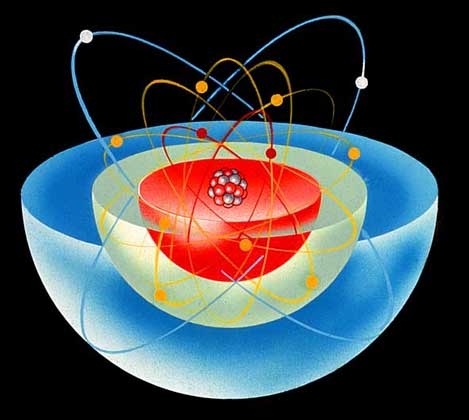
На міжнародному з’їзді у м. Карлсруе у 1860 р. було прийнято означення понять «молекула» й «атом». Молекула – це найменша частинка даної речовини, що має її хімічні властивості. Хімічні властивості молекули визначаються її складом і хімічною будовою. Згідно з сучасним уявленням, із молекул складаються гази (окрім інертних газів) і речовини у пароподібному стані. У твердому стані з молекул складаються тільки ті речовини, кристалічна решітка яких має молекулярну структуру, наприклад: органічні речовини, вода, більшість неметалів. Атом – це найменша частинка хімічного елемента, що входить до складу молекул простих і складних речовин. Згідно із сучасними уявленнями: Атом – це електронейтральна частинка, що складається з позитивно зарядженого атомного ядра і негативно заряджених електронів. Мал. 3. Структура атома. Якщо вас цікавить як влаштований атом, його структура, то до вашої уваги наступне відео. Відео 2. Модель атому.
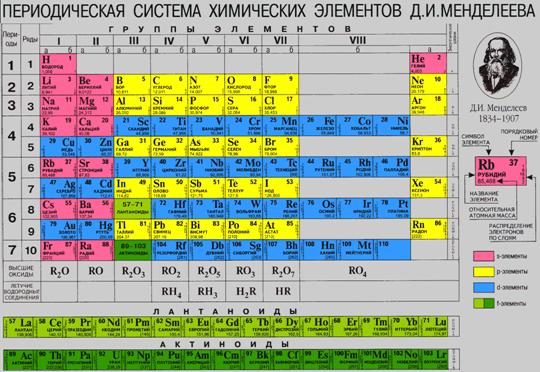
Кожний окремий вид атомів має назву хімічного елемента. Хімічний елемент – це певний вид атомів з однаковим позитивним зарядом ядра. Відомо 110 елементів. Мал. 4. Періодична система хімічних елементів. Хімічні речовини бувають прості і складні. Багато простих елементів утворюють кілька простих речовин, що розрізняються будовою та властивостями. Це явище називається алотропією, а речовини, що утворюються, - алотропними видозмінами або модифікаціями. Так, елемент Карбон утворю три алотропні модифікації: алмаз, графіт, карбін. Щоб краще зрозуміти що ж таке «алотропія», пропонуємо переглянути наступне відео. Відео 3. Алотропія вуглецю.
Кількість речовини – це величина, яка характеризує числове відображення частинок у сполуці (речовині). Контролюючий блок 1
Визначення маси та кількості речовини за хімічними рівняннямиСпробуємо вирішити типову задачу на визначення маси речовини. До розчину, що містить магній сульфат масою 10 г, долили розчин, що містить калій гідроксид масою 11,2 г. Обчислити масу осаду, добутого у результаті реакції. Мал. 5. Магній сульфат. Розв’язання. По-перше, напишемо рівняння реакції і розставимо дані умови задачі: По-друге, визначимо, яку з вихідних речовин узято з надлишком: По-третє, визначимо масу магній гідроксиду, що випадає в осад, виконуючи розрахунки за магній сульфатом, який узято з недостачею: Отже, маса осаду, отриманого у результаті реакції становить 4,83 г. Розглянемо ще один приклад. Треба обчислити масу осаду, що утвориться у результаті взаємодії надлишку розчину натрій хлориду з розчином арґентум нітрату масою 17г, якщо масова частка останнього становить 10%. Мал. 6. Натрій хлорид. Спочатку обчислимо масу AgNO3 у взятому розчині: Напишемо рівняння реакції, визначимо речовину, що випадає в осад і обчислимо її масу: Отже, маса осаду = 1,435 г. Контролюючий блок 2
Домашнє завданняДайте визначення поняттю «алотропія». Зробіть загальну характеристику та приклади. Цікаво знати, що…Усі спостерігали горіння в повітрі різних вуглецевих сполук: дерева, кам’яного вугілля, природного газу. Тощо. Горіння цих речовин відбувається легко, оскільки температура запалювання їх невисока. Багатьом нерідко доводилось спостерігати також горіння металу (наприклад заліза) при зварюванні металевих конструкцій, труб тощо. В усі боки тоді летять розпечені до білого кольору шматки металевої окалини. Отже, за певних умов (при високій температурі і наявності кисню) метал енергійно згоряє. У хімічні лабораторії неважко спалити невелику стальну річ. Для цього закріпіть на залізному дроті тоненьку стальну голку. На кінець голки помістіть невеликий шматочок дерева, наприклад, третину звичайного сірника. Запаліть дерево на повітрі і внесіть увесь пристрій у банку з киснем. Від температури горіння дерева голка нагрівається і енергійно згоряє в атмосфері кисню, розкидаючи в усі боки шматочки розпеченої окалини. Явище нагадує бенгальський вогонь. Банку можна заповнити киснем, безпосередньо витискуючи ним повітря. Для того, щоб дно банки не тріснуло від шматочків розпеченої окалини, слід перед спробою насипати в неї шар піску. Замість голки можна взяти закручений в спіраль тонкий стальний дріт. Список використаних джерел1. Урок на тему «Хімічні рівняння та розрахунки за ними» Князєвої М. В., вчителя хімії, м. Бєлгород, СШ №39.
Князєва М.В. Малова О.М Лісняк А.В.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: