|
ХІМІЧНИЙ СКЛАД ЖИВИХ ОРГАНІЗМІВ. НЕОРГАНІЧНІ СПОЛУКИ
Що спільного між живою та неживою природою? Які основні неорганічні сполуки входять до складу живих організмів? Які їхні функції? Що таке катіони і аніони?
Що вивчає біохімія? Науку, що вивчає хімічний склад живих організмів, будову, властивості та роль виявлених у них сполук, шляхи їхнього виникнення та перетворення, називають біологічною хімією, або біохімією. Ця наука як галузь біології сформувалась у другій половині XIX століття.
Сучасна біохімія досліджує живу матерію на різних рівнях її організації: молекулярному, клітинному, організмовому. Одне з основних її завдань - з'ясування механізмів регуляції життєдіяльності клітин і організму в цілому, які забезпечують єдність процесів обміну речовин та перетворення енергії в організмі.
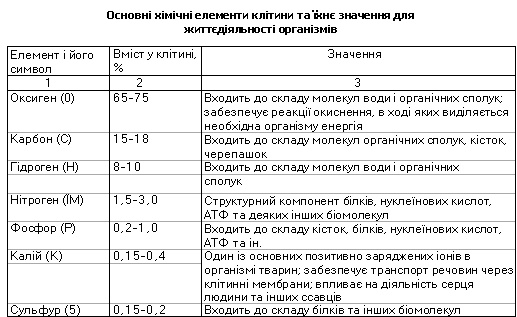
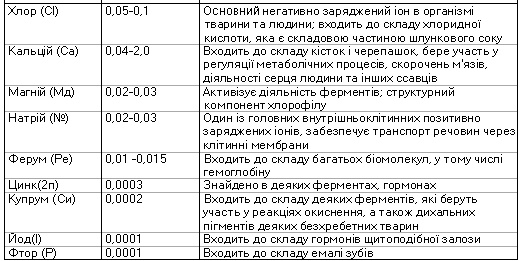
Який елементарний хімічний склад живих організмів? Живі організми містять майже всі відомі в природі хімічні елементи. Одні з них виявлені в усіх організмів без винятку, інші - лише в окремих або трапляються зрідка (див. таблицю).
Хімічний склад живих організмів відносно сталий. У найбільшій кількості в них наявні чотири хімічні елементи: Гідроген, Карбон, Нітроген і Окси-ген. їхня частка у хімічному складі клітини становить майже 98%, і вони належать до макроелементів. їх називають також органогенними, оскільки насамперед ці елементи входять до складу органічних сполук.
До макроелементів також належать Фосфор, Калій, Сульфур, Хлор, Кальцій, Магній, Натрій і Ферум, їхня сумарна частка становить до 1,9%. Понад 50 хімічних елементів відносять до мікроелементів (Йод, Кобальт, Манган, Купрум, Молібден, Цинк тощо). їхній вміст у клітині - від 10~12 до 10~3 %. Ще менше у клітині ультрамікроелементів: Плюмбуму, Брому, Аргентуму, Ауруму та ін. Хімічні елементи, що містяться в клітині, входять до складу органічних та неорганічних сполук або перебувають у вигляді іонів.
Хімічний склад усіх живих організмів відносно подібний. Натомість, у різних компонентів неживої природи він різний. Наприклад, у водній оболонці Землі (гідросфері) переважають Гідроген і Оксиген, у газоподібній (атмосфері) - Оксиген і Нітроген, у твердій (літосфері) — Силіцій, Оксиген та ін.
Які властивості води? Серед неорганічних сполук живих організмів особлива роль належить воді. Вода є основним середовищем, у якому відбуваються процеси обміну речовин та перетворення енергії. Вміст води в більшості живих організмів становить 60—70%, а в деяких (наприклад, у медуз) -до 98%. Вода утворює основу внутрішнього середовища живих організмів (крові, лімфи, міжклітинної рідини).
Вода має унікальні хімічні та фізичні властивості. Порівняно з іншими рідинами в неї відносно висока температура кипіння і випаровування. Молекула води (Н20) складається з двох атомів Гідрогену, які пов'язані міцним ковалентним зв'язком з атомом Оксигену. Молекула води елвктронейт-ральна, бо на її різних полюсах розташовані позитивний та негативний електричні заряди. Це визначає і таку властивість молекули води, як полярність. Саме завдяки полярності сусідні молекули води можуть притягуватись одна до одної: сили електричної взаємодії виникають між негативним зарядом на атомі Оксигену однієї молекули та позитивним зарядом на атомі Гідрогену іншої. Такий тип зв'язку називають водневим. Він у 15-20 разів слабший за ковалентний.
Які функції води в клітині? Вода визначає внутрішньоклітинний тиск (тургор) та об'єм клітин. Вона здатна формувати водну оболонку навколо певних сполук (наприклад, білків), що запобігає їхній взаємодії між собою. Таку воду називають зв'язаною (структурованою). її частка становить 4 - 5% від загальної кількості води в організмі. Іншу частину води (95 - 96%), не зв'язану з іншими сполуками, називають вільною. Саме вільна вода є універсальним розчинником, кращим, ніж більшість інших рідин.
Залежно від того, розчиняються певні сполуки у воді чи ні, їх умовно поділяють на гідрофільні, або полярні, та гідрофобні, або неполярні. До гідрофільних (від грец. хідор - вода та філіа - люблю) сполук, здатних розчинятись у воді, належить більшість солей, наприклад, кухонна сіль (КаСІ). Вода розчиняє більшість речовин, які містять групи (-ОН, -СООН та ін.), здатні іонізуватися (тобто розпадатися на електрично заряджені частинки) під час взаємодії з нею.
Гідрофобні (від грец. фобос - страх) сполуки (майже всі жири, деякі білки та ін.) містять неполярні групи (-СН.,, -СН2СН;) та ін.), які не взаємодіють з водою, тому в ній не розчиняються.
Вода як універсальний розчинник відіграє надзвичайно важливу роль у живих організмах, оскільки більшість біохімічних реакцій відбувається у водних розчинах. Надходять речовини у клітини та виводяться з них продукти життєдіяльності також переважно в розчиненому вигляді. Вода бере безпосередню участь у реакціях гідролізу (від грец. лізіс - розкладання) - розщеплення органічних сполук з приєднанням до місця розриву іонів молекули води (Н+ та ОН").
З водою пов'язана також регуляція теплового режиму організмів. їй притаманна велика теплоємність, тобто здатність поглинати тепло за незначних змін власної температури. Завдяки цьому вода запобігає різким змінам температури в клітинах і в організмі в цілому за значних її коливань у навколишньому середовищі. Під час випаровування води організми витрачають багато тепла. Так вони захищають себе від перегрівання. Завдяки високій теплопровідності, вода забезпечує рівномірний розподіл теплоти між тканинами організму, циркулюючи по порожнинах органів і тіла (порожнинна рідина, кров, лімфа тощо).
Важливе біологічне значення для функціонування організмів має і те, що вода під впливом розчинених у ній речовин може змінювати свої властивості, зокрема температуру замерзання і кипіння. Так, із настанням зими у клітинах морозостійких рослин і холоднокровних тварин підвищується концентрація розчинних вуглеводів та інших сполук (наприклад, гліцерину). Це перешкоджає переходу води в організмах у кристалічний стан і таким чином запобігає їхній загибелі.
На перебіг біохімічних реакцій у водних розчинах істотно впливає концентрація іонів гідрогену у воді, її оцінюють за водневим показником - рН (значення від'ємного десяткового логарифму концентрації іонів гідрогену).
Які ще неорганічні сполуки, крім води, е в організмах? Які їхні функції? Для підтримання процесів життєдіяльності окремих клітин і організму в цілому важливе значення мають солі неорганічних (мінеральних) сполук. У живих організмах вони розчинені в воді (у вигляді іонів) або перебувають у вигляді твердих сполук. Іони утворені катіонами металів (калію, натрію, кальцію, магнію тощо) і аніонами кислот (хлоридної - СІ", сульфатної -Н80~, 80^7 карбонатної - НСО~, фосфатної -Н9РОт, НРО ?- та ін.).
Різна концентрація К+ і Na+ поза клітинами та всередині них спричинює виникнення різниці електричних потенціалів на плазматичних мембранах клітини. Це забезпечує передачу нервових імпульсів, а також транспорт речовин через мембрани. Регуляторну функцію та активацію багатьох ферментів здійснюють Са2+ і Мg2+. Сполуки кальцію (СаСО.() входять до складу черепашок молюсків і найпростіших (радіолярій) внутрішньоклітинний скелет побудований з двооксиду силіцію (SіО2) або сульфатнокислого стронцію (SrSO4).
Важливі функції виконують також неорганічні кислоти. Так, хлоридна кислота створює кисле середовище в шлунку хребетних тварин і людини, забезпечуючи цим активність ферментів шлункового соку. Залишки сульфатної кислоти, приєднуючись до нерозчинних у воді сполук, забезпечують їхню розчинність. Це сприяє виведенню даних сполук з клітин і організму.
Загальний вміст неорганічних речовин у клітинах різних типів варіює в межах від одного до декількох відсотків.
КОНТРОЛЬНІ ЗАПИТАННЯ
1. Що вивчає наука біохімія?
2. У яких співвідношеннях перебувають у живих клітинах різні хімічні елементи?
3. Які властивості води як основи внутрішнього середовища організмів?
4. Які функції виконує вода в живих організмах?
5. У якому стані в клітині перебувають солі? Які їхні функції в живих організмах?
ПОМІРКУЙТЕ
Які особливості будови молекул води забезпечують її властивості?
Як фізико-хімічні властивості води забезпечують процеси життєдіяльності окремих клітин і всього організму?
М.Є.Кучеренко, Ю.Г.Вервес, П.Г.Балан, В.М.Войціцький, Біологія, 10 клас
Вислано читачами з інтернет-сайтів
 акселеративні методи на уроці акселеративні методи на уроці  національні особливості національні особливості
 виділити головне в уроці - опорний каркас виділити головне в уроці - опорний каркас  нічого собі уроки нічого собі уроки
 відеокліпи відеокліпи  нова система освіти нова система освіти
 вправи на пошук інформації вправи на пошук інформації  підручники основні допоміжні підручники основні допоміжні
 гумор, притчі, приколи, приказки, цитати гумор, притчі, приколи, приказки, цитати  презентація уроку презентація уроку
 додаткові доповнення додаткові доповнення  реферати реферати
 домашнє завдання домашнє завдання  речовки та вікторизми речовки та вікторизми
 задачі та вправи (рішення та відповіді) задачі та вправи (рішення та відповіді)  риторичні питання від учнів риторичні питання від учнів
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)  рівень складності звичайний І рівень складності звичайний І
 знайди інформацію сам знайди інформацію сам  рівень складності високий ІІ рівень складності високий ІІ
 ідеальні уроки ідеальні уроки  рівень складності олімпійський III рівень складності олімпійський III
 ілюстрації, графіки, таблиці ілюстрації, графіки, таблиці  самоперевірка самоперевірка
 інтерактивні технології інтерактивні технології  система оцінювання система оцінювання
 календарний план на рік календарний план на рік  скласти пазл з різних частин інформації скласти пазл з різних частин інформації
 кейси та практикуми кейси та практикуми  словник термінів словник термінів
 комікси комікси  статті статті
 коментарі та обговорення коментарі та обговорення  тематичні свята тематичні свята
 конспект уроку конспект уроку  тести тести
 методичні рекомендації методичні рекомендації  шпаргалка шпаргалка
 навчальні програми навчальні програми  що ще не відомо, не відкрито вченими що ще не відомо, не відкрито вченими
|












