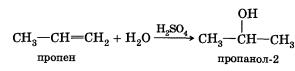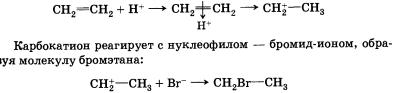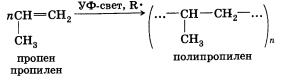|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Алкены<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Алкены</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 10 класс|Химия 10 класс]]>> Химия: Алкены<metakeywords>химия, 10 класс, класс, урок химии, на тему, урок на тему, урок для 10 класса, Алкены</metakeywords>''' |
| | | | |
| - | К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, [[Алкины|алкины]], алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалке-ны), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов:<br><br>''Строение''<br><br>Алкены — ациклические [[Природные_источники_углеводородов|углеводороды]], содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле С<sub>n</sub>Н<sub>2n</sub>.<br><br> | + | К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, [[Алкины|алкины]], алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалке-ны), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов. |
| | | | |
| - | Свое второе название — «олефины» — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло).<br><br>Атомы углерода, между которыми имеется двойная связь, как вы знаете, находятся в состоянии sp<sup>2</sup>-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию а-связи, а за счет негибридизованных -орбиталей соседних молекулы этилена атомов [[Углерод_(Химия_9_класс)|углерода]] образуется вторая, ''п''-связь. Таким образом, двойная связь состоит из одной Þ- и одной п-связи.<br><br>Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие л-связь, располагаются перпендикулярно плоскости молекулы (см. рис. 5).<br><br>Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой 7г-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.<br><br>Гомологический ряд этена<br><br>Неразветвленные алкены составляют гомологический ряд этена (этилена).<br><br>С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д.<br><br>''Изомерия и номенклатура''<br><br>Для алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры, как вы помните, отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные [[Изомерия_и_ее_виды|изомеры]], — это бутен.<br><br>СН3—СН2—СН=СН2 СН3—С=СН2<br> l<br> СН3<br>бутен-1 метилпропен<br><br>Особым видом структурной изомерии является изомерия положения двойной связи:<br><br>СН3—СН2—СН=СН2 СН3—СН=СН—СН3<br><sub> бутен-1 бутен-2</sub><br><br>Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или ''цис-транс-изомерии.''<br>[[Image:HimR10-1.jpg|Алкены]] | + | <h2>Строение</h2> |
| | + | |
| | + | Алкены — ациклические [[Природные_источники_углеводородов|углеводороды]], содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле С<sub>n</sub>Н<sub>2n</sub>.<br><br> |
| | + | |
| | + | Свое второе название — «олефины» — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло).<br><br>Атомы углерода, между которыми имеется двойная связь, как вы знаете, находятся в состоянии sp<sup>2</sup>-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию а-связи, а за счет негибридизованных -орбиталей соседних молекулы этилена атомов [[Углерод_(Химия_9_класс)|углерода]] образуется вторая, ''п''-связь. Таким образом, двойная связь состоит из одной Þ- и одной п-связи.<br><br>Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие л-связь, располагаются перпендикулярно плоскости молекулы (см. рис. 5).<br><br>Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой 7г-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения. |
| | + | |
| | + | <br><h4>Гомологический ряд этена</h4> |
| | + | |
| | + | Неразветвленные алкены составляют гомологический ряд этена (этилена).<br><br>С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д. |
| | + | |
| | + | <h2>Изомерия и номенклатура</h2> |
| | + | |
| | + | Для алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры, как вы помните, отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные [[Изомерия_и_ее_виды|изомеры]], — это бутен.<br><br>СН3—СН2—СН=СН2 СН3—С=СН2<br> l<br> СН3<br>бутен-1 метилпропен<br><br>Особым видом структурной изомерии является изомерия положения двойной связи:<br><br>СН3—СН2—СН=СН2 СН3—СН=СН—СН3<br><sub> бутен-1 бутен-2</sub><br><br>Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или ''цис-транс-изомерии.''<br>[[Image:HimR10-1.jpg|Алкены]] |
| | | | |
| | <br> | | <br> |
| Строка 11: |
Строка 23: |
| | <br>сн2=сн—сн2—сн2—сн2—сн3<br>гексен-1 циклогексан<br><br>Номенклатура [[Алкены|алкенов]], разработанная ИЮПАК, схожа с номенклатурой алканов.<br><br>1. Выбор главной цепи<br><br>Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.<br> | | <br>сн2=сн—сн2—сн2—сн2—сн3<br>гексен-1 циклогексан<br><br>Номенклатура [[Алкены|алкенов]], разработанная ИЮПАК, схожа с номенклатурой алканов.<br><br>1. Выбор главной цепи<br><br>Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.<br> |
| | | | |
| - | 2. Нумерация атомов главной цепи<br><br>Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения<br><br>сн3—сн—сн2—сн=сн—сн3 сн3<br><br>5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить.<br><br>Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.<br><br><br>CH3— CH2—CH=CH—СН—СН3<br> l<br> СН3<br>2-метилгексен-З<br><br>3. Формирование названия<br><br>Названия алкенов формируются так же, как и названия ал-канов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и [[Оценивание_к_уроку_«Тема_24._Правописание_суффикса_-ск-._Написание_нн,_н_в_суффиксах»|суффикс]], обозначающий принадлежность соединения к классу алкенов, -ен.<br>''<br>Получение''<br><br>1. Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алка-нов происходит образование алкенов.<br> | + | 2. Нумерация атомов главной цепи<br><br>Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения<br><br>сн3—сн—сн2—сн=сн—сн3 сн3<br><br>5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить.<br><br>Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.<br><br><br>CH3— CH2—CH=CH—СН—СН3<br> l<br> СН3<br>2-метилгексен-З<br><br>3. Формирование названия<br><br>Названия алкенов формируются так же, как и названия ал-канов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и [[Оценивание_к_уроку_«Тема_24._Правописание_суффикса_-ск-._Написание_нн,_н_в_суффиксах»|суффикс]], обозначающий принадлежность соединения к классу алкенов, -ен. |
| | | | |
| - | 2. Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:<br>[[Image:HimR10-2.jpg|Алкены]]
| + | <h2>Получение</h2> |
| | | | |
| - | <br> | + | 1. Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алка-нов происходит образование алкенов.<br> |
| | | | |
| - | 3. Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:<br>[[Image:HimR10-3.jpg|Алкены]]
| + | 2. Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:<br>[[Image:HimR10-2.jpg|Алкены]]<br> |
| | | | |
| - | <br> | + | 3. Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:<br>[[Image:HimR10-3.jpg|Алкены]]<br> |
| | | | |
| | Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров и будет изучена в § 16 «Спирты»).<br><br>4. Дегидрогалогенирование (отщепление галогеноводорода).<br><br>При взаимодействии галогеналкана со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода. | | Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров и будет изучена в § 16 «Спирты»).<br><br>4. Дегидрогалогенирование (отщепление галогеноводорода).<br><br>При взаимодействии галогеналкана со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода. |
| | | | |
| - | <br>Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует ''правилу Зайцева:''<br><br>При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода.<br><br>5. Дегалогенирование. При действии цинка на дибромпроиз-водное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:<br>[[Image:HimR10-4.jpg|Алкены]] | + | <br>Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует ''правилу Зайцева:''<br><br>При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода.<br><br>5. Дегалогенирование. При действии цинка на дибромпроиз-водное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:<br>[[Image:HimR10-4.jpg|Алкены]]<br> |
| | | | |
| - | <br> | + | <h2>Физические свойства</h2> |
| | | | |
| - | ''Физические свойства''<br><br>Первые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твердые вещества.<br><br>Температуры [[Кипение|кипения]] и плавления закономерно повышаются при увеличении молекулярной массы соединений.<br>''<br>Химические свойства''<br><br>Реакции присоединения<br><br>Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.<br><br>1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:<br><br>CH3—СН2—СН=СН2 + Н2 -> CH3—CH2—СН2—СН3<br><br>Эта реакция протекает и при атмосферном и при повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.<br><br>2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.<br>
| + | Первые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твердые вещества.<br><br>Температуры [[Кипение|кипения]] и плавления закономерно повышаются при увеличении молекулярной массы соединений. |
| | | | |
| - | Марковников Владимир Васильевич | + | <h2>Химические свойства</h2> |
| | + | |
| | + | Реакции присоединения<br><br>Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.<br><br>1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:<br><br>CH3—СН2—СН=СН2 + Н2 -> CH3—CH2—СН2—СН3<br><br>Эта реакция протекает и при атмосферном и при повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.<br><br>2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.<br> |
| | + | |
| | + | <br><h4>Марковников Владимир Васильевич </h4> |
| | | | |
| | (1837—1904)<br>[[Image:HimR10-5.jpg|марковников]] | | (1837—1904)<br>[[Image:HimR10-5.jpg|марковников]] |
| Строка 41: |
Строка 57: |
| | <br> | | <br> |
| | | | |
| - | Эта реакция присоединения протекает по свободноради-кальному механизму.<br><br>''Реакции окисления''<br><br>Как и любые органические соединения, алкены горят в кислороде с образованием С02 и Н20.<br><br>В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия. В нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных [[Спирты_(Химия_9_класс)|спиртов]]), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь.<br><br>Как вы уже знаете, непредельные углеводороды — алкены способны вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.<br><br>''Электрофильное присоединение''<br><br>Электрофильные реакции — это реакции, протекающие под действием электрофилов — частиц, имеющих недостаток электронной плотности, например незаполненную орбиталь. Простейшей электрофильной частицей является катион водорода. Известно, что атом водорода имеет один электрон на З-в-орбитали. Катион водорода образуется, когда атом теряет этот электрон, таким образом, у катиона водорода вообще отсутствуют электроны:<br><br>Н· - 1е<sup>-</sup> —> Н<sup>+</sup><br><br>При этом катион имеет достаточно высокое сродство к электрону. Сочетание этих факторов делает катион водорода достаточно сильной электрофильной частицей.<br><br>Образование катиона водорода возможно при электролитической диссоциации кислот:<br><br>НВr —> Н<sup>+</sup> + Вr<sup>-</sup><br><br>Именно по этой причине многие электрофильные реакции идут в присутствии и с участием кислот.<br><br>Электрофильные частицы, как уже говорилось раньше, действуют на системы, содержащие области повышенной электронной плотности. Примером такой системы может являться кратная (двойная или тройная) углерод-углеродная связь.<br><br>Вы уже знаете, что атомы углерода, между которыми образована двойная связь, находятся в состоянии sр<sup>2</sup>-гибридизации. Негибри-дизованные р-орбитали соседних атомов углерода, находящиеся в одной плоскости, перекрываются, образуя ''п''-связь, которая менее прочна, чем Þ-связь, и, что наиболее существенно, легко поляризуется под действием внешнего электрического поля. Это означает, что при приближении положительно заряженной частицы электроны тс-связи смещаются в ее сторону и образуется так называемый ''п-''комплекс.<br><br>Получается ''п''-комплекс и при присоединении катиона водорода к ''п''-связи. Катион водорода как бы натыкается на выступающую из плоскости молекулы электронную плотность ''п''-связи и присоединяется к ней.<br>[[Image:HimR10-8.jpg|Алкены]] | + | Эта реакция присоединения протекает по свободноради-кальному механизму. |
| | + | |
| | + | <h2>Реакции окисления</h2> |
| | + | |
| | + | Как и любые органические соединения, алкены горят в кислороде с образованием С02 и Н20.<br><br>В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия. В нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных [[Спирты_(Химия_9_класс)|спиртов]]), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь.<br><br>Как вы уже знаете, непредельные углеводороды — алкены способны вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения. |
| | + | |
| | + | <h2>Электрофильное присоединение</h2> |
| | + | |
| | + | Электрофильные реакции — это реакции, протекающие под действием электрофилов — частиц, имеющих недостаток электронной плотности, например незаполненную орбиталь. Простейшей электрофильной частицей является катион водорода. Известно, что атом водорода имеет один электрон на З-в-орбитали. Катион водорода образуется, когда атом теряет этот электрон, таким образом, у катиона водорода вообще отсутствуют электроны:<br><br>Н· - 1е<sup>-</sup> —> Н<sup>+</sup><br><br>При этом катион имеет достаточно высокое сродство к электрону. Сочетание этих факторов делает катион водорода достаточно сильной электрофильной частицей.<br><br>Образование катиона водорода возможно при электролитической диссоциации кислот:<br><br>НВr —> Н<sup>+</sup> + Вr<sup>-</sup><br><br>Именно по этой причине многие электрофильные реакции идут в присутствии и с участием кислот.<br><br>Электрофильные частицы, как уже говорилось раньше, действуют на системы, содержащие области повышенной электронной плотности. Примером такой системы может являться кратная (двойная или тройная) углерод-углеродная связь.<br><br>Вы уже знаете, что атомы углерода, между которыми образована двойная связь, находятся в состоянии sр<sup>2</sup>-гибридизации. Негибри-дизованные р-орбитали соседних атомов углерода, находящиеся в одной плоскости, перекрываются, образуя ''п''-связь, которая менее прочна, чем Þ-связь, и, что наиболее существенно, легко поляризуется под действием внешнего электрического поля. Это означает, что при приближении положительно заряженной частицы электроны тс-связи смещаются в ее сторону и образуется так называемый ''п-''комплекс.<br><br>Получается ''п''-комплекс и при присоединении катиона водорода к ''п''-связи. Катион водорода как бы натыкается на выступающую из плоскости молекулы электронную плотность ''п''-связи и присоединяется к ней.<br>[[Image:HimR10-8.jpg|Алкены]] |
| | | | |
| | <br> | | <br> |
| Строка 57: |
Строка 81: |
| | Преимущественное направление реакции будет зависеть от того, какого карбокатиона окажется больше в реакционной среде, что, в свою очередь, определяется устойчивостью карбокатиона. Эксперимент показывает преимущественное образование 2-бромпропа-на. Это означает, что в большей степени происходит образование карбокатиона (1) с положительным зарядом на центральном атоме.<br><br>Большая устойчивость этого карбокатиона объясняется тем, что положительный заряд на центральном атоме углерода компенсируется положительным индуктивным эффектом двух метильных групп, суммарный эффект которых выше, чем +/-эффект одной этильной группы:<br><br>Закономерности реакций гидрогалогенирования алкенов были изучены известным русским химиком В. В. Марковниковым, учеником А. М. [[Теория_строения_химических_соединений_А._М._Бутлерова|Бутлерова]], который, как это уже было сказано выше, сформулировал правило, носящее его имя.<br><br>Это правило было установлено эмпирически, т. е. опытным путем. В настоящее время мы можем привести вполне убедительное его объяснение.<br><br>Интересно, что правилу Марковникова подчиняются и другие реакции электрофильного присоединения, поэтому будет правильно сформулировать его в более общем виде.<br><br>В реакциях электрофильного присоединения электрофил (частица с незаполненной орбиталью) присоединяется к более гидрированному атому углерода, а нуклеофил (частица с неподеленной парой электронов) — к менее гидрированному.<br> | | Преимущественное направление реакции будет зависеть от того, какого карбокатиона окажется больше в реакционной среде, что, в свою очередь, определяется устойчивостью карбокатиона. Эксперимент показывает преимущественное образование 2-бромпропа-на. Это означает, что в большей степени происходит образование карбокатиона (1) с положительным зарядом на центральном атоме.<br><br>Большая устойчивость этого карбокатиона объясняется тем, что положительный заряд на центральном атоме углерода компенсируется положительным индуктивным эффектом двух метильных групп, суммарный эффект которых выше, чем +/-эффект одной этильной группы:<br><br>Закономерности реакций гидрогалогенирования алкенов были изучены известным русским химиком В. В. Марковниковым, учеником А. М. [[Теория_строения_химических_соединений_А._М._Бутлерова|Бутлерова]], который, как это уже было сказано выше, сформулировал правило, носящее его имя.<br><br>Это правило было установлено эмпирически, т. е. опытным путем. В настоящее время мы можем привести вполне убедительное его объяснение.<br><br>Интересно, что правилу Марковникова подчиняются и другие реакции электрофильного присоединения, поэтому будет правильно сформулировать его в более общем виде.<br><br>В реакциях электрофильного присоединения электрофил (частица с незаполненной орбиталью) присоединяется к более гидрированному атому углерода, а нуклеофил (частица с неподеленной парой электронов) — к менее гидрированному.<br> |
| | | | |
| - | Полимеризация<br><br>Особым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Эта реакция протекает по механизму свободнорадикального присоединения:<br>[[Image:HimR10-11.jpg|Алкены]]
| + | <br><h4>Полимеризация</h4> |
| | + | |
| | + | Особым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Эта реакция протекает по механизму свободнорадикального присоединения:<br>[[Image:HimR10-11.jpg|Алкены]] |
| | | | |
| | Полимеризацию проводят в присутствии инициаторов — пере-кисных соединений, которые являются источником свободных радикалов. Перекисными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим перекисным соединением является перекись водорода НООН.<br><br>При температуре 100 °С и давлении 100 МПа происходит гомо-лиз неустойчивой кислород-кислородной связи и образование радикалов — инициаторов полимеризации. Под действием радикалов КО- происходит инициирование полимеризации, которая развивается как реакция свободнорадикального присоединения. Рост цепи прекращается, когда в реакционной смеси происходит рекомбинация радикалов — полимерной цепи и радикалов или КОСН2СН2-.<br><br>При помощи реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, получают большое количество высокомолекулярных соединений:<br>[[Image:HimR10-12.jpg|Алкены]] | | Полимеризацию проводят в присутствии инициаторов — пере-кисных соединений, которые являются источником свободных радикалов. Перекисными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим перекисным соединением является перекись водорода НООН.<br><br>При температуре 100 °С и давлении 100 МПа происходит гомо-лиз неустойчивой кислород-кислородной связи и образование радикалов — инициаторов полимеризации. Под действием радикалов КО- происходит инициирование полимеризации, которая развивается как реакция свободнорадикального присоединения. Рост цепи прекращается, когда в реакционной смеси происходит рекомбинация радикалов — полимерной цепи и радикалов или КОСН2СН2-.<br><br>При помощи реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, получают большое количество высокомолекулярных соединений:<br>[[Image:HimR10-12.jpg|Алкены]] |
| Строка 69: |
Строка 95: |
| | Все эти полимерные соединения находят широкое применение в самых разных областях человеческой деятельности — промышленности, медицине, используются для изготовления оборудования биохимических лабораторий, некоторые являются полупродуктами для синтеза других высокомолекулярных соединений. | | Все эти полимерные соединения находят широкое применение в самых разных областях человеческой деятельности — промышленности, медицине, используются для изготовления оборудования биохимических лабораторий, некоторые являются полупродуктами для синтеза других высокомолекулярных соединений. |
| | | | |
| - | ''Окисление''
| + | <h2>Окисление </h2> |
| | | | |
| | Вы уже знаете, что в нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов). В кислой среде (подкисленный серной кислотой раствор) происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы:<br>[[Image:HimR10-14.jpg|Алкены]] | | Вы уже знаете, что в нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов). В кислой среде (подкисленный серной кислотой раствор) происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы:<br>[[Image:HimR10-14.jpg|Алкены]] |
| Строка 79: |
Строка 105: |
| | <br> | | <br> |
| | | | |
| - | ''Применение''<br><br>Алкены широко используются в химической промышленности как сырье для получения разнообразных органических веществ и материалов.<br><br>Так, например, этен является исходным веществом для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.<br><br>Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной пленки, посуды, труб, электроизоляционных материалов.<br><br>Из пропена получают глицерин, ацетон, изопропанол, растворители. Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.<br><br>В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена прочнее всех известных синтетических волокон.<br><br>Материалы, изготовленные из этих волокон, являются перспективными и находят все большее применение в разных областях человеческой деятельности.<br><br>[[Image:HimR10-15.jpg|Алкены]]
| + | <h2>Применение</h2> |
| | | | |
| - | <br>
| + | Алкены широко используются в химической промышленности как сырье для получения разнообразных органических веществ и материалов.<br><br>Так, например, этен является исходным веществом для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.<br><br>Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной пленки, посуды, труб, электроизоляционных материалов.<br><br>Из пропена получают глицерин, ацетон, изопропанол, растворители. Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.<br><br>В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена прочнее всех известных синтетических волокон.<br><br>Материалы, изготовленные из этих волокон, являются перспективными и находят все большее применение в разных областях человеческой деятельности.<br><br>[[Image:HimR10-15.jpg|Алкены]] |
| - | | + | |
| - | 1. Какие виды изомерии характерны для алкенов? Напишите формулы возможных изомеров пентена-1.<br><br>2. Из каких соединений может быть получен: а) изобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишите уравнения соответствующих реакций.<br><br>3. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б, В.<br><br>[[Алкены]]<br><br>4. Предложите способ получения 2-хлорпропана из 1-хлор-пропана. Напишите уравнения соответствующих реакций.<br>
| + | |
| - | | + | |
| - | 5. Предложите способ очистки этана от примесей этилена. Напишите уравнения соответствующих реакций.<br><br>6. Приведите примеры реакций, с помощью которых можно различить предельные и непредельные углеводороды.<br><br>7. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н. у.). Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов?<br><br>8. Какой газ находится в цилиндре (этен или пропен), если известно, что на полное сгорание 20 см3 этого газа потребовалось 90 см3 (н. у.) кислорода?<br><br>9*. При реакции алкена с хлором в темноте образуется 25,4 г дихлорида, а при реакции этого алкена той же массы с бромом в тетрахлорметане — 43,2 г дибромида. Установите все возможные структурные формулы исходного алкена.
| + | |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <sub>конспекты уроков [[Гипермаркет знаний - первый в мире!|для всех классов]], задачи и упражнения [[Химия|по химии]], аудио и видео к [[Химия 10 класс|уроку химии]]</sub>
| + | 1. Какие виды изомерии характерны для алкенов? Напишите формулы возможных изомеров пентена-1.<br> |
| - | | + | 2. Из каких соединений может быть получен: а) изобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишите уравнения соответствующих реакций.<br> |
| - | '''<u>Содержание урока</u>'''
| + | 3. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б, В. |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока '''
| + | 4. Предложите способ получения 2-хлорпропана из 1-хлор-пропана. Напишите уравнения соответствующих реакций.<br> |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас
| + | 5. Предложите способ очистки этана от примесей этилена. Напишите уравнения соответствующих реакций.<br> |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока
| + | 6. Приведите примеры реакций, с помощью которых можно различить предельные и непредельные углеводороды.<br> |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы
| + | 7. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н. у.). Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов?<br> |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии
| + | 8. Какой газ находится в цилиндре (этен или пропен), если известно, что на полное сгорание 20 см3 этого газа потребовалось 90 см3 (н. у.) кислорода?<br> |
| - |
| + | 9*. При реакции алкена с хлором в темноте образуется 25,4 г дихлорида, а при реакции этого алкена той же массы с бромом в тетрахлорметане — 43,2 г дибромида. Установите все возможные структурные формулы исходного алкена. |
| - | '''<u>Практика</u>'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников
| + | |
| - |
| + | |
| - | '''<u>Иллюстрации</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты
| + | |
| - |
| + | |
| - | '''<u>Дополнения</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие
| + | |
| - | '''<u></u>'''
| + | |
| - | <u>Совершенствование учебников и уроков
| + | |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике'''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми
| + | |
| - |
| + | |
| - | '''<u>Только для учителей</u>'''
| + | |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки '''
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы
| + | |
| - | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения
| + | |
| - |
| + | |
| - |
| + | |
| - | '''<u>Интегрированные уроки</u>'''<u>
| + | |
| - | </u>
| + | |
| - | | + | |
| - | <br> | + | |
| - | | + | |
| - | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам].
| + | |
| - | | + | |
| - | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].
| + | |
Версия 17:31, 22 июня 2015
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалке-ны), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Строение
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n.
Свое второе название — «олефины» — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от англ. oil — масло).
Атомы углерода, между которыми имеется двойная связь, как вы знаете, находятся в состоянии sp2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию а-связи, а за счет негибридизованных -орбиталей соседних молекулы этилена атомов углерода образуется вторая, п-связь. Таким образом, двойная связь состоит из одной Þ- и одной п-связи.
Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие л-связь, располагаются перпендикулярно плоскости молекулы (см. рис. 5).
Двойная связь (0,132 нм) короче одинарной, а ее энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой 7г-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена).
С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры, как вы помните, отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен.
СН3—СН2—СН=СН2 СН3—С=СН2
l
СН3
бутен-1 метилпропен
Особым видом структурной изомерии является изомерия положения двойной связи:
СН3—СН2—СН=СН2 СН3—СН=СН—СН3
бутен-1 бутен-2
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс-изомерии.

Цис-изомеры отличаются от торакс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости п-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:
сн2=сн—сн2—сн2—сн2—сн3
гексен-1 циклогексан
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения
сн3—сн—сн2—сн=сн—сн3 сн3
5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить.
Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
CH3— CH2—CH=CH—СН—СН3
l
СН3
2-метилгексен-З
3. Формирование названия
Названия алкенов формируются так же, как и названия ал-канов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, -ен.
Получение
1. Крекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алка-нов происходит образование алкенов.
2. Дегидрирование предельных углеводородов. При пропускании алканов над катализатором при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
3. Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (Н2804, Аl203) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
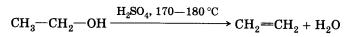
Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров и будет изучена в § 16 «Спирты»).
4. Дегидрогалогенирование (отщепление галогеноводорода).
При взаимодействии галогеналкана со щелочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода.
Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева:
При отщеплении галогеноводорода от вторичных и третичных галогеналканов атом водорода отщепляется от наименее гидрированного атома углерода.
5. Дегалогенирование. При действии цинка на дибромпроиз-водное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:
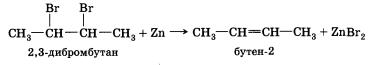
Физические свойства
Первые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства
Реакции присоединения
Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
CH3—СН2—СН=СН2 + Н2 -> CH3—CH2—СН2—СН3
Эта реакция протекает и при атмосферном и при повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
Марковников Владимир Васильевич
(1837—1904)

Русский химик-органик. Сформулировал (1869) правила о направлении реакций замещения, отщепления, присоединения по двойной связи и изомеризации в зависимости от химического строения. Исследовал (с 1880 г.) состав нефти, заложил основы нефтехимии как самостоятельной науки. Открыл (1883) новый класс органических веществ — цикло-парафины (нафтены).
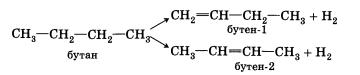
3. Гидрогалогенирование (присоединение галогеноводорода).
Реакция присоединения галогеноводорода более подробно будет рассмотрена ниже. Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
CH2=CH2 + H2O -> СН3—СН2ОН
этен этанол
Обратите внимание на то, что первичный спирт (с гидроксигруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
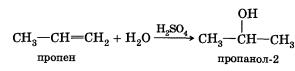
Эта реакция также протекает в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксигруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
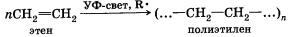
Эта реакция присоединения протекает по свободноради-кальному механизму.
Реакции окисления
Как и любые органические соединения, алкены горят в кислороде с образованием С02 и Н20.
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия. В нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь.
Как вы уже знаете, непредельные углеводороды — алкены способны вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
Электрофильное присоединение
Электрофильные реакции — это реакции, протекающие под действием электрофилов — частиц, имеющих недостаток электронной плотности, например незаполненную орбиталь. Простейшей электрофильной частицей является катион водорода. Известно, что атом водорода имеет один электрон на З-в-орбитали. Катион водорода образуется, когда атом теряет этот электрон, таким образом, у катиона водорода вообще отсутствуют электроны:
Н· - 1е- —> Н+
При этом катион имеет достаточно высокое сродство к электрону. Сочетание этих факторов делает катион водорода достаточно сильной электрофильной частицей.
Образование катиона водорода возможно при электролитической диссоциации кислот:
НВr —> Н+ + Вr-
Именно по этой причине многие электрофильные реакции идут в присутствии и с участием кислот.
Электрофильные частицы, как уже говорилось раньше, действуют на системы, содержащие области повышенной электронной плотности. Примером такой системы может являться кратная (двойная или тройная) углерод-углеродная связь.
Вы уже знаете, что атомы углерода, между которыми образована двойная связь, находятся в состоянии sр2-гибридизации. Негибри-дизованные р-орбитали соседних атомов углерода, находящиеся в одной плоскости, перекрываются, образуя п-связь, которая менее прочна, чем Þ-связь, и, что наиболее существенно, легко поляризуется под действием внешнего электрического поля. Это означает, что при приближении положительно заряженной частицы электроны тс-связи смещаются в ее сторону и образуется так называемый п-комплекс.
Получается п-комплекс и при присоединении катиона водорода к п-связи. Катион водорода как бы натыкается на выступающую из плоскости молекулы электронную плотность п-связи и присоединяется к ней.
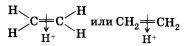
На следующей стадии происходит полное смещение электронной пары п-связи к одному из атомов углерода, что приводит к появлению на нем неподеленной пары электронов. Орбиталь атома углерода, на которой находится эта пара, и незаполненная орбиталь катиона водорода перекрываются, что приводит к образованию ковалентной связи по донорно-акцепторному механизму. У второго атома углерода при этом остается незаполненная орбиталь, т. е. положительный заряд.
Образовавшаяся частица называется карбокатионом, так как она содержит положительный заряд на атоме углерода. Эта частица может соединиться с каким-либо анионом, частицей, имеющей неподеленную электронную пару, т. е. нуклеофилом.
Рассмотрим механизм реакции электрофильного присоединения на примере гидробромирования (присоединения бромоводорода) этена:
СН2= СН2 + НВг —-> СНВr—СН3
Реакция начинается с образования электрофильной частицы — катиона водорода, которое происходит в результате диссоциации молекулы бромоводорода.
Катион водорода атакует п-связь, образуя п-комплекс, который быстро преобразуется в карбокатион:
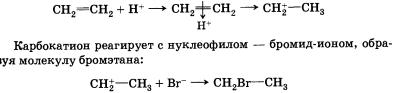
Теперь рассмотрим более сложный случай.
Реакция присоединения бромоводорода к этену протекает однозначно, а взаимодействие бромоводорода с пропеном теоретически может дать два продукта: 1-бромпропан и 2-бромпропан. Данные эксперимента показывают, что в основном получается 2-бромпропан.
Для того чтобы объяснить это, нам придется рассмотреть промежуточную частицу — карбокатион.
Присоединение катиона водорода к пропену может привести к образованию двух карбокатионов: если катион водорода присоединится к первому атому углерода, к атому, который находится на конце цепи, то положительный заряд окажется у второго, т. е. в центре молекулы (1); если присоединится ко второму, то положительный заряд окажется у первого атома (2).
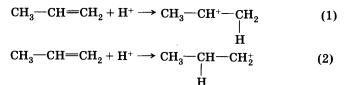
Преимущественное направление реакции будет зависеть от того, какого карбокатиона окажется больше в реакционной среде, что, в свою очередь, определяется устойчивостью карбокатиона. Эксперимент показывает преимущественное образование 2-бромпропа-на. Это означает, что в большей степени происходит образование карбокатиона (1) с положительным зарядом на центральном атоме.
Большая устойчивость этого карбокатиона объясняется тем, что положительный заряд на центральном атоме углерода компенсируется положительным индуктивным эффектом двух метильных групп, суммарный эффект которых выше, чем +/-эффект одной этильной группы:
Закономерности реакций гидрогалогенирования алкенов были изучены известным русским химиком В. В. Марковниковым, учеником А. М. Бутлерова, который, как это уже было сказано выше, сформулировал правило, носящее его имя.
Это правило было установлено эмпирически, т. е. опытным путем. В настоящее время мы можем привести вполне убедительное его объяснение.
Интересно, что правилу Марковникова подчиняются и другие реакции электрофильного присоединения, поэтому будет правильно сформулировать его в более общем виде.
В реакциях электрофильного присоединения электрофил (частица с незаполненной орбиталью) присоединяется к более гидрированному атому углерода, а нуклеофил (частица с неподеленной парой электронов) — к менее гидрированному.
Полимеризация
Особым случаем реакции присоединения является реакция полимеризации алкенов и их производных. Эта реакция протекает по механизму свободнорадикального присоединения:
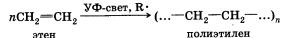
Полимеризацию проводят в присутствии инициаторов — пере-кисных соединений, которые являются источником свободных радикалов. Перекисными соединениями называют вещества, молекулы которых включают группу —О—О—. Простейшим перекисным соединением является перекись водорода НООН.
При температуре 100 °С и давлении 100 МПа происходит гомо-лиз неустойчивой кислород-кислородной связи и образование радикалов — инициаторов полимеризации. Под действием радикалов КО- происходит инициирование полимеризации, которая развивается как реакция свободнорадикального присоединения. Рост цепи прекращается, когда в реакционной смеси происходит рекомбинация радикалов — полимерной цепи и радикалов или КОСН2СН2-.
При помощи реакции свободнорадикальной полимеризации веществ, содержащих двойную связь, получают большое количество высокомолекулярных соединений:
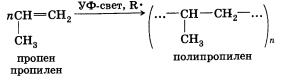
Применение алкенов с различными заместителями дает возможность синтезировать богатый ассортимент полимерных материалов с широким набором свойств.
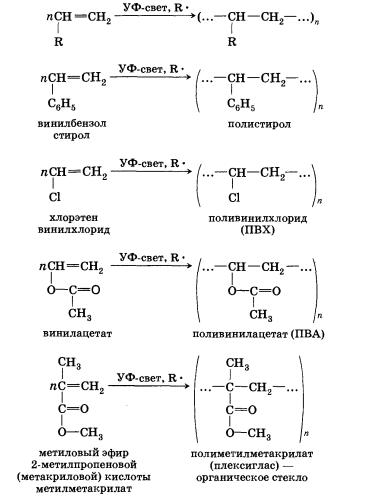
Все эти полимерные соединения находят широкое применение в самых разных областях человеческой деятельности — промышленности, медицине, используются для изготовления оборудования биохимических лабораторий, некоторые являются полупродуктами для синтеза других высокомолекулярных соединений.
Окисление
Вы уже знаете, что в нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов). В кислой среде (подкисленный серной кислотой раствор) происходит полное разрушение двойной связи и превращение атомов углерода, между которыми существовала двойная связь, в атомы углерода карбоксильной группы:

Деструктивное окисление алкенов можно применять для определения их структуры. Так, например, если при окислении некоторого алкена получены уксусная и пропионовая кислоты, это означает, что окислению подвергся пентен-2, а если получены масляная (бутановая) кислота и углекислый газ, то исходный углеводород — пентен-1.
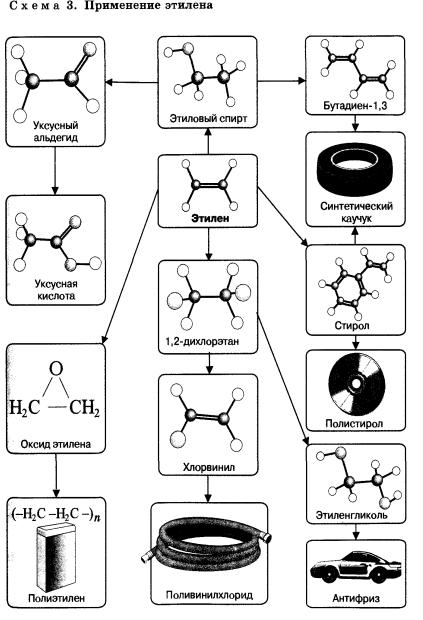
Применение
Алкены широко используются в химической промышленности как сырье для получения разнообразных органических веществ и материалов.
Так, например, этен является исходным веществом для производства этанола, этиленгликоля, эпоксидов, дихлорэтана.
Большое количество этена перерабатывается в полиэтилен, который используется для изготовления упаковочной пленки, посуды, труб, электроизоляционных материалов.
Из пропена получают глицерин, ацетон, изопропанол, растворители. Полимеризацией пропена получают полипропилен, который по многим показателям превосходит полиэтилен: имеет более высокую температуру плавления, химическую устойчивость.
В настоящее время из полимеров — аналогов полиэтилена производят волокна, обладающие уникальными свойствами. Так, например, волокно из полипропилена прочнее всех известных синтетических волокон.
Материалы, изготовленные из этих волокон, являются перспективными и находят все большее применение в разных областях человеческой деятельности.
1. Какие виды изомерии характерны для алкенов? Напишите формулы возможных изомеров пентена-1.
2. Из каких соединений может быть получен: а) изобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишите уравнения соответствующих реакций.
3. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б, В.
4. Предложите способ получения 2-хлорпропана из 1-хлор-пропана. Напишите уравнения соответствующих реакций.
5. Предложите способ очистки этана от примесей этилена. Напишите уравнения соответствующих реакций.
6. Приведите примеры реакций, с помощью которых можно различить предельные и непредельные углеводороды.
7. На полное гидрирование 2,8 г алкена израсходовано 0,896 л водорода (н. у.). Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов?
8. Какой газ находится в цилиндре (этен или пропен), если известно, что на полное сгорание 20 см3 этого газа потребовалось 90 см3 (н. у.) кислорода?
9*. При реакции алкена с хлором в темноте образуется 25,4 г дихлорида, а при реакции этого алкена той же массы с бромом в тетрахлорметане — 43,2 г дибромида. Установите все возможные структурные формулы исходного алкена.
|