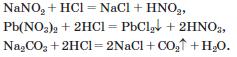|
|
|
| (13 промежуточных версий не показаны.) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Хімія: Взаємодія амоніаку та хлороводню з водою. Солі амонію. Якісна реакція на йони амонію та хлорид-іони''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Взаємодія амоніаку та хлороводню з водою. Солі амонію. Якісна реакція на йони амонію та хлорид-іони'''<br> <metakeywords>Хімія, клас, урок, на тему, 10 клас, Взаємодія амоніаку та хлороводню з водою, Солі амонію, Якісна реакція на йони амонію та хлорид-іони.</metakeywords><br> '''1. Взаємодія з '''[[Вода. Акселеративні методи|'''водою''']]''.'' [[Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню|Аміак]] добре розчиняється у воді утворюючи ''аміачну воду'' (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH<sub>3</sub>). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Якщо суху колбу, заповнену аміаком і закриту пробкою із вставленою трубкою з відтягнутим кінцем, занурити у воду, до якої додано кілька крапель розчину фенолфталеїну, то з безбарвної рідини починає бити малиновий «фонтан». Забарвлення аміачної води свідчить про те, що водний розчин аміаку має лужну реакцію. |
| | | | |
| - | <br> <metakeywords>Хімія, клас, урок, на тему, 10 клас, Взаємодія амоніаку та хлороводню з водою, Солі амонію, Якісна реакція на йони амонію та хлорид-іони.</metakeywords>ВЗАЄМОДІЯ АМОНІАКУ ТА ХЛОРОВОДНЮ З ВОДОЮ. СОЛІ АМОНІЮ. ЯКІСНА РЕАКЦІЯ НА ЙОНИ АМОНІЮ ТА ХЛОРИД-ІОНИ
| + | ''Як це можна пояснити?'' |
| | | | |
| - | <br> <u>Будова молекули.</u> | + | У воді концентрації йонів Гідрогену Н<sup>+</sup> і гідроксид-іонів ОН<sup>-</sup> — однакові: |
| | | | |
| - | Молекула аміаку NH<sub>3</sub> являє собою ''диполь'': спільні електронні пари дуже зміщені до атома Нітрогену (чому?):
| + | H2O ⇔ H<sup>+</sup> + OH<sup>-</sup> ,<br> |
| | | | |
| - | <sub> ''' .. '''</sub> ..
| + | тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH<sub>3</sub> у воді концентрація гідроксид-іонів ОН<sup>- </sup>збільшується, отже, утворюється лужне середовище, і фенолфталеїн стає малиновим. |
| | | | |
| - | NH<sub>3</sub>, H :N: H N | + | Виникнення [[Лужні, лужноземельні елементи та Магній. Фізичні та хімічні властивості простих речовин, основний характер їх оксидів та гідроксидів.|лужного середовища]] пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NH<sup>+</sup><sub>4</sub>. |
| | | | |
| - | <sup> </sup>'''<sup> ..</sup> ''' / ↑ \<br> N H H H | + | NH<sub>3</sub> + H<sup>+</sup> → NH<sub>4</sub> |
| | | | |
| - | <br>• Зазначте електронні формули атомів Нітрогену і Гідрогену, покажіть графічно розміщення електронів по орбіталях і поясніть, якими електронами утворюється ковалентний зв'язок у молекулі аміаку і чому він полярний. Яка валентність і ступінь окиснення Нітрогену в аміаку? | + | <sub></sub><br> |
| | | | |
| - | <u>Фізичні властивості.</u> | + | При цьому вивільнюються з води гідроксид-іони ОН<sup>-</sup> , що й надає розчину лужної реакції. |
| | | | |
| - | Аміак NH<sub>3</sub> — безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (при 20<sup>0</sup>С в 1 об'ємі води — 700 об'ємів NH<sub>3</sub>), при температурі, нижчій за — 33,4 °С переходить у рідкий стан. Дуже уражує слизові оболонки очей і дихальних шляхів.
| + | Кожний йон амонію NH<sup>+</sup><sub>4</sub> має чотири ковалентні зв'язки. Три з них юються за рахунок трьох неспарених електронів, які є на ''р''-орбіталях зовнішнього електронного шару атома Нітрогену. Четвертий зв'язок утворюється за донорно-акцепторним механізмом між атомом Нітрогену аміаку (донор) та йоном гідрогену (акцептор): |
| | | | |
| - | <u>Хімічні властивості.</u> | + | Н Н +<br> |
| | | | |
| - | Для аміаку характерні реакції окиснення і приєднання.
| + | l І |
| | | | |
| - | ''1.Окиснення аміаку.'' Аміак, маючи низький ступінь окиснення Нітрогену -3, поводить себе як відновник. Відновні властивості аміаку виявляються під час горіння його в кисні (мал. 5).<br>
| + | Н — N: + Н<sup>+</sup> → Н — N — Н |
| | | | |
| - | Мал. 5. Горіння аміаку
| + | І І<br> Н Н |
| | | | |
| - | [[Image:3-3..jpg]]<br> <br>4NH<sub>3</sub> + 30<sub>2</sub> ⇔ 2N<sub>2</sub> + 6H<sub>2</sub>0
| + | <br>Усі чотири зв'язки нітроген-гідроген N — Н в йоні амонію рівноцінні, незважаючи на різні механізми їхнього утворення. |
| | | | |
| - | За наявності каталізатора (Pt) реакція окиснення аміаку змінюється: замість вільного азоту утворюється оксид нітрогену (ІІ) N0:
| + | Взаємодія аміаку з водою відбувається за рівнянням: |
| | | | |
| - | 4NH<sub>3</sub> + 50<sub>2 </sub>= 4N0↑ + 6Н<sub>2</sub>0
| + | NH<sub>3 </sub>+ Н<sub>2</sub>0 ⇔ NH<sub>3</sub> • Н<sub>2</sub>0⇔ NH<sup>+</sup><sub>4</sub> + ОН<sup>-</sup> |
| | | | |
| - | • Складіть для наведених рівнянь електронний баланс, обґрунтуйте розстановку коефіцієнтів і доведіть, що аміак в обох випадках — відновник.
| + | <sup></sup><br> |
| | | | |
| - | ''2. Взаємодія з водою.'' Аміак добре розчиняється у воді утворюючи ''аміачну воду'' (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH<sub>3</sub>). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Якщо суху колбу, заповнену аміаком і закриту пробкою із вставленою трубкою з відтягнутим кінцем, занурити у воду, до якої додано кілька крапель розчину фенолфталеїну, то з безбарвної рідини починає бити малиновий «фонтан» (мал. 6).
| + | Але в розчині лише невелика частина молекул NH<sub>3</sub> перетворюється на йони амонію NH<sup>+</sup><sub>4</sub>. Тому аміачна вода пахне аміаком. |
| | | | |
| - | Мал. 6. Розчинення аміаку у воді<br>
| + | Аміачну воду позначають формулою NH<sub>3</sub> • Н<sub>2</sub>0 і називають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ: |
| | | | |
| | + | NH<sub>3</sub> • Н<sub>2</sub>0 ⇔ NH<sup>+</sup><sub>4</sub> + ОН<sup>-</sup><br> |
| | | | |
| | + | NH<sub>3</sub> • Н<sub>2</sub>0⇔ NH<sub>3</sub>↑ + Н<sub>2</sub>0<br> |
| | | | |
| - | Забарвлення аміачної води свідчить про те, що водний розчин аміаку має лужну реакцію.
| + | '''<br>''' |
| | | | |
| - | Як це можна пояснити? У воді концентрації йонів Гідрогену Н<sup>+</sup> і гідроксид-іонів ОН<sup>-</sup> — однакові:
| + | '''2. Взаємодія з '''[[13. Кислоти, їх склад, назви|'''кислотами''']]''.'' Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу — концентрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим — дрібні кристалики хлориду амонію (нашатирю): |
| | | | |
| - | H2O ⇔ H<sup>+</sup> + OH<sup>-</sup> ,
| + | NH<sub>3</sub> + НСl = NH<sub>4</sub>Cl |
| | | | |
| - | тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH3 у воді концентрація гідроксид-іонів ОН- збільшується, отже, утворюється лужне середови¬ще, і фенолфталеїн стає малиновим.<br>Виникнення лужного середовища пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NHJ.<br>NH3 + H+ -* NHJ<br>цьому вивільнюються з води гідроксид-іони ОН , -надає розчину лужної реакції.<br>ясний йон амонію NH^ має чотири ковалентні зв'язки. Три з них<br>юються за рахунок трьох неспарених електронів, які є на р-орбіталях<br>У1*0?щдього електронного шару атома Нітрогену. Четвертий зв'язок утво-<br>з°ВІ1 я за донорно-акцепторним механізмом між атомом Нітрогену аміа-<br>рІ°Є(донор) та йоном гідрогену (акцептор):<br>Н<br>н —N: + н4" -►<br>н<br>н<br>н—N —н<br>н<br>Усі чотири зв'язки нітроген-гідроген N — Н в йоні амонію рівноцін¬ні незважаючи на різні механізми їхнього утворення.<br>Взаємодія аміаку з водою відбувається за рівнянням:<br>NH3 + Н20<br>NH3 ■ Н20 ї> NH^ + ОН-<br>Але в розчині лише невелика частина молекул NH3 пе¬ретворюється на йони амонію NH4. Тому аміачна вода пах¬не аміаком.<br>Аміачну воду позначають формулою NH3 • Н20 і нази¬вають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ:<br>NH3 • Н20 ^ NHJ + ОН"<br>NH,<br>н2о<br>NH31 + Н20<br>3. Взаємодія з кислотами. Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу—кон¬центрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим —дрібні кристалики хлори-ДУ амонію (нашатирю):<br>Отже, амонію.<br>V NH3 + НС1 = NH4C1 аміак, взаємодіючи з кислотами, утворює солі<br><br>• Напишіть рівняння реакцій між аміаком і: а) нітратноці 6) сульфатною кислотами. Які солі амонію при цьому утвЗ рюються?<br>Що спільного і відмінного між речовинами, назви яких «нащі тир» і «нашатирний спирт»?<br>Добування. У лабораторії аміак добувають із суміші твея дих речовин —нашатирю NH4C1 і гашеного вапна Са(ОШ (мал. 7) за рівнянням:<br>2NH4C1 + Са(ОН)2 = CaCl2+2NH31 + 2Н20 .<br>• Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном?<br>Застосування. Аміак — важливий продукт хімічної промисловості. Його вико¬ристовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речо¬вин, соди. Як холодоагент аміак застосовують у холо¬дильниках.<br>У вигляді аміачної води 1 він використовується у ме« дицині під назвою «наша¬тирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і І нервової системи, тому нашатирний спирт дають нюхати J при знепритомленні та отруєннях, наприклад чадним газом І CO. Як слабкий луг аміачну воду широко застосовують УІ хімічних лабораторіях, а також у побуті: піц час прання бі- і лизни, для виведення плям, чищення килимів і ювелірних ! виробів.<br>Са(ОН)2<br><br>рії<br>Добування аміаку в лаборато-<br>Завдання для самоконтролю<br>69. Які фізичні властивості аміаку? Як його добувають у лабо' раторних умовах? Напишіть відповідне рівняння реакції.<br>70. Чи можна зібрати аміак способом: а) витіснення повітря? б) витіснення води? Чому?<br>50<br>її Зазначте електронні конфігурації атомів Нітрогену і Гідро-<br>ха поясніть, якими електронами утворюються ковалентні<br>гей' В М0Лекулі аміаку і чому вона полярна. Яка валентність і<br>3^Й ступінь окиснення Нітрогену в аміаку?<br>* 72. Які реакції аміаку з іншими речовинами ведуть до утворен-<br>ив йонів амоніїо?<br>73. В якому напрямі (на. підставі принципу Ле Шательє)<br>шститься рівновага реакції аміаку з водою під час: а) нагршання; <\ охолодження; в) додавання кислоти; г) додавання лугу?<br>' 74. На каталітичне окиснення аміаку кількістю речовини 2 моль витрачається кисень об'ємом (н. у.)<br>(а) 11,2 л; (в) 28 л;<br>(б) 22,4 л; (г) 56 л.<br>75. Під час взаємодії хлориду амонію з гашеним вапном масою 370 кг виділяється аміак об'ємом (н. у.)<br>(а) 11,2 м3: (в) 224 м3;<br>(б) 22,4 м3; (г) 448 м3.<br>76*. Прокип'ятили 200 г розчину з масовою часткою аміаку в ньому 25 %. При цьому 20 г аміаку звітрилося. Якою стала масова частка аміаку в розчині? Яка маса хлороводню потрібна для його нейтралізації?<br>§ 12. СОЛІ АМОНІЮ<br>Солі амонію — це кристалічні речовини з йонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.<br>• Напишіть формули трьох солей амонію і зазначте назву кожної з них.<br>Фізичні властивості. Солі амонію —тверді кристалічні Речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.<br>Хімічні властивості. Солі амонію виявляють типові для С]х солей властивості і деякі специфічні.<br>*• Дисоціація на йони. Як сильні електроліти солі амонію ВоДНому розчині добре дисоціюють на йони:<br>(NH4)2S04 £ 2NH+ + SO^-<br>*• Взаємодія з іншими солями. Якщо в пробірку з розчи-в м бориду амонію долити розчин нітрату аргентуму, то ЗДає сирнистий (схожий на зсіле молоко) білий осад:<br>NH4CJ + AgN03 == NH4N03+AgCl І Щ<br>• Ви переконалися, що солі амонію вступають у реакцію йондв обміну з іншими солями. Напишіть наведене рівняння у повіЛ і скороченій йонних формах. Пригадайте, яких умов тре? додержувати, щоб реакція обміну між двома солями відбуд-З до кінця, тобто практично була б необоротною. Чи витрима* такі умови у даному разі?<br>3. Взаємодія з лугами. В результаті взаємодії солей амо. нію з лугами утворюється аміак, через що дану реакцій використовують як якісну на солі амоніїо:<br>NH4C1 + NaOH = NaCl + NH31 + H20<br>Виділення аміаку NH3 —характерна ознака для розпіз-j навання солей амонію.<br>Лабораторна робота З Виявлення йонів амонію в розчині<br>Налийте в пробірку 2 мл розчину сульфату амонію і добав¬те до нього стільки ж розчину гідроксиду натрію. Нагрійте рідину в пробірці до кипіння й обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки червоний лакмусо¬вий папірець, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції.<br>Отже, якісною реакцією на солі амоніїо є діїї лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посшгінням червоного вологого лакмусового папірця.<br>• Доведіть за допомогою йонного рівняння, що гідроксид-іони ОН- є реактивом на йони амонію NH4.<br>4. Розклад під час нагрівання:<br>NH4C1<br>нагрівання '<br>Z NH3 + HC1<br>охолодження NH4N03 -> N20 + 2H,0<br><br>тт бування. Солі амоніїо добувають внаслщок взаємодії /iv або аміачної води (NH3 • Н20) з кислотами:<br>NH3 + HN03 « NH4N03<br>Лабораторна робота 4 Утворення солей амонію<br>до отвору пробірки з концентрованим розчином аміаку під-еСіть скляну паличку, змочену концентрованою хлоридною<br>кислотою.<br>Як пояснити утворення диму? Дослід повторіть, узявши за¬мість хлоридної концентровану нітратну кислоту. Напишіть рівняння проведених реакцій.<br>Застосування. Нітрат амонію NH4N03 і сульфат амонію (NH4)2S04 використовують головним чином як добрива. Нітрат амонію NH4N03 (в суміші з алюмшієм і вугіллям) застосовують для виготовлення вибухової речовини —амо¬налу. Хлорид амонію NH4C1 пщ назвою «нашатир» вико¬ристовують у процесі паяння для очищення поверхні паяль¬ника.<br>Коли нагрітий паяльник занурюють у нашатир NH4Q, то сіль розкла¬дається (див. вище). Утворений хлороводень НС1 взаємодіє з оксидом ку-пруму(П) CuO, що вкриває поверхню паяльника, внаслідок чого з'явля¬ється хлорид купруму(И) СиС12, який сплавляється з надлишком нашати¬рю NH4C1. В результаті поверхня паяльника звільняється від оксидів, і розплавлене олово прилипає до очищеної міді.<br>Завдання для самоконтролю<br>77. Які солі називають солями амонію? Напишіть рівняння Реакцій, що для них характерні. Зазначте специфічні властивості.<br>78. Напишіть рівняння взаємодії аміаку з сульфатною кисло-Тою' Зважте на те, що можуть утворитися як середня, так і кисла сОДі амонію. Поясніть, від чого це залежить.<br>79. Карбонат амонію (NH4)2C03 застосовують у кондитерській Праві як розпушувач тіста. На якій властивості солі грунтується ^е її застосування? Відповідь проілюструйте рівнянням реакції.<br>,™- Напишіть рівняння реакцій, за допомогою яких можна Діиснити такі перетворення:<br>N2 -* NH3 -> (NH4)3P04 -» NH3 -» NO -> N02<br>^ іиоюш JJ Г ПОДІЯЛИ РОЗЧИНОМ Лугу. ]-»І<br>цьому виділився аміак об'ємом (н. у.)<br>(а) 11,2 л; (в) 33,6 л; І<br>(б) 22,4 л; (г) 44,8 л. І 82. На 6,8 г аміаку подіяли хлороводнем. Добутий хлорид ад,<br>нію розчинили у 200 г води. Масова частка NH4C1 у добу^^'<br>розчині становить .. г<br>(а) 9,7 %; (в) 21,4 %<br>(б) 10,7 % (г) 53,5 %<br>83. Аміак об'ємом 11,2 л (н. у.) пропустили в розчин, яхм містить 35 г нітратної кислоти. Визначте маси речовин, що пере, бувають у розчині після завершення реакції.<br><br>§ 13. ПРОМИСЛОВИЙ СИНТЕЗ АМІАКУ<br>У промисловості аміак синтезують з простих речовин азоту N2 і водню Н2;<br>N2 + ЗН2 +*. 2NH3, АЯ= -92 кДж. 4 моль 2 моль , І<br>За яких умов здійснюється цей синтез, можна дізнатись з рівняння реакції. Але для виробництва цього замало, бо основним завданням є не просто добути аміак, а добути його найбільш економічним способом. Для цього необхідно і з'ясувати оптимальні умови синтезу, тобто такі, за яких ви¬хід аміаку буде найбільшим і процес здійснюватиметься з ' великою швидкістю.<br>Звернімося до ршняння реакції. Що з нього видно?<br>Ми бачимо, що: 1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага; 2) реакція відбувається між газами із зменшен¬ням об'єму; 3) реакція екзотермічна, відбувається з виділен¬ням теплоти.<br>Як же керувати такою реакцією, пам'ятаючи, що вироб¬ництво аміаку має бути економічно вигідним?<br>Згадаємо теорпо, а саме—принцип Ле Шательє: якшР система перебуває у стані рівноваги, то' в процесі дії на неї сил, що викликають зсув рівноваги, система переходить У такий стан, в якому ефект цього впливу послаблюється.<br>оДЯЧи з принципу Ле Шательє, розмірковуємо так: реакція екзотермічна, то треба знизити температуру, ^^° аміак не розклався. Але із зниженням температури Щ° кість реакції зменшиться. Це нібито не страшно, бо Цір^;а використати каталізатор. Проте відомо, що каталіза-^° виявляє свою активність лише із нагріванням до певної т°Р ератури. Отже, знижувати температуру можна, але тіль-JL до певної межі.<br>Далі звертаємо увагу, що реакція між газами відбувається меншенням об'єму. Це означає, що рівновага зміщувати¬меться у бік утворення аміаку за умови підвищеного тиску. тТооте навіть за дуже високого тиску зв'язати весь азот і во-едь не вдається, а застосування високих тисків спричинює Збільшення вартості обладнання і збільшення витрат енергії на стиснення газової суміші.<br>Виходячи з обговорення умов процесу, робимо висно¬вок, Ш° ДДЯ синтезу аміаку треба:<br>а) застосовувати невеликий тиск (ЗО МПа), який дає змогу змістити рівновагу в бис утворення аміаку;<br>б) використовувати каталізатор (губчасте задізо з доміш¬ками А1203 і К20);<br>в) підвищувати температуру (до 450—550 °С).<br>Такі умови вважаються оптимальними для економічно доцільного синтезу аміаку.<br>Реакція відбувається в колоні синтезу (див. вклейку). Колона синтезу складається з тешіообмшника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутринній діаметр корпусу колони. Отже, між каталізаторною коробкою і корпусом утворюєть¬ся щілина. Холодна суміш азоту з воднем надходить у коло¬ну через цю щілину і запобіїає перегріванню корпусу. Газо¬ва суміш іде донизу, проходить між гарячими трубками теплообмінника, нагризається і потрапляє до каталізаторної коробки. Тут, на каталізаторі, відбувається синтез аміаку. При цьому виділяється багато теплоти. Гаряча суміш аміаку, азоту й водню надходить у трубки теплообмінника, тому вони гарячі. Відбувається теплообмін, теплота реакції утилі¬зується — це один з важливих принципів сучасного вироб¬ництва.<br>Газ, що виходить з колони синтезу, містить 12—15 % аміаку. В такому разі не зрозуміло, чому синтез вважається економічно доцільним. Річ у тім, що далі в процесі вироб-<br>ництва використовують принцип циркуляції, за яким<br>азої<br>водень, що не прореагували, відокремлюються від зрід^ " го аміаку і знову повертаються в колону синтезу. Завдо^ принципу циркуляції на сучасних заводах вихід аміаку стГ новить 96—98 %.<br>В Україні перший завод з виробництва синтетичною аміаку став до ладу у 1933 р. в Горлівці Донецької області Пізнше з'явилися заводи у Дніпродзержинську (1938), Q. верськодонецьку (1958), Черкасах (1962), Рівному (1965) тощо. Нині триває робота з дальшого вдосконалення техно¬логії аміачного виробництва.<br>Завдання для самоконтролю<br>84. Які хімічні процеси лежать в основі лабораторного і промислового способів добування аміаку?<br>85. Назвіть оптимальні умови промислового синтезу аміаку. Як вони узгоджуються з принципом Ле Шательє? Дайте обгрунто¬вану відповідь, виходячи з рівняння реакції.<br>86. За кольоровим малюнком на вклейці спробуйте пояснити призначення кожного з апаратів технологічної схеми виробництва аміаку. Поясніть принцип дії колони синтезу.<br>87. Корпус колони синтезу аміаку зроблено із сталі. Відомо, що за високої температури і високого тиску водень і аміак руйнують сталь. Яке інженерне рішення дає змогу захистити коло¬ну від хімічного руйнування?<br>88. Який об'єм водню (н. у.) необхідний для виробництва аміаку масою 5 т, якщо вихід аміаку завдяки використанню цирку¬ляції становить 95 96?<br>
| + | Отже, аміак, взаємодіючи з кислотами, утворює солі амонію: <br> |
| | | | |
| - | <br> ''Н.М. Буринська, Л.П. Величко, Хімія, 10 клас<br>Вислано читачами з інтернет-сайтів ''
| + | ''Напишіть рівняння реакцій між аміаком і: а) нітратною, б) сульфатною кислотами. Які солі амонію при цьому утворюються?<br>Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»?'' '''<br>''' |
| | | | |
| - | <br> <sub>Матеріали з хімії, планування[[Хімія|з хімії]], завдання та [[Гіпермаркет Знань - перший в світі!|відповіді]] по класам, плани конспектів уроків [[Хімія 10 клас|з хімії для 10 класу]]</sub> | + | '''Добування'''''.'' У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH<sub>4</sub>Cl і гашеного вапна Са(ОH)<sub>2</sub> за рівнянням: |
| | + | |
| | + | 2NH<sub>4</sub>Cl + Са(ОН)<sub>2</sub> = CaCl<sub>2</sub>+2NH<sub>3</sub>↑ + 2Н<sub>2</sub>0 . <br> |
| | + | |
| | + | ''Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном?'' <br> |
| | + | |
| | + | '''Застосування'''''.'' Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках. |
| | + | |
| | + | У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.<br><br>'''Солі амонію''' — це кристалічні речовини з йонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.<br> <br> Напишіть формули трьох солей амонію і зазначте назву кожної з них.<br> |
| | | | |
| | <br> | | <br> |
| | + | |
| | + | '''[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Фізичні властивості]]'''[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Фiзичні й хімічні властивості речовини.]]'''.'''<br> |
| | + | |
| | + | <u></u>Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | '''[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Хімічні властивості]]'''[[Відео до уроку: Фiзичні й хімічні властивості речовини.|Фiзичні й хімічні властивості речовини.]]'''. '''<br> Солі амонію виявляють типові для всіх солей властивості і деякі специфічні.<br> |
| | + | |
| | + | ''1. Дисоціація на йони.'' Як сильні електроліти солі амонію у водному розчині добре дисоціюють на йони:<br> |
| | + | |
| | + | (NH<sub>4</sub>)2S0<sub>4</sub> ⇔2NH<sup>+</sup><sub>4 </sub>+ SO<sup>2-</sup><sub>4</sub><br> |
| | + | |
| | + | ''2. Взаємодія з іншими солями.'' Якщо в пробірку з розчином хлориду амонію долити розчин нітрату аргентуму, то випадає сирнистий (схожий на зсіле молоко) білий осад:<br> |
| | + | |
| | + | NH<sub>4</sub>Cl + AgN0<sub>3</sub> = NH<sub>4</sub>N0<sub>3</sub>+ AgCl↓ <br> <br> |
| | + | |
| | + | ''Ви переконалися, що солі амонію вступають у реакцію йонного обміну з іншими солями. Напишіть наведене рівняння у повній і скороченій йонних формах. Пригадайте, яких умов треба додержувати, щоб реакція обміну між двома солями відбулася до кінця, тобто практично була б необоротною. Чи витримані такі умови у даному разі?''<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | ''3. Взаємодія з [[40. Історичні відомості про спроби класифiкації хiмічних елементів. Поняття про лужні, інертні елементи, галогени|лугами]]. ''В результаті взаємодії солей амонію з лугами утворюється аміак, через що дану реакцій використовують як якісну на солі амонію:<br> |
| | + | |
| | + | NH<sub>4</sub>Cl + NaOH = NaCl + NH<sub>3</sub>↑ + H<sub>2</sub>0<br> |
| | + | |
| | + | Виділення аміаку NH<sub>3</sub> —характерна ознака для розпізнавання солей амонію.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | '''Лабораторна робота З'''<br> |
| | + | |
| | + | '''Виявлення йонів амонію в розчині'''<br> |
| | + | |
| | + | Налийте в пробірку 2 мл розчину сульфату амонію і добавте до нього стільки ж розчину гідроксиду натрію. Нагрійте рідину в пробірці до кипіння й обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки червоний лакмусовий папірець, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції.<br> |
| | + | |
| | + | Отже, якісною реакцією на солі амонію є дія лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посинінням червоного вологого лакмусового папірця.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Доведіть за допомогою йонного рівняння, що гідроксид-іони ОН<sup>-</sup> є реактивом на йони амонію NH<sup>+</sup><sub><sup></sup>4</sub>.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | ''4. Розклад під час нагрівання:'' |
| | + | |
| | + | <sub>нагрівання </sub> |
| | + | |
| | + | <sub></sub>NH<sub>4</sub>C <sub><sup>----------></sup> </sub>NH3 + HCl |
| | + | |
| | + | <sup><sub> </sub><sub><-----------</sub></sup><br><sup> охолодження </sup><br><br>NH<sub>4</sub>N0<sub>3</sub> → N<sub>2</sub>0 + 2H<sub>2</sub>0<br><br>''Добування.'' Солі амонію добувають внаслідок взаємодії аміаку або аміачної води (NH<sub>3</sub> • Н<sub>2</sub>0) з кислотами: |
| | + | |
| | + | NH<sub>3</sub> + HN0<sub>3</sub> = NH<sub>4</sub>N0<sub>3</sub> |
| | + | |
| | + | '''<br>''' |
| | + | |
| | + | '''Лабораторна робота 4''' |
| | + | |
| | + | '''Утворення солей амонію'''<br>До отвору пробірки з концентрованим розчином аміаку піднесіть скляну паличку, змочену концентрованою хлоридною<br>кислотою. |
| | + | |
| | + | Як пояснити утворення диму? Дослід повторіть, узявши замість хлоридної концентровану нітратну кислоту. Напишіть рівняння проведених реакцій. |
| | + | |
| | + | <br> |
| | + | |
| | + | ''Застосування. ''Нітрат амонію NH<sub>4</sub>N0<sub>3 </sub>і сульфат амонію (NH<sub>4</sub>)2S0<sub>4</sub> використовують головним чином як добрива. Нітрат амонію NH<sub>4</sub>N0<sub>3</sub> (в суміші з алюмінієм і вугіллям) застосовують для виготовлення вибухової речовини — амоналу. Хлорид амонію NH<sub>4</sub>Cl під назвою «нашатир» використовують у процесі паяння для очищення поверхні паяльника. |
| | + | |
| | + | <br> |
| | + | |
| | + | Коли нагрітий паяльник занурюють у нашатир NH<sub>4</sub>Сl, то сіль розкладається (див. вище). Утворений хлороводень НСl взаємодіє з оксидом купруму (II) CuO, що вкриває поверхню паяльника, внаслідок чого з'являється хлорид купруму(II) СuСl<sub>2</sub>, який сплавляється з надлишком нашатирю NH<sub>4</sub>Cl. В результаті поверхня паяльника звільняється від оксидів, і розплавлене олово прилипає до очищеної міді.<br><br><br>У [[Ілюстрації до теми Загальна характеристика господарства. Промисловість. Сільське господарство. Транспорт|промисловості]] аміак синтезують з простих речовин азоту N<sub>2 </sub>і водню Н<sub>2</sub>:<br> |
| | + | |
| | + | N<sub>2</sub> + ЗН<sub>2</sub> ⇔ 2NH<sub>3</sub>, Δ''H ''= -92 кДж.<br> |
| | + | |
| | + | <sup>4 моль 2 моль </sup><br>За яких умов здійснюється цей синтез, можна дізнатись з рівняння реакції. Але для виробництва цього замало, бо основним завданням є не просто добути аміак, а добути його найбільш економічним способом. Для цього необхідно з'ясувати оптимальні умови синтезу, тобто такі, за яких вихід аміаку буде найбільшим і процес здійснюватиметься з великою швидкістю.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Звернімося до ршняння реакції. ''Що з нього видно?''<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Ми бачимо, що: 1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага; 2) реакція відбувається між газами із зменшенням об'єму; 3) реакція екзотермічна, відбувається з виділенням теплоти.<br> |
| | + | |
| | + | ''Як же керувати такою реакцією, пам'ятаючи, що виробництво аміаку має бути економічно вигідним?''<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Згадаємо теорію, а саме — принцип Ле Шательє: якщо система перебуває у стані рівноваги, то в процесі дії на неї сил, що викликають зсув рівноваги, система переходить у такий стан, в якому ефект цього впливу послаблюється.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Виходячи з принципу Ле Шательє, розмірковуємо так: реакція екзотермічна, то треба знизити температуру, щоб аміак не розклався. Але із зниженням температури швидкість реакції зменшиться. Це нібито не страшно, бо можна використати каталізатор. Проте відомо, що каталізатор виявляє свою активність лише із нагріванням до певної температури. Отже, знижувати температуру можна, але тільки до певної межі.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Далі звертаємо увагу, що реакція між газами відбувається меншенням об'єму. Це означає, що рівновага зміщуватиметься у бік утворення аміаку за умови підвищеного тиску. Проте навіть за дуже високого тиску зв'язати весь азот і водень не вдається, а застосування високих тисків спричинює збільшення вартості обладнання і збільшення витрат енергії на стиснення газової суміші.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Виходячи з обговорення умов процесу, робимо висновок, що для синтезу аміаку треба:<br>а) застосовувати невеликий тиск (30 МПа), який дає змогу змістити рівновагу в бік утворення аміаку;<br>б) використовувати каталізатор (губчасте залізо з домішками Аl<sub>2</sub>0<sub>3</sub> і К<sub>2</sub>0);<br>в) підвищувати температуру (до 450—550 °С).<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Такі умови вважаються оптимальними для економічно доцільного синтезу аміаку.<br> |
| | + | |
| | + | Реакція відбувається в колоні синтезу(див. вклейку). |
| | + | |
| | + | <br> |
| | + | |
| | + | [[Image:51.jpg|350px|Промисловий синтез аміаку. фото]] |
| | + | |
| | + | <br> |
| | + | |
| | + | Колона синтезу складається з теплообмінника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутрішній діаметр корпусу колони. Отже, між каталізаторною коробкою і корпусом утворюється щілина. Холодна суміш азоту з воднем надходить у колону через цю щілину і запобігає перегріванню корпусу. Газова суміш іде донизу, проходить між гарячими трубками теплообмінника, нагризається і потрапляє до каталізаторної коробки. Тут, на каталізаторі, відбувається синтез аміаку. При цьому виділяється багато теплоти. Гаряча суміш аміаку, азоту й водню надходить у трубки теплообмінника, тому вони гарячі. Відбувається теплообмін, теплота реакції ''утилізується'' — це один з важливих принципів сучасного виробництва.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | Газ, що виходить з колони синтезу, містить 12—15 % аміаку. В такому разі не зрозуміло, чому синтез вважається економічно доцільним. Річ у тім, що далі в процесі виробництва використовують ''принцип циркуляції'', за яким азот і водень, що не прореагували, відокремлюються від зрідженого аміаку і знову повертаються в колону синтезу. Завдяки принципу циркуляції на сучасних заводах вихід аміаку становить 96—98 %.<br> |
| | + | |
| | + | <br> |
| | + | |
| | + | В Україні перший завод з виробництва синтетичною аміаку став до ладу у 1933 р. в Горлівці Донецької області. Пізнше з'явилися заводи у Дніпродзержинську (1938), Сіверськодонецьку (1958), Черкасах (1962), Рівному (1965) тощо. Нині триває робота з дальшого вдосконалення технології аміачного виробництва. |
| | + | |
| | + | <br> |
| | + | |
| | + | '''Завдання для самоконтролю'''<br>''1. Чи можна зібрати аміак способом: а) витіснення повітря? б) витіснення води? Чому?<br>2. Зазначте електронні конфігурації атомів Нітрогену і Гідрогену та поясніть, якими електронами утворюються ковалентні<br>зв'язки в молекулі аміаку і чому вона полярна. Яка валентність і який ступінь окиснення Нітрогену в аміаку?<br>3. Які реакції аміаку з іншими речовинами ведуть до утворення йонів амонію?<br>4. В якому напрямі (на. підставі принципу Ле Шательє) зміститься рівновага реакції аміаку з водою під час: а) нагрівання; б) охолодження; в) додавання кислоти; г) додавання лугу?<br>5. На каталітичне окиснення аміаку кількістю речовини 2 моль витрачається кисень об'ємом (н. у.)<br>(а) 11,2 л; (в) 28 л;<br>(б) 22,4 л; (г) 56 л.<br>6. Під час взаємодії хлориду амонію з гашеним вапном масою 370 кг виділяється аміак об'ємом (н. у.)<br>(а) 11,2 м3: (в) 224 м3;<br>(б) 22,4 м3; (г) 448 м3.<br>7. Прокип'ятили 200 г розчину з масовою часткою аміаку в ньому 25 %. При цьому 20 г аміаку звітрилося. Якою стала масова частка аміаку в розчині? Яка маса хлороводню потрібна для його нейтралізації?<br>8. Напишіть рівняння взаємодії аміаку з сульфатною кислотою зважте на те, що можуть утворитися як середня, так і кисла солі амонію. Поясніть, від чого це залежить.<br>9. Карбонат амонію (NH<sub>4</sub>)<sub>2</sub>C0<sub>3</sub> застосовують у кондитерській справі як розпушувач тіста. На якій властивості солі грунтується таке її застосування? Відповідь проілюструйте рівнянням реакції.<br>10. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:<br>N<sub>2</sub> → NH<sub>3</sub> → (NH<sub>4</sub>)<sub>3</sub>P0<sub>4</sub> → NH<sub>3</sub> →NO→ N0<sub>2</sub><br>11. На сульфат амонію масою 33 г подіяли розчином лугу. При цьому виділився аміак об'ємом (н. у.)<br>(а) 11,2 л; (в) 33,6 л; <br>(б) 22,4 л; (г) 44,8 л. <br>12. На 6,8 г аміаку подіяли хлороводнем. Добутий хлорид амонію розчинили у 200г води. Масова частка NH<sub>4</sub>Cl у добутому<br>розчині становить <br>(а) 9,7 %; (в) 21,4 %<br>(б) 10,7 % (г) 53,5 %<br>13. Аміак об'ємом 11,2 л (н. у.) пропустили в розчин, який містить 35 г нітратної кислоти. Визначте маси речовин, що перебувають у розчині після завершення реакції.<br>14. Які хімічні процеси лежать в основі лабораторного і промислового способів добування аміаку?<br>15. Назвіть оптимальні умови промислового синтезу аміаку. Як вони узгоджуються з принципом Ле Шательє? Дайте обгрунтовану відповідь, виходячи з рівняння реакції.<br>16. За кольоровим малюнком на вклейці спробуйте пояснити призначення кожного з апаратів технологічної схеми виробництва аміаку. Поясніть принцип дії колони синтезу.<br>17. Корпус колони синтезу аміаку зроблено із сталі. Відомо, що за високої температури і високого тиску водень і аміак руйнують сталь. Яке інженерне рішення дає змогу захистити колону від хімічного руйнування?<br>18. Який об'єм водню (н. у.) необхідний для виробництва аміаку масою 5 т, якщо вихід аміаку завдяки використанню циркуляції становить 95 %?<br>'' |
| | + | |
| | + | ''<br> Н.М. Буринська, Л.П. Величко, [[Хімія 10 клас|Хімія, 10 клас]]<br>Вислано читачами з інтернет-сайтів '' |
| | + | |
| | + | <u><br> '''Гідроген хлорид. Хлоридна кислота. Хлориди'''</u><br>Гідроген хлорид. Гідроген хлорид, або хлороводень, НС1 є однією з найважливіших неорганічних сполук. Він слугує реагентом у різних процесах у хімічній технології. Водний розчин хлороводню — хлоридну кислоту — широко використовують у промисловості, наукових дослідженнях, хімічних лабораторіях.<br> |
| | + | |
| | + | <br>Гідроген хлорид, як і інші аналогічні сполуки неметалічних елементів, має молекулярну будову. Електронна і графічна формули молекули хлороводню: |
| | + | |
| | + | [[Image:H1017.jpg|формула. фото]]<br> |
| | + | |
| | + | <br>Ковалентний зв'язок між атомами Гідрогену і Хлору є полярним; атом більш електронегативного Хлору зміщує у свій бік спільну електронну пару: [[Image:H1018.jpg|формула. фото]]<br> |
| | + | |
| | + | На атомі Хлору зосереджується невеликий негативний заряд, а на атомі Гідрогену — такий самий за значенням, але позитивний заряд: |
| | + | |
| | + | [[Image:H1019.jpg|формула. фото]]<br> |
| | + | |
| | + | <br> Молекула гідроген хлориду є полярною.<br> |
| | + | |
| | + | '''<br>'''[[Сполуки неметалічних елементів з Гідрогеном. Склад, фізичні властивості, добування в лабораторії аміаку і хлороводню|'''Хлороводень''']] — безбарвний газ із різким запахом, важчий за повітря, добре розчинний у воді. За температури 20 °С і нормального тиску в 1 л води розчиняється 445 л цього газу. У вологому повітрі гідроген хлорид «димить» унаслідок утворення дрібних краплинок його водного розчину.<br> |
| | + | |
| | + | <br>Хлороводень сильно подразнює дихальні шляхи. Тому досліди із цим газом та його концентрованим водним розчином (концентрованою хлоридною кислотою) проводять у витяжній шафі.<br> |
| | + | |
| | + | <br>'''Хлоридна кислота'''. Водний розчин гідроген хлориду називають хлоридною кислотою. Тривіальна назва цього розчину — соляна кислота. Вона зумовлена тим, що раніше для добування кислоти використовували природну сіль (натрій хлорид).<br> |
| | + | |
| | + | <br>Для підтвердження високої розчинності хлороводню у воді й кислотних властивостей водного розчину цієї сполуки демонструють ефектний дослід. У посудину з водою добавляють кілька крапель розчину лакмусу або метилоранжу. Хлороводнем наповнюють колбу, добавляють у неї 1—2 краплі води, швидко закривають пробкою, в яку вставлена скляна трубка, і занурюють кінець трубки в розчин індикатора у посудині (мал. 21). Під час розчинення газу тиск у колбі знижується; рідина заповнює колбу, створюючи фонтан, і набуває червоного забарвлення.<br> |
| | + | |
| | + | <br>Майже насичений водний розчин гідроген хлориду (масова частка НС1 у ньому становить 34—36 %) називають концентрованою хлоридною кислотою. Із цього розчину постійно виділяється хлороводень.<br> |
| | + | |
| | + | <br>Хлоридна кислота належить до сильних кислот; ступінь її дисоціації в розбавлених розчинах перевищує 90 %. |
| | + | |
| | + | <br> |
| | + | |
| | + | [[Image:H1020.jpg|350px|Розчинення хлороводню у воді. фото]] |
| | + | |
| | + | ''Поясніть, чому і як молекула НС1 розпадається на йони у водному розчині.'' |
| | + | |
| | + | <br>Хімічні властивості. Хлоридна кислота, як і інші кислоти, реагує:<br>• з металами з виділенням водню<br>[[Image:H1021.jpg|формула. фото]] (метали, розміщені в ряду активності справа від водню, із хлоридною кислотою не взаємодіють);<br>• з основними й амфотерними оксидами<br>[[Image:H1022.jpg|формули. фото]]<br>• з основами й амфотерними гідроксидами<br>[[Image:H1023.jpg|формули. фото]]<br>• із більшістю солей<br>[[Image:H1024.jpg|формули. фото]]<br> |
| | + | |
| | + | Для трьох останніх реакцій складіть йонно-молекулярні рівняння. |
| | + | |
| | + | <br>Добування гідроген хлориду і хлоридної кислоти. У промисловості гідроген хлорид добувають спалюванням водню в атмосфері хлору (мал. 22) |
| | + | |
| | + | <br> |
| | + | |
| | + | [[Image:H1025.jpg|350px|Горіння водню в атмосфері хлору]]<br> |
| | + | |
| | + | Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою:<br>[[Image:H1026.jpg]]<br>Таким способом раніше добували хлороводень і в промисловості.<br> |
| | + | |
| | + | ''Чи можна замість твердої солі використати її водний розчин, а замість концентрованої кислоти — розбавлену? ''Відповідь аргументуйте. |
| | + | |
| | + | <br>Хлороводень розчиняють у воді й отримують хлоридну кислоту. |
| | + | |
| | + | <br>Прилад для добування гідроген хлориду і хлоридної кислоти в лабораторії зображено на малюнку 23. Хлороводень, будучи важчим за повітря, витісняє його зі склянки і розчиняється у воді. Зверніть увагу: вільний кінець газовідвідної трубки не повинен торкатися води. Інакше вода внаслідок швидкого розчинення в ній гідроген хлориду потрапить у трубку, а відтак — у концентровану сульфатну кислоту. Відбудеться сильне розігрівання, пробірка може тріснути, а кислота — потрапити на шкіру і спричинити опіки. |
| | + | |
| | + | <br> |
| | + | |
| | + | [[Image:H1027.jpg|350px|Добування гідроген хлориду і хлоридної кислоти в лабораторії. фото]]<br> |
| | + | |
| | + | <br> ''П.П. Попель, Л.С. Крикля. [[Хімія 10 клас|Хімія, 10 клас]]<br>Надіслано читачами інтернет-сайту'' |
| | + | |
| | + | <br> <sub>Матеріали з хімії, планування[[Хімія|з хімії]], завдання та [[Гіпермаркет Знань - перший в світі!|відповіді]] по класам, плани конспектів уроків [[Хімія 10 клас|з хімії для 10 класу]]</sub><br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%92%D0%B7%D0%B0%D1%94%D0%BC%D0%BE%D0%B4%D1%96%D1%8F_%D0%B0%D0%BC%D0%BE%D0%BD%D1%96%D0%B0%D0%BA%D1%83_%D1%82%D0%B0_%D1%85%D0%BB%D0%BE%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BD%D1%8E_%D0%B7_%D0%B2%D0%BE%D0%B4%D0%BE%D1%8E._%D0%A1%D0%BE%D0%BB%D1%96_%D0%B0%D0%BC%D0%BE%D0%BD%D1%96%D1%8E._%D0%AF%D0%BA%D1%96%D1%81%D0%BD%D0%B0_%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D1%96%D1%8F_%D0%BD%D0%B0_%D0%B9%D0%BE%D0%BD%D0%B8_%D0%B0%D0%BC%D0%BE%D0%BD%D1%96%D1%8E_%D1%82%D0%B0_%D1%85%D0%BB%D0%BE%D1%80%D0%B8%D0%B4-%D1%96%D0%BE%D0%BD%D0%B8._%D0%9F%D1%80%D0%B5%D0%B7%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D1%96%D1%8F_%D1%83%D1%80%D0%BE%D0%BA%D1%83 презентація уроку] |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| - | | + | |
| - | <br>
| + | |
| | | | |
| | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| | | | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].<br> | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум].<br> |
Текущая версия на 07:02, 14 сентября 2012
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Взаємодія амоніаку та хлороводню з водою. Солі амонію. Якісна реакція на йони амонію та хлорид-іони
1. Взаємодія з водою. Аміак добре розчиняється у воді утворюючи аміачну воду (за нормальних умов у 100 г води розчиняється 87,5 г, або 115л, NH3). Висока розчинність аміаку пояснюється тим, що він реагує з водою. Якщо суху колбу, заповнену аміаком і закриту пробкою із вставленою трубкою з відтягнутим кінцем, занурити у воду, до якої додано кілька крапель розчину фенолфталеїну, то з безбарвної рідини починає бити малиновий «фонтан». Забарвлення аміачної води свідчить про те, що водний розчин аміаку має лужну реакцію.
Як це можна пояснити?
У воді концентрації йонів Гідрогену Н+ і гідроксид-іонів ОН- — однакові:
H2O ⇔ H+ + OH- ,
тому середовище нейтральне, і фенолфталеїн безбарвний. З розчиненням аміаку NH3 у воді концентрація гідроксид-іонів ОН- збільшується, отже, утворюється лужне середовище, і фенолфталеїн стає малиновим.
Виникнення лужного середовища пояснюється тим, що в розчині молекули аміаку приєднують йони гідрогену, утворюючи йони амонію NH+4.
NH3 + H+ → NH4
При цьому вивільнюються з води гідроксид-іони ОН- , що й надає розчину лужної реакції.
Кожний йон амонію NH+4 має чотири ковалентні зв'язки. Три з них юються за рахунок трьох неспарених електронів, які є на р-орбіталях зовнішнього електронного шару атома Нітрогену. Четвертий зв'язок утворюється за донорно-акцепторним механізмом між атомом Нітрогену аміаку (донор) та йоном гідрогену (акцептор):
Н Н +
l І
Н — N: + Н+ → Н — N — Н
І І
Н Н
Усі чотири зв'язки нітроген-гідроген N — Н в йоні амонію рівноцінні, незважаючи на різні механізми їхнього утворення.
Взаємодія аміаку з водою відбувається за рівнянням:
NH3 + Н20 ⇔ NH3 • Н20⇔ NH+4 + ОН-
Але в розчині лише невелика частина молекул NH3 перетворюється на йони амонію NH+4. Тому аміачна вода пахне аміаком.
Аміачну воду позначають формулою NH3 • Н20 і називають гідроксидом амонію, або нашатирним спиртом. Він належить до слабких і нестійких основ:
NH3 • Н20 ⇔ NH+4 + ОН-
NH3 • Н20⇔ NH3↑ + Н20
2. Взаємодія з кислотами. Якщо змочити одну скляну паличку концентрованим розчином аміаку, а іншу — концентрованою хлоридною кислотою і піднести їх одну до одної, то з'являється білий дим — дрібні кристалики хлориду амонію (нашатирю):
NH3 + НСl = NH4Cl
Отже, аміак, взаємодіючи з кислотами, утворює солі амонію:
Напишіть рівняння реакцій між аміаком і: а) нітратною, б) сульфатною кислотами. Які солі амонію при цьому утворюються?
Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»?
Добування. У лабораторії аміак добувають із суміші твея дих речовин — нашатирю NH4Cl і гашеного вапна Са(ОH)2 за рівнянням:
2NH4Cl + Са(ОН)2 = CaCl2+2NH3↑ + 2Н20 .
Чому для добування аміаку беруть сухі речовини, а не їхні розчини? Чому збирають аміак у пробірку, перевернену догори дном?
Застосування. Аміак — важливий продукт хімічної промисловості. Його використовують як добриво і для виробництва азотних добрив, а також нітратної кислоти, вибухових речовин, соди. Як холодоагент аміак застосовують у холодильниках.
У вигляді аміачної води він використовується у медицині під назвою «нашатирний спирт». Вдихання малих кількостей аміаку І стимулює роботу серця і нервової системи, тому нашатирний спирт дають нюхати при знепритомленні та отруєннях, наприклад чадним газом CO. Як слабкий луг аміачну воду широко застосовують у хімічних лабораторіях, а також у побуті: під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
Солі амонію — це кристалічні речовини з йонним типом зв'язку. До складу солей амонію входять один або кілька катіонів амонію і аніон кислотного залишку.
Напишіть формули трьох солей амонію і зазначте назву кожної з них.
Фізичні властивостіФiзичні й хімічні властивості речовини..
Солі амонію — тверді кристалічні речовини, що за зовнішнім виглядом нагадують солі лужних металів. У воді добре розчиняються.
Хімічні властивостіФiзичні й хімічні властивості речовини..
Солі амонію виявляють типові для всіх солей властивості і деякі специфічні.
1. Дисоціація на йони. Як сильні електроліти солі амонію у водному розчині добре дисоціюють на йони:
(NH4)2S04 ⇔2NH+4 + SO2-4
2. Взаємодія з іншими солями. Якщо в пробірку з розчином хлориду амонію долити розчин нітрату аргентуму, то випадає сирнистий (схожий на зсіле молоко) білий осад:
NH4Cl + AgN03 = NH4N03+ AgCl↓
Ви переконалися, що солі амонію вступають у реакцію йонного обміну з іншими солями. Напишіть наведене рівняння у повній і скороченій йонних формах. Пригадайте, яких умов треба додержувати, щоб реакція обміну між двома солями відбулася до кінця, тобто практично була б необоротною. Чи витримані такі умови у даному разі?
3. Взаємодія з лугами. В результаті взаємодії солей амонію з лугами утворюється аміак, через що дану реакцій використовують як якісну на солі амонію:
NH4Cl + NaOH = NaCl + NH3↑ + H20
Виділення аміаку NH3 —характерна ознака для розпізнавання солей амонію.
Лабораторна робота З
Виявлення йонів амонію в розчині
Налийте в пробірку 2 мл розчину сульфату амонію і добавте до нього стільки ж розчину гідроксиду натрію. Нагрійте рідину в пробірці до кипіння й обережно понюхайте газ, що виділяється. Піднесіть до отвору пробірки червоний лакмусовий папірець, змочений водою. Що спостерігається? Чому? Напишіть рівняння реакції.
Отже, якісною реакцією на солі амонію є дія лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посинінням червоного вологого лакмусового папірця.
Доведіть за допомогою йонного рівняння, що гідроксид-іони ОН- є реактивом на йони амонію NH+4.
4. Розклад під час нагрівання:
нагрівання
NH4C ----------> NH3 + HCl
<-----------
охолодження
NH4N03 → N20 + 2H20
Добування. Солі амонію добувають внаслідок взаємодії аміаку або аміачної води (NH3 • Н20) з кислотами:
NH3 + HN03 = NH4N03
Лабораторна робота 4
Утворення солей амонію
До отвору пробірки з концентрованим розчином аміаку піднесіть скляну паличку, змочену концентрованою хлоридною
кислотою.
Як пояснити утворення диму? Дослід повторіть, узявши замість хлоридної концентровану нітратну кислоту. Напишіть рівняння проведених реакцій.
Застосування. Нітрат амонію NH4N03 і сульфат амонію (NH4)2S04 використовують головним чином як добрива. Нітрат амонію NH4N03 (в суміші з алюмінієм і вугіллям) застосовують для виготовлення вибухової речовини — амоналу. Хлорид амонію NH4Cl під назвою «нашатир» використовують у процесі паяння для очищення поверхні паяльника.
Коли нагрітий паяльник занурюють у нашатир NH4Сl, то сіль розкладається (див. вище). Утворений хлороводень НСl взаємодіє з оксидом купруму (II) CuO, що вкриває поверхню паяльника, внаслідок чого з'являється хлорид купруму(II) СuСl2, який сплавляється з надлишком нашатирю NH4Cl. В результаті поверхня паяльника звільняється від оксидів, і розплавлене олово прилипає до очищеної міді.
У промисловості аміак синтезують з простих речовин азоту N2 і водню Н2:
N2 + ЗН2 ⇔ 2NH3, ΔH = -92 кДж.
4 моль 2 моль
За яких умов здійснюється цей синтез, можна дізнатись з рівняння реакції. Але для виробництва цього замало, бо основним завданням є не просто добути аміак, а добути його найбільш економічним способом. Для цього необхідно з'ясувати оптимальні умови синтезу, тобто такі, за яких вихід аміаку буде найбільшим і процес здійснюватиметься з великою швидкістю.
Звернімося до ршняння реакції. Що з нього видно?
Ми бачимо, що: 1) ця реакція є оборотною, отже, до кінця не доходить, у процесі реакції встановлюється хімічна рівновага; 2) реакція відбувається між газами із зменшенням об'єму; 3) реакція екзотермічна, відбувається з виділенням теплоти.
Як же керувати такою реакцією, пам'ятаючи, що виробництво аміаку має бути економічно вигідним?
Згадаємо теорію, а саме — принцип Ле Шательє: якщо система перебуває у стані рівноваги, то в процесі дії на неї сил, що викликають зсув рівноваги, система переходить у такий стан, в якому ефект цього впливу послаблюється.
Виходячи з принципу Ле Шательє, розмірковуємо так: реакція екзотермічна, то треба знизити температуру, щоб аміак не розклався. Але із зниженням температури швидкість реакції зменшиться. Це нібито не страшно, бо можна використати каталізатор. Проте відомо, що каталізатор виявляє свою активність лише із нагріванням до певної температури. Отже, знижувати температуру можна, але тільки до певної межі.
Далі звертаємо увагу, що реакція між газами відбувається меншенням об'єму. Це означає, що рівновага зміщуватиметься у бік утворення аміаку за умови підвищеного тиску. Проте навіть за дуже високого тиску зв'язати весь азот і водень не вдається, а застосування високих тисків спричинює збільшення вартості обладнання і збільшення витрат енергії на стиснення газової суміші.
Виходячи з обговорення умов процесу, робимо висновок, що для синтезу аміаку треба:
а) застосовувати невеликий тиск (30 МПа), який дає змогу змістити рівновагу в бік утворення аміаку;
б) використовувати каталізатор (губчасте залізо з домішками Аl203 і К20);
в) підвищувати температуру (до 450—550 °С).
Такі умови вважаються оптимальними для економічно доцільного синтезу аміаку.
Реакція відбувається в колоні синтезу(див. вклейку).
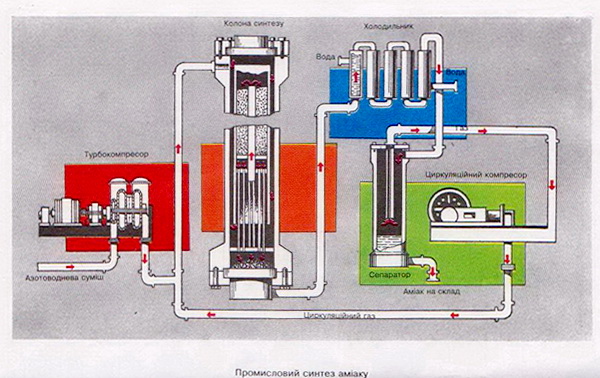
Колона синтезу складається з теплообмінника (нижня частина) і каталізаторної коробки (верхня частина), діаметр якої дещо менший, ніж внутрішній діаметр корпусу колони. Отже, між каталізаторною коробкою і корпусом утворюється щілина. Холодна суміш азоту з воднем надходить у колону через цю щілину і запобігає перегріванню корпусу. Газова суміш іде донизу, проходить між гарячими трубками теплообмінника, нагризається і потрапляє до каталізаторної коробки. Тут, на каталізаторі, відбувається синтез аміаку. При цьому виділяється багато теплоти. Гаряча суміш аміаку, азоту й водню надходить у трубки теплообмінника, тому вони гарячі. Відбувається теплообмін, теплота реакції утилізується — це один з важливих принципів сучасного виробництва.
Газ, що виходить з колони синтезу, містить 12—15 % аміаку. В такому разі не зрозуміло, чому синтез вважається економічно доцільним. Річ у тім, що далі в процесі виробництва використовують принцип циркуляції, за яким азот і водень, що не прореагували, відокремлюються від зрідженого аміаку і знову повертаються в колону синтезу. Завдяки принципу циркуляції на сучасних заводах вихід аміаку становить 96—98 %.
В Україні перший завод з виробництва синтетичною аміаку став до ладу у 1933 р. в Горлівці Донецької області. Пізнше з'явилися заводи у Дніпродзержинську (1938), Сіверськодонецьку (1958), Черкасах (1962), Рівному (1965) тощо. Нині триває робота з дальшого вдосконалення технології аміачного виробництва.
Завдання для самоконтролю
1. Чи можна зібрати аміак способом: а) витіснення повітря? б) витіснення води? Чому?
2. Зазначте електронні конфігурації атомів Нітрогену і Гідрогену та поясніть, якими електронами утворюються ковалентні
зв'язки в молекулі аміаку і чому вона полярна. Яка валентність і який ступінь окиснення Нітрогену в аміаку?
3. Які реакції аміаку з іншими речовинами ведуть до утворення йонів амонію?
4. В якому напрямі (на. підставі принципу Ле Шательє) зміститься рівновага реакції аміаку з водою під час: а) нагрівання; б) охолодження; в) додавання кислоти; г) додавання лугу?
5. На каталітичне окиснення аміаку кількістю речовини 2 моль витрачається кисень об'ємом (н. у.)
(а) 11,2 л; (в) 28 л;
(б) 22,4 л; (г) 56 л.
6. Під час взаємодії хлориду амонію з гашеним вапном масою 370 кг виділяється аміак об'ємом (н. у.)
(а) 11,2 м3: (в) 224 м3;
(б) 22,4 м3; (г) 448 м3.
7. Прокип'ятили 200 г розчину з масовою часткою аміаку в ньому 25 %. При цьому 20 г аміаку звітрилося. Якою стала масова частка аміаку в розчині? Яка маса хлороводню потрібна для його нейтралізації?
8. Напишіть рівняння взаємодії аміаку з сульфатною кислотою зважте на те, що можуть утворитися як середня, так і кисла солі амонію. Поясніть, від чого це залежить.
9. Карбонат амонію (NH4)2C03 застосовують у кондитерській справі як розпушувач тіста. На якій властивості солі грунтується таке її застосування? Відповідь проілюструйте рівнянням реакції.
10. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
N2 → NH3 → (NH4)3P04 → NH3 →NO→ N02
11. На сульфат амонію масою 33 г подіяли розчином лугу. При цьому виділився аміак об'ємом (н. у.)
(а) 11,2 л; (в) 33,6 л;
(б) 22,4 л; (г) 44,8 л.
12. На 6,8 г аміаку подіяли хлороводнем. Добутий хлорид амонію розчинили у 200г води. Масова частка NH4Cl у добутому
розчині становить
(а) 9,7 %; (в) 21,4 %
(б) 10,7 % (г) 53,5 %
13. Аміак об'ємом 11,2 л (н. у.) пропустили в розчин, який містить 35 г нітратної кислоти. Визначте маси речовин, що перебувають у розчині після завершення реакції.
14. Які хімічні процеси лежать в основі лабораторного і промислового способів добування аміаку?
15. Назвіть оптимальні умови промислового синтезу аміаку. Як вони узгоджуються з принципом Ле Шательє? Дайте обгрунтовану відповідь, виходячи з рівняння реакції.
16. За кольоровим малюнком на вклейці спробуйте пояснити призначення кожного з апаратів технологічної схеми виробництва аміаку. Поясніть принцип дії колони синтезу.
17. Корпус колони синтезу аміаку зроблено із сталі. Відомо, що за високої температури і високого тиску водень і аміак руйнують сталь. Яке інженерне рішення дає змогу захистити колону від хімічного руйнування?
18. Який об'єм водню (н. у.) необхідний для виробництва аміаку масою 5 т, якщо вихід аміаку завдяки використанню циркуляції становить 95 %?
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Вислано читачами з інтернет-сайтів
Гідроген хлорид. Хлоридна кислота. Хлориди
Гідроген хлорид. Гідроген хлорид, або хлороводень, НС1 є однією з найважливіших неорганічних сполук. Він слугує реагентом у різних процесах у хімічній технології. Водний розчин хлороводню — хлоридну кислоту — широко використовують у промисловості, наукових дослідженнях, хімічних лабораторіях.
Гідроген хлорид, як і інші аналогічні сполуки неметалічних елементів, має молекулярну будову. Електронна і графічна формули молекули хлороводню:

Ковалентний зв'язок між атомами Гідрогену і Хлору є полярним; атом більш електронегативного Хлору зміщує у свій бік спільну електронну пару: 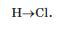
На атомі Хлору зосереджується невеликий негативний заряд, а на атомі Гідрогену — такий самий за значенням, але позитивний заряд:
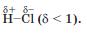
Молекула гідроген хлориду є полярною.
Хлороводень — безбарвний газ із різким запахом, важчий за повітря, добре розчинний у воді. За температури 20 °С і нормального тиску в 1 л води розчиняється 445 л цього газу. У вологому повітрі гідроген хлорид «димить» унаслідок утворення дрібних краплинок його водного розчину.
Хлороводень сильно подразнює дихальні шляхи. Тому досліди із цим газом та його концентрованим водним розчином (концентрованою хлоридною кислотою) проводять у витяжній шафі.
Хлоридна кислота. Водний розчин гідроген хлориду називають хлоридною кислотою. Тривіальна назва цього розчину — соляна кислота. Вона зумовлена тим, що раніше для добування кислоти використовували природну сіль (натрій хлорид).
Для підтвердження високої розчинності хлороводню у воді й кислотних властивостей водного розчину цієї сполуки демонструють ефектний дослід. У посудину з водою добавляють кілька крапель розчину лакмусу або метилоранжу. Хлороводнем наповнюють колбу, добавляють у неї 1—2 краплі води, швидко закривають пробкою, в яку вставлена скляна трубка, і занурюють кінець трубки в розчин індикатора у посудині (мал. 21). Під час розчинення газу тиск у колбі знижується; рідина заповнює колбу, створюючи фонтан, і набуває червоного забарвлення.
Майже насичений водний розчин гідроген хлориду (масова частка НС1 у ньому становить 34—36 %) називають концентрованою хлоридною кислотою. Із цього розчину постійно виділяється хлороводень.
Хлоридна кислота належить до сильних кислот; ступінь її дисоціації в розбавлених розчинах перевищує 90 %.

Поясніть, чому і як молекула НС1 розпадається на йони у водному розчині.
Хімічні властивості. Хлоридна кислота, як і інші кислоти, реагує:
• з металами з виділенням водню
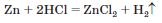 (метали, розміщені в ряду активності справа від водню, із хлоридною кислотою не взаємодіють); (метали, розміщені в ряду активності справа від водню, із хлоридною кислотою не взаємодіють);
• з основними й амфотерними оксидами
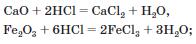
• з основами й амфотерними гідроксидами
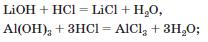
• із більшістю солей
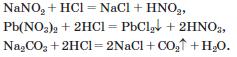
Для трьох останніх реакцій складіть йонно-молекулярні рівняння.
Добування гідроген хлориду і хлоридної кислоти. У промисловості гідроген хлорид добувають спалюванням водню в атмосфері хлору (мал. 22)

Н2 + С12 = 2НС1, а в лабораторії — за реакцією обміну між твердою сіллю (натрій хлоридом) і концентрованою сульфатною кислотою:
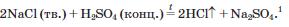
Таким способом раніше добували хлороводень і в промисловості.
Чи можна замість твердої солі використати її водний розчин, а замість концентрованої кислоти — розбавлену? Відповідь аргументуйте.
Хлороводень розчиняють у воді й отримують хлоридну кислоту.
Прилад для добування гідроген хлориду і хлоридної кислоти в лабораторії зображено на малюнку 23. Хлороводень, будучи важчим за повітря, витісняє його зі склянки і розчиняється у воді. Зверніть увагу: вільний кінець газовідвідної трубки не повинен торкатися води. Інакше вода внаслідок швидкого розчинення в ній гідроген хлориду потрапить у трубку, а відтак — у концентровану сульфатну кислоту. Відбудеться сильне розігрівання, пробірка може тріснути, а кислота — потрапити на шкіру і спричинити опіки.

П.П. Попель, Л.С. Крикля. Хімія, 10 клас
Надіслано читачами інтернет-сайту
Матеріали з хімії, плануванняз хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|