|
|
|
| Строка 5: |
Строка 5: |
| | <metakeywords>Физика, 10 класс, Внутренняя энергия</metakeywords> | | <metakeywords>Физика, 10 класс, Внутренняя энергия</metakeywords> |
| | | | |
| - | Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В ее основе лежит понятие ''внутренняя энергия''. С него мы и начнем. Предварительно остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-кинетической теорией.<br> '''Термодинамика и статистическая механика.''' Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика. Она возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание.<br> Сейчас в науке и технике при изучении тепловых явлений используются как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют ''статистической механикой''. Термодинамика и статистическая механика изучают различными методами одни и те же явления и взаимно дополняют друг друга.<br> ''Главное содержание термодинамики состоит в двух основных ее законах, касающихся поведения энергии.'' Эти законы установлены опытным путем. Они справедливы для всех веществ независимо от их внутреннего строения.<br> Статистическая механика более глубокая и точная наука, чем термодинамика, но и более сложная. К ней прибегают в тех случаях, когда простые соотношения термодинамики оказываются недостаточными для объяснения наблюдаемых явлений.<br> '''Внутренняя энергия в молекулярно-кинетической теории.''' В середине XIX в. было доказано, что наряду с механической энергией макроскопические тела обладают еще и энергией, заключенной внутри самих тел. Эта ''внутренняя энергия'' входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован ''закон сохранения и превращения энергии''.<br> Что такое внутренняя энергия?<br> Когда скользящая по льду шайба останавливается под действием силы трения, то ее механическая (кинетическая) энергия не просто исчезает, а передается беспорядочно движущимся молекулам льда и шайбы. Неровности поверхностей трущихся тел деформируются при движении, и интенсивность беспорядочного движения молекул возрастает. Оба тела нагреваются, что и означает увеличение их внутренней энергии.<br> Нетрудно наблюдать и обратный переход внутренней энергии в механическую. Если нагревать воду в пробирке, закрытой пробкой, то внутренняя энергия воды и внутренняя энергия пара начнут возрастать. Давление пара увеличится настолько, что пробка будет выбита. Кинетическая энергия пробки увеличится за счет внутренней энергии пара. Расширяясь, водяной пар совершает работу и охлаждается. Его внутренняя энергия при этом уменьшается.<br> С точки зрения молекулярно-кинетической теории '''внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).'''<br> Вычислить внутреннюю энергию тела (или ее изменение), учитывая движение отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или ее изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить.<br> '''Внутренняя энергия идеального одноатомного газа.''' Наиболее прост по своим свойствам одноатомный газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы - гелий, неон, аргон и др. Вычислим внутреннюю энергию идеального одноатомного газа.<br> Так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул.<br> Для вычисления внутренней энергии идеального одноатомного газа массой ''m'' нужно умножить среднюю кинетическую энергию одного атома на число атомов . Учитывая, что ''kN<sub>A</sub>=R'', получим формулу для внутренней энергии идеального газа:<br>[[Image:A75-1.jpg|center|215x48px]] '''Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре.'''<br> Она не зависит от объема и других макроскопических параметров системы.<br> Изменение внутренней энергии идеального газа равно [[Image:A75-2.jpg|170x30px]], т.е. определяется температурами начального и конечного состояний газа и не зависит от процесса.<br> Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между ''U'' и ''T'' другой. Объясняется это тем, что сложные молекулы не только ''движутся поступательно, но и вращаются''. Внутренняя энергия таких газов равна сумме энергий поступательного и вращательного движений молекул.<br> '''Зависимость внутренней энергии от макроскопических параметров.''' Мы установили, что внутренняя энергия идеального газа зависит от одного параметра - температуры. От объема внутренняя энергия идеального газа не зависит потому, что потенциальная энергия взаимодействия его молекул равна нулю.<br> У реальных газов, жидкостей и твердых тел средняя потенциальная энергия взаимодействия молекул ''не равна нулю''. Правда, для газов она много меньше средней кинетической энергии молекул, но для твердых и жидких тел сравнима с ней.<br> Средняя потенциальная энергия взаимодействия молекул газа зависит от объема вещества, так как при изменении объема меняется среднее расстояние между молекулами. Следовательно, ''внутренняя энергия реального газа в термодинамике в общем случае зависит, наряду с температурой T, и от объема V.''<br> Значения макроскопических параметров (температуры ''T'', объема ''V'' и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел.<br> Внутренняя энергия ''U'' макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объемом.<br> В основе термодинамики лежит понятие внутренней энергии. Эта энергия зависит от макроскопических параметров: температуры и объема.<br> Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.<br><br><br> ???<br> 1. Приведите примеры превращения механической энергии во внутреннюю и обратно в технике и быту.<br> 2. От каких физических величин зависит внутренняя энергия тела?<br> 3. Чему равна внутренняя энергия идеального одноатомного газа?<br>
| + | Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В ее основе лежит понятие ''внутренняя энергия''. С него мы и начнем. Предварительно остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-[[Идеальный_газ_в_молекулярно-кинетической_теории|кинетической]] теорией.<br> '''Термодинамика и статистическая механика.''' Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика. Она возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание.<br> Сейчас в науке и [[Давление_в_природе_и_технике|технике]] при изучении тепловых явлений используются как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют ''статистической механикой''. Термодинамика и статистическая механика изучают различными методами одни и те же явления и взаимно дополняют друг друга.<br> ''Главное содержание термодинамики состоит в двух основных ее законах, касающихся поведения энергии.'' Эти законы установлены опытным путем. Они справедливы для всех веществ независимо от их внутреннего строения.<br> Статистическая механика более глубокая и точная наука, чем термодинамика, но и более сложная. К ней прибегают в тех случаях, когда простые соотношения термодинамики оказываются недостаточными для объяснения наблюдаемых явлений.<br> '''Внутренняя энергия в молекулярно-кинетической теории.''' В середине XIX в. было доказано, что наряду с механической энергией макроскопические тела обладают еще и энергией, заключенной внутри самих тел. Эта ''внутренняя энергия'' входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован ''закон сохранения и превращения энергии''.<br> Что такое внутренняя [[Кинетическая_энергия_и_ее_изменение|энергия]]?<br> Когда скользящая по льду шайба останавливается под действием силы трения, то ее механическая (кинетическая) энергия не просто исчезает, а передается беспорядочно движущимся молекулам льда и шайбы. Неровности поверхностей трущихся тел деформируются при движении, и интенсивность беспорядочного движения молекул возрастает. Оба тела нагреваются, что и означает увеличение их внутренней энергии.<br> Нетрудно наблюдать и обратный переход внутренней энергии в механическую. Если нагревать воду в пробирке, закрытой пробкой, то внутренняя энергия воды и внутренняя энергия пара начнут возрастать. Давление пара увеличится настолько, что пробка будет выбита. Кинетическая энергия пробки увеличится за счет внутренней энергии пара. Расширяясь, водяной пар совершает работу и охлаждается. Его внутренняя энергия при этом уменьшается.<br> С точки зрения молекулярно-кинетической теории '''внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).'''<br> Вычислить внутреннюю энергию тела (или ее изменение), учитывая [[Броуновское_движение|движение]] отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или ее изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить.<br> '''Внутренняя энергия идеального одноатомного газа.''' Наиболее прост по своим свойствам одноатомный газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы - гелий, неон, аргон и др. Вычислим внутреннюю энергию идеального одноатомного газа.<br> Так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул.<br> Для вычисления внутренней энергии идеального одноатомного газа массой ''m'' нужно умножить среднюю кинетическую энергию одного атома на число атомов . Учитывая, что ''kN<sub>A</sub>=R'', получим формулу для внутренней энергии идеального газа:<br>[[Image:A75-1.jpg|center|215x48px|Внутренняя энергия]] '''Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной [[Определение_температуры|температуре]].'''<br> Она не зависит от объема и других макроскопических параметров системы.<br> Изменение внутренней энергии идеального газа равно [[Image:A75-2.jpg|170x30px|Внутренняя энергия]], т.е. определяется температурами начального и конечного состояний газа и не зависит от процесса.<br> Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между ''U'' и ''T'' другой. Объясняется это тем, что сложные молекулы не только ''движутся поступательно, но и вращаются''. Внутренняя энергия таких газов равна сумме энергий поступательного и вращательного движений молекул.<br> '''Зависимость внутренней энергии от макроскопических параметров.''' Мы установили, что внутренняя энергия идеального газа зависит от одного параметра - температуры. От объема внутренняя энергия идеального газа не зависит потому, что потенциальная энергия взаимодействия его молекул равна нулю.<br> У реальных газов, жидкостей и твердых тел средняя потенциальная энергия взаимодействия молекул ''не равна нулю''. Правда, для газов она много меньше средней кинетической энергии молекул, но для твердых и жидких тел сравнима с ней.<br> Средняя потенциальная энергия взаимодействия молекул газа зависит от объема вещества, так как при изменении объема меняется среднее расстояние между [[Определение_температуры|молекулами]]. Следовательно, ''внутренняя энергия реального газа в термодинамике в общем случае зависит, наряду с температурой T, и от объема V.''<br> Значения макроскопических параметров (температуры ''T'', объема ''V'' и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел.<br> Внутренняя энергия ''U'' макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объемом.<br> В основе термодинамики лежит понятие внутренней энергии. Эта энергия зависит от макроскопических параметров: температуры и объема.<br> Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.<br><br><br> ???<br> 1. Приведите примеры превращения [[Уменьшение_механической_энергии_системы_под_действием_сил_трения|механической]] энергии во внутреннюю и обратно в технике и быту.<br> 2. От каких физических величин зависит внутренняя энергия тела?<br> 3. Чему равна внутренняя энергия идеального одноатомного газа?<br> |
| | | | |
| | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' | | <br> ''Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс'' |
| Строка 12: |
Строка 12: |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентация урока |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| | | | |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | '''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Версия 11:40, 5 июля 2012
Гипермаркет знаний>>Физика и астрономия>>Физика 10 класс>>Физика: Внутренняя энергия
Термодинамика была создана в середине XIX в. после открытия закона сохранения энергии. В ее основе лежит понятие внутренняя энергия. С него мы и начнем. Предварительно остановимся на вопросе о том, какая связь существует между термодинамикой и молекулярно-кинетической теорией.
Термодинамика и статистическая механика. Первой научной теорией тепловых процессов была не молекулярно-кинетическая теория, а термодинамика. Она возникла при изучении оптимальных условий использования теплоты для совершения работы. Это произошло в середине XIX в., задолго до того, как молекулярно-кинетическая теория получила всеобщее признание.
Сейчас в науке и технике при изучении тепловых явлений используются как термодинамика, так и молекулярно-кинетическая теория. В теоретической физике молекулярно-кинетическую теорию называют статистической механикой. Термодинамика и статистическая механика изучают различными методами одни и те же явления и взаимно дополняют друг друга.
Главное содержание термодинамики состоит в двух основных ее законах, касающихся поведения энергии. Эти законы установлены опытным путем. Они справедливы для всех веществ независимо от их внутреннего строения.
Статистическая механика более глубокая и точная наука, чем термодинамика, но и более сложная. К ней прибегают в тех случаях, когда простые соотношения термодинамики оказываются недостаточными для объяснения наблюдаемых явлений.
Внутренняя энергия в молекулярно-кинетической теории. В середине XIX в. было доказано, что наряду с механической энергией макроскопические тела обладают еще и энергией, заключенной внутри самих тел. Эта внутренняя энергия входит в баланс энергетических превращений в природе. После открытия внутренней энергии был сформулирован закон сохранения и превращения энергии.
Что такое внутренняя энергия?
Когда скользящая по льду шайба останавливается под действием силы трения, то ее механическая (кинетическая) энергия не просто исчезает, а передается беспорядочно движущимся молекулам льда и шайбы. Неровности поверхностей трущихся тел деформируются при движении, и интенсивность беспорядочного движения молекул возрастает. Оба тела нагреваются, что и означает увеличение их внутренней энергии.
Нетрудно наблюдать и обратный переход внутренней энергии в механическую. Если нагревать воду в пробирке, закрытой пробкой, то внутренняя энергия воды и внутренняя энергия пара начнут возрастать. Давление пара увеличится настолько, что пробка будет выбита. Кинетическая энергия пробки увеличится за счет внутренней энергии пара. Расширяясь, водяной пар совершает работу и охлаждается. Его внутренняя энергия при этом уменьшается.
С точки зрения молекулярно-кинетической теории внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
Вычислить внутреннюю энергию тела (или ее изменение), учитывая движение отдельных молекул и их положения относительно друг друга, практически невозможно из-за огромного числа молекул в макроскопических телах. Поэтому необходимо уметь определять значение внутренней энергии (или ее изменение) в зависимости от макроскопических параметров, которые можно непосредственно измерить.
Внутренняя энергия идеального одноатомного газа. Наиболее прост по своим свойствам одноатомный газ, состоящий из отдельных атомов, а не молекул. Одноатомными являются инертные газы - гелий, неон, аргон и др. Вычислим внутреннюю энергию идеального одноатомного газа.
Так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул.
Для вычисления внутренней энергии идеального одноатомного газа массой m нужно умножить среднюю кинетическую энергию одного атома на число атомов . Учитывая, что kNA=R, получим формулу для внутренней энергии идеального газа:
Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре.
Она не зависит от объема и других макроскопических параметров системы.
Изменение внутренней энергии идеального газа равно 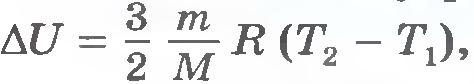 , т.е. определяется температурами начального и конечного состояний газа и не зависит от процесса. , т.е. определяется температурами начального и конечного состояний газа и не зависит от процесса.
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия также пропорциональна абсолютной температуре, но коэффициент пропорциональности между U и T другой. Объясняется это тем, что сложные молекулы не только движутся поступательно, но и вращаются. Внутренняя энергия таких газов равна сумме энергий поступательного и вращательного движений молекул.
Зависимость внутренней энергии от макроскопических параметров. Мы установили, что внутренняя энергия идеального газа зависит от одного параметра - температуры. От объема внутренняя энергия идеального газа не зависит потому, что потенциальная энергия взаимодействия его молекул равна нулю.
У реальных газов, жидкостей и твердых тел средняя потенциальная энергия взаимодействия молекул не равна нулю. Правда, для газов она много меньше средней кинетической энергии молекул, но для твердых и жидких тел сравнима с ней.
Средняя потенциальная энергия взаимодействия молекул газа зависит от объема вещества, так как при изменении объема меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия реального газа в термодинамике в общем случае зависит, наряду с температурой T, и от объема V.
Значения макроскопических параметров (температуры T, объема V и др.) однозначно определяют состояние тел. Поэтому они определяют и внутреннюю энергию макроскопических тел.
Внутренняя энергия U макроскопических тел однозначно определяется параметрами, характеризующими состояние этих тел: температурой и объемом.
В основе термодинамики лежит понятие внутренней энергии. Эта энергия зависит от макроскопических параметров: температуры и объема.
Внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре.
???
1. Приведите примеры превращения механической энергии во внутреннюю и обратно в технике и быту.
2. От каких физических величин зависит внутренняя энергия тела?
3. Чему равна внутренняя энергия идеального одноатомного газа?
Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский, Физика 10 класс
Материалы по физике, задание и ответы по классам, планы конспектов уроков по физике для 10 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|










