|
|
|
| (6 промежуточных версий не показаны.) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Хімія: Вода як розчинник. Будова молекули води, поняття про водневий зв’язок''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Вода як розчинник. Будова молекули води, поняття про водневий зв’язок''' |
| | | | |
| - | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Вода як розчинник, Будова молекули води, поняття про водневий зв’язок.</metakeywords>ВОДА ЯК РОЗЧИННИК. БУДОВА МОЛЕКУЛИ ВОДИ, ПОНЯТТЯ ПРО ВОДНЕВИЙ ЗВ'ЯЗОК
| + | <metakeywords>Хімія, клас, урок, на тему, 9 клас, Вода як розчинник, Будова молекули води, поняття про водневий зв’язок.</metakeywords> |
| | + | |
| | + | |
| | + | |
| | + | ВОДА ЯК РОЗЧИННИК. БУДОВА МОЛЕКУЛИ ВОДИ, ПОНЯТТЯ ПРО ВОДНЕВИЙ ЗВ'ЯЗОК |
| | | | |
| | <br> | | <br> |
| | | | |
| - | <u>Розчин і його компоненти. Вода як розчинник, будова молекули води. Поняття про водневий зв'язок</u><br>
| + | '''Розчин і його компоненти. Вода як розчинник, будова молекули води. Поняття про водневий зв'язок'''<br> |
| | + | |
| | + | ''• [[Значення_розчинів_у_природі_та_житті_людини._Поняття_про_дисперсні_системи,_колоїдні_та_істинні_розчини._Насичені_й_ненасичені_розчини|Розчин]] і його компоненти'' деякою мірою знайомі вам з курсу природознавства. З попереднього параграфа ви дізналися, що розчин – однофазна гомогенна система, яка складається з двох або більше компонентів.<br> |
| | + | |
| | + | Характерна ознака істинних розчинів – гомогенність. У істинних розчинах навіть за допомогою ультрамікроскопа не можна побачити окремих частинок їхніх складових.<br> |
| | + | |
| | + | '''Завдання'''<br> |
| | + | |
| | + | ''Поясніть, чому частинки дисперсної фази колоїдних розчинів можна досліджувати методом ультрамікроскопії, а частинки компонентів істинних розчинів – ні (за потреби зверніться до малюнка 3.2).<br>'' |
| | + | |
| | + | Схарактеризуймо докладніше компоненти розчинів. Вам уже відомо, що розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники – рідини. Наприклад, дуже розповсюджені у природі водні розчини речовин. |
| | + | |
| | + | '''Завдання''' |
| | + | |
| | + | ''Наведіть кілька прикладів рідких розчинів, які трапляються у природі.'' |
| | + | |
| | + | Рідкі розчини використовують у техніці, на виробництві, у [[Відео_до_уроку_на_тему:_Світове_сільське_господарство:_значення,_внутрішньогалузева_структура,_міжгалузеві_зв'язки,_аграрні_відносини|сільському господарстві]], лабораторних дослідженнях, фармації, медицині і повсякденному житті. Тож з’ясуймо ознаки класифікації розчинів, навчімось розрізняти їхні компоненти. |
| | + | |
| | + | Розчин утворений не менш ніж двома компонентами, один з яких – розчинник, а інші розчинені в ньому. Наприклад, у столовому оцті вода – розчинник, а оцтова кислота – розчинена речовина. |
| | | | |
| - | Після опрацювання § 4 ви зможете:<br>
| + | Зазвичай розчинником уважають той компонент, який у чистому вигляді існує у тому самому агрегатному стані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Запам'ятайте, воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини. |
| | | | |
| - | розрізняти компоненти розчину; пояснювати утворення водневого зв’язку.<br>
| + | ''• [[Вода_-_найпоширеніша_речовина_на_Землі._Повні_уроки|Вода]] як розчинник'' має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води (мал. 4.1). Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. З курсу хімії 8-го класу ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем? |
| | | | |
| - | На шляху до успіху пригадаємо з вивчених курсів природознавства, хімії, фізики:<br>що таке розчин; які особливості молекулярних та йонних кристалів; у який спосіб утворюються ковалентні полярні зв’язки; які властивості має вода у різних агрегатних станах; що таке температура кипіння; як відбувається електростатична взаємодія; де трапляються розчини у природі та побуті;<br>шукатимемо відповіді на запитання:<br>яка характерна ознака істинних розчинів? З чого складається розчин? Чим зумовлені унікальні властивості води? Яке значення мають водневі зв’язки?<br>
| + | [[Image:29 chemistry.jpg|Будова молекули води. фото]] |
| | | | |
| - | • Розчин і його компоненти деякою мірою знайомі вам з курсу природознавства. З попереднього параграфа ви дізналися, що розчин – однофазна гомогенна система, яка складається з двох або більше компонентів.<br>
| + | ''Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною (мал. 4.2).'' |
| | | | |
| - | Характерна ознака істинних розчинів – гомогенність. У істинних розчинах навіть за допомогою ультрамікроскопа не можна побачити окремих частинок їхніх складових.<br>
| + | Зверніть увагу: [[Атоми,_молекули,_йони._Хімічні_елементи,_їхні_назви_і_символи|молекули]], утворені [[Атоми_і_хімічні_елементи._Перевір_себе|атомами]] різних [[Атоми_і_хімічні_елементи._Перевір_себе|хімічних елементів]], можуть, залежно від геометричної форми, бути полярними й неполярними. Якщо форма асиметрична (через наявність неподілених електронних гір або неспарених електронів), то молекула полярна (мал. 4.2,2). Якщо ж зміщення електронної густини симетричне, то молекула неполярна жал. 4.2,3). |
| | | | |
| - | <u>''Завдання''</u><br>
| + | [[Image:29 1 chemistry.jpg|Диполь. фото]] |
| | | | |
| - | Поясніть, чому частинки дисперсної фази колоїдних розчинів можна досліджувати методом ультрамікроскопії, а частинки компонентів істинних розчинів – ні ( за потреби зверніться до малюнка 3.2).<br>
| + | За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям (мал. 4.3). |
| | | | |
| - | Схарактеризуймо докладніше компоненти розчинів. Вам уже відомо, що розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники – рідини. Наприклад, дуже розповсюджені у природі водні розчини речовин.
| + | Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником. |
| | | | |
| - | <u>''Завдання''</u>
| + | [[Image:30 chemistry.jpg|Молекули води та водневі зв'язки між ними. фото]] |
| | | | |
| - | Наведіть кілька прикладів рідких розчинів, які трапляються у природі.
| + | Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків (мал. 4.4). З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води. |
| | | | |
| - | Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті. Тож з’ясуймо ознаки класифікації розчинів, навчімось розрізняти їхні компоненти.
| + | Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду (мал. 4.5). |
| | | | |
| - | Розчин утворений не менш ніж двома компонентами, один з яких – розчинник, а інші розчинені в ньому. Наприклад, у столовому оцті вода – розчинник, а оцтова кислота – розчинена речовина.
| + | [[Image:30 1 chemistry.jpg|Водневі зв'язки. фото]] |
| | | | |
| - | Зазвичай розчинником уважають той компонент, який у чистому вигляді існує у тому самому агрегатному стані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Запам'ятайте, воду традиційно -намають розчинником навіть тоді, коли її маса значно менша за масу зозчиненої речовини.
| + | '''Завдання''' |
| | | | |
| - | • Вода як розчинник має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води (мал. 4.1). Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. З курсу хімії 8-го класу ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем?
| + | Роздивіться фрагменти (1) і (2) малюнка 4.5 і висловіть припущення щодо причин наявності у будь-якої сніжинки саме шести променів. |
| | | | |
| - | Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною (мал. 4.2).
| + | Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм. |
| | | | |
| - | Зверніть увагу: молекули, утворені атомами різних хімічних елементів, можуть, залежно від геометричної форми, бути полярними й неполярними. Якщо форма асиметрична (через наявність неподілених електронних гір або неспарених електронів), то молекула полярна (мал. 4.2,2). Якщо ж зміщення електронної густини симетричне, то молекула неполярна жал. 4.2,3).
| + | Під час подальшого вивчення хімії та біології ви дізнаєтеся, що утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Вони можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків. |
| | | | |
| - | За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям (мал. 4.3).
| + | Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. Докладніше про це ви дізнаєтеся з наступного параграфа. |
| | | | |
| - | Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником.
| + | '''Цікаво?''' |
| | | | |
| - | Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків (мал. 4.4). З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води.<br>Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду (мал. 4.5).
| + | Більшість обрядових дій українців відбувалися біля води, бо ототожнювалися з водною стихією: купальські обряди, русалії й Водохреще, обливання та зорожіння на мосту, біля криниці чи ополонки. Водна магія та культ води лежали в основі багатьох вірувань та повір'їв, утілюючись у колоритних демонологічних обрядах, що стали етнічними символами духовної культури українців, - у образах русалки, нявки, водяника тощо. |
| | | | |
| - | <u>''Завдання''</u>
| + | '''Стисло про головне''' |
| | | | |
| - | Роздивіться фрагменти (1) і (2) малюнка 4.5 і висловіть припущення щодо причин наявності у будь-якої сніжинки саме шести променів.
| + | Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники - рідини. Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті. |
| | | | |
| - | Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм.
| + | Розчин утворений не менш ніж двома компонентами, один з яких - розчинник, а інші розчинені в ньому. Зазвичай розчинником вважають той компонент, який у чистому вигляді існує у тому самому агрегатному сгані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини. |
| | | | |
| - | Під час подальшого вивчення хімії та біології ви дізнаєтеся, що утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Вони можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків.
| + | Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені хімічним складом і будовою молекули цієі сполуки. Утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. |
| | | | |
| - | Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. Докладніше про це ви дізнаєтеся з наступного параграфа.
| + | Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною |
| | | | |
| - | <u>''Цікаво?''</u>
| + | На поверхні речовин, занурених у воду, міжатомні й міжмолекулярні сили під впливом диполів води слабшають у 80 разів. Цим пояснюють здатність води бути універсальним розчинником. |
| | | | |
| - | Більшість обрядових дій українців відбувалися біля води, бо ототожнювалися з водною стихією: купальські обряди, русалії й Водохреще, обливання та зорожіння на мосту, біля криниці чи ополонки. Водна магія та культ води лежали в основі багатьох вірувань та повір'їв, утілюючись у колоритних демонологічних обрядах, що стали етнічними символами духовної культури українців, - у образах русалки, нявки, водяника тощо.
| + | Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі температури кипіння і плавлення води. |
| | | | |
| - | <u>''Стисло про головне''</u>
| + | Окрім води, утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Водневі зв'язки можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків. |
| | | | |
| - | Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники - рідини. Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті.
| + | Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. |
| | | | |
| - | Розчин утворений не менш ніж двома компонентами, один з яких - розчинник, а інші розчинені в ньому. Зазвичай розчинником вважають той компонент, який у чистому вигляді існує у тому самому агрегатному сгані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини.
| + | '''Застосуйте свої знання і уміння'''<u></u> |
| | | | |
| - | Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені хімічним складом і будовою молекули цієі сполуки. Утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя.
| + | ''1. Наведіть визначення розчину.'' |
| | | | |
| - | Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною
| + | ''2. Назвіть характерну ознаку істинних розчинів.'' |
| | | | |
| - | На поверхні речовин, занурених у воду, міжатомні й міжмолекулярні сили під впливом диполів води слабшають у 80 разів. Цим пояснюють здатність води бути універсальним розчинником.
| + | ''3. Наведіть кілька прикладів твердих розчинів, які використовують у побуті.'' |
| | | | |
| - | Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі температури кипіння і плавлення води.
| + | ''4. Схарактеризуйте будову молекули води.'' |
| | | | |
| - | Окрім води, утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Водневі зв'язки можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків.
| + | ''5. Доповніть речення. Істинний розчин є системою:<br>А Гомогенною; Б Гетерогенною; В Однокомпонентною; Г Багатокомпонентною; Д Однофазною; Е Двохфазною; Ж Грубодисперсною; 3 Колоїдною.'' |
| | | | |
| - | Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин.
| + | ''6. Виберіть розчини:<br>А Дощова вода; Б Столовий оцет; В Молоко; Г Хлоридна кислота.'' |
| | | | |
| - | <u>''Застосуйте свої знання і уміння''</u><br>1. Наведіть визначення розчину.<br>2. Назвіть характерну ознаку істинних розчинів.<br>3. Наведіть кілька прикладів твердих розчинів, які використовують у побуті.<br>4. Схарактеризуйте будову молекули води.<br>5. Доповніть речення. Істинний розчин є системою:<br>А Гомогенною; Б Гетерогенною; В Однокомпонентною; Г Багатокомпонентною; Д Однофазною; Е Двохфазною; Ж Грубодисперсною; 3 Колоїдною.<br>6. Виберіть розчини:<br>А Дощова вода; Б Столовий оцет; В Молоко; Г Хлоридна кислота.<br>7. Виберіть усі правильні твердження:<br>А Молекула води полярна; Б Молекула води неполярна; В Молекула води є диполем; Г Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні полярні; Д Зв'язки О-Н у молекулі води йонні; Е Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні неполярні.<br>'''''<br>'''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів''
| + | ''7. Виберіть усі правильні твердження:<br>А Молекула води полярна; Б Молекула води неполярна; В Молекула води є диполем; Г Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні полярні; Д Зв'язки О-Н у молекулі води йонні; Е Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні неполярні.''<br>'''''<br>'''Г. А. Лашевська, [[Хімія_9_клас|Хімія, 9 клас]]<br>Вислано читачами з інтернет-сайтів'' |
| | | | |
| - | <br> <sub>Планування з хімії, підручники та книги онлайн, курси та завдання з хімії для 9 класу</sub> <br> | + | <br> <sub>Планування [[Хімія|з хімії]], [[Гіпермаркет Знань - перший в світі!|підручники]] та книги онлайн, курси та завдання [[Хімія 9 клас|з хімії для 9 класу]]</sub> <br> |
| | | | |
| | <br> | | <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%92%D0%BE%D0%B4%D0%B0_%D1%8F%D0%BA_%D1%80%D0%BE%D0%B7%D1%87%D0%B8%D0%BD%D0%BD%D0%B8%D0%BA._%D0%91%D1%83%D0%B4%D0%BE%D0%B2%D0%B0_%D0%BC%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B8_%D0%B2%D0%BE%D0%B4%D0%B8,_%D0%BF%D0%BE%D0%BD%D1%8F%D1%82%D1%82%D1%8F_%D0%BF%D1%80%D0%BE_%D0%B2%D0%BE%D0%B4%D0%BD%D0%B5%D0%B2%D0%B8%D0%B9_%D0%B7%D0%B2%E2%80%99%D1%8F%D0%B7%D0%BE%D0%BA._%D0%A0%D0%B5%D1%84%D0%B5%D1%80%D0%B0%D1%82%D0%B8 реферати] |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br> Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| | | | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Текущая версия на 09:34, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Вода як розчинник. Будова молекули води, поняття про водневий зв’язок
ВОДА ЯК РОЗЧИННИК. БУДОВА МОЛЕКУЛИ ВОДИ, ПОНЯТТЯ ПРО ВОДНЕВИЙ ЗВ'ЯЗОК
Розчин і його компоненти. Вода як розчинник, будова молекули води. Поняття про водневий зв'язок
• Розчин і його компоненти деякою мірою знайомі вам з курсу природознавства. З попереднього параграфа ви дізналися, що розчин – однофазна гомогенна система, яка складається з двох або більше компонентів.
Характерна ознака істинних розчинів – гомогенність. У істинних розчинах навіть за допомогою ультрамікроскопа не можна побачити окремих частинок їхніх складових.
Завдання
Поясніть, чому частинки дисперсної фази колоїдних розчинів можна досліджувати методом ультрамікроскопії, а частинки компонентів істинних розчинів – ні (за потреби зверніться до малюнка 3.2).
Схарактеризуймо докладніше компоненти розчинів. Вам уже відомо, що розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники – рідини. Наприклад, дуже розповсюджені у природі водні розчини речовин.
Завдання
Наведіть кілька прикладів рідких розчинів, які трапляються у природі.
Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті. Тож з’ясуймо ознаки класифікації розчинів, навчімось розрізняти їхні компоненти.
Розчин утворений не менш ніж двома компонентами, один з яких – розчинник, а інші розчинені в ньому. Наприклад, у столовому оцті вода – розчинник, а оцтова кислота – розчинена речовина.
Зазвичай розчинником уважають той компонент, який у чистому вигляді існує у тому самому агрегатному стані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Запам'ятайте, воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини.
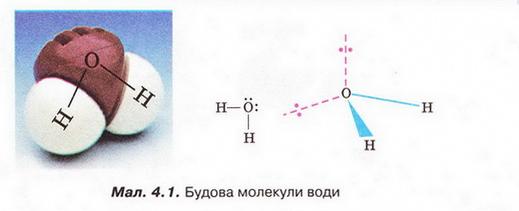
• Вода як розчинник має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води (мал. 4.1). Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. З курсу хімії 8-го класу ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем?
Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною (мал. 4.2).
Зверніть увагу: молекули, утворені атомами різних хімічних елементів, можуть, залежно від геометричної форми, бути полярними й неполярними. Якщо форма асиметрична (через наявність неподілених електронних гір або неспарених електронів), то молекула полярна (мал. 4.2,2). Якщо ж зміщення електронної густини симетричне, то молекула неполярна жал. 4.2,3).

За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям (мал. 4.3).
Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником.
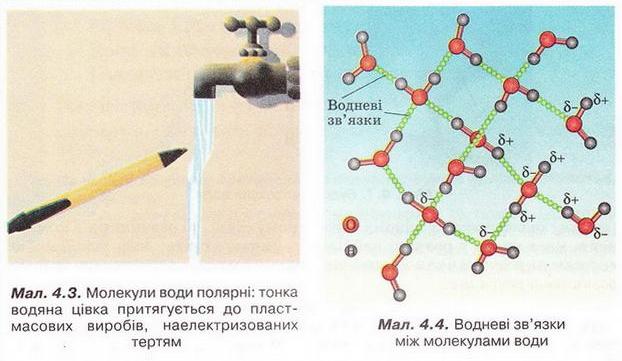
Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків (мал. 4.4). З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води.
Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду (мал. 4.5).
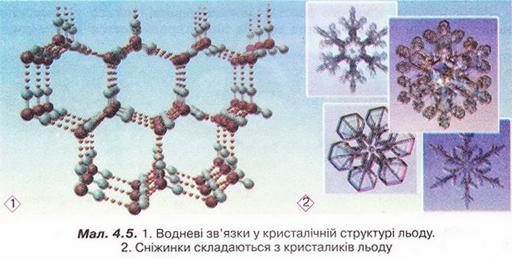
Завдання
Роздивіться фрагменти (1) і (2) малюнка 4.5 і висловіть припущення щодо причин наявності у будь-якої сніжинки саме шести променів.
Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм.
Під час подальшого вивчення хімії та біології ви дізнаєтеся, що утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Вони можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків.
Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин. Докладніше про це ви дізнаєтеся з наступного параграфа.
Цікаво?
Більшість обрядових дій українців відбувалися біля води, бо ототожнювалися з водною стихією: купальські обряди, русалії й Водохреще, обливання та зорожіння на мосту, біля криниці чи ополонки. Водна магія та культ води лежали в основі багатьох вірувань та повір'їв, утілюючись у колоритних демонологічних обрядах, що стали етнічними символами духовної культури українців, - у образах русалки, нявки, водяника тощо.
Стисло про головне
Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники - рідини. Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті.
Розчин утворений не менш ніж двома компонентами, один з яких - розчинник, а інші розчинені в ньому. Зазвичай розчинником вважають той компонент, який у чистому вигляді існує у тому самому агрегатному сгані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини.
Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені хімічним складом і будовою молекули цієі сполуки. Утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя.
Диполь - система з двох зарядів, протилежних за знаком і однакових за величиною
На поверхні речовин, занурених у воду, міжатомні й міжмолекулярні сили під впливом диполів води слабшають у 80 разів. Цим пояснюють здатність води бути універсальним розчинником.
Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі температури кипіння і плавлення води.
Окрім води, утворення водневих зв'язків притаманне й іншим речовинам - як неорганічним, так і органічним. Водневі зв'язки можуть утворюватися між молекулами різних речовин. Перебіг багатьох біологічних процесів й існування живих організмів можливі саме завдяки утворенню й руйнуванню водневих зв'язків.
Водневі зв'язки, так само як і електростатична взаємодія між диполями води та йонами у вузлах кристалічних ґраток, відіграють неабияку роль у процесі розчинення речовин.
Застосуйте свої знання і уміння
1. Наведіть визначення розчину.
2. Назвіть характерну ознаку істинних розчинів.
3. Наведіть кілька прикладів твердих розчинів, які використовують у побуті.
4. Схарактеризуйте будову молекули води.
5. Доповніть речення. Істинний розчин є системою:
А Гомогенною; Б Гетерогенною; В Однокомпонентною; Г Багатокомпонентною; Д Однофазною; Е Двохфазною; Ж Грубодисперсною; 3 Колоїдною.
6. Виберіть розчини:
А Дощова вода; Б Столовий оцет; В Молоко; Г Хлоридна кислота.
7. Виберіть усі правильні твердження:
А Молекула води полярна; Б Молекула води неполярна; В Молекула води є диполем; Г Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні полярні; Д Зв'язки О-Н у молекулі води йонні; Е Зв'язки між атомами Гідрогену й Оксигену в молекулі води ковалентні неполярні.
Г. А. Лашевська, Хімія, 9 клас
Вислано читачами з інтернет-сайтів
Планування з хімії, підручники та книги онлайн, курси та завдання з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|














