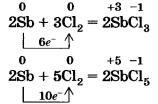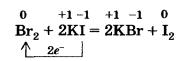|
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Галогены
Строение и свойства атомов. Элементы главной подгруппы VII группы Периодической системы, объединенные под общим названием галогены, фтор P, хлор Сl, бром Вr, иод I, астат Аt (редко встречающийся в природе) — типичные неметаллы. Это и понятно, ведь их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы этих элементов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли. Отсюда общее название «галогены», т. е. «рождающие соли».
Галогены — очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются от хлора к иоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у иода.
Галогены — простые вещества. Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалент-ной неполярной химической связью между атомами. В твердом состоянии Р2, С12, Вг2,12 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами (табл. 7).
Физические свойства галогенов Таблица 7
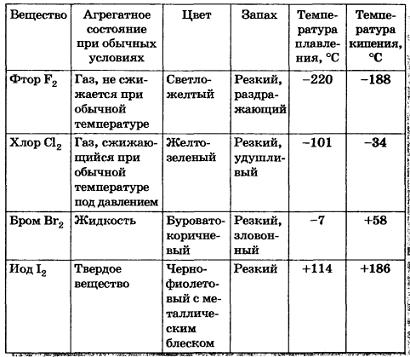
Как можно заметить, с увеличением молекулярной массы галогенов температуры плавления и кипения повышаются, возрастают плотности: бром — жидкость, иод — твердое вещество, фтор и хлор — газы. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
От F2 к I2 усиливается интенсивность окраски галогенов.
Химическая активность галогенов, как неметаллов, от фтора к иоду ослабевает, у кристаллов иода появляется металлический блеск.
Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом, как вы уже знаете, образуются соли (отсюда и название подгруппы). Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются.
Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы (рис. 17), образуя при этом смесь двух хлоридов сурьмы(ІІІ) и (V):
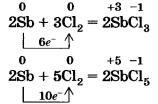
Нагретый порошок железа также загорается при взаимодействии с хлором. Опыт можно провести, как с сурьмой, но только железные опилки нужно предварительно накалить в железной ложечке, а затем высыпать их небольшими порциями в колбу с хлором. Так как хлор является сильным окислителем, то в результате реакции образуется хлорид железа(ІІІ).
В парах брома сгорает раскаленная медная проволока:

Реакция сопровождается выделением фиолетовых паров иода (почему?).
Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к иоду можно судить и по их способности вытеснять друг друга из растворов солей.
Так, хлор вытесняет бром и иод из растворов их солей.
Свободный бром вытесняет иод из солей:
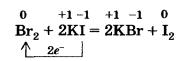
Для фтора эта реакция не характерна, так как она протекает в растворе, а фтор взаимодействует с водой, вытесняя из нее кислород.
Здесь кислород выступает в непривычной для себя роли восстановителя, это единственный, пожалуй, случай, когда кислород является не одним из исходных веществ, а продуктом горения.
Ослабление окислительных свойств галогенов от фтора к иоду наглядно проявляется при взаимодействии их с водородом. Уравнение этой реакции можно записать в общем виде так:
Н2 + Г2 = 2НГ
(Г — условное химическое обозначение галогенов).
Если фтор взаимодействует с водородом в любых условиях со взрывом, то смесь хлора с водородом реагирует со взрывом только при поджигании или облучении прямым солнечным светом, бром взаимодействует с водородом при нагревании и без взрыва. Эти реакции экзотермические. Реакция же соединения иода с водородом слабо эндотермическая, она протекает медленно даже при нагревании.
В результате этих реакций образуются соответственно фтороводород НF, хлороводород НСl, бромоводород НВr и иодово-дород НI.
Открытие галогенов.Фтор в свободном виде получил впервые в 1866 г. французский химик Анри Муассан, который был удостоен за это Нобелевской премии. Свое название элемент получил от греч. фторос — разрушающий.
Хлор открыт шведским химиком К. Шееле в 1774 г. Элемент получил название за свой цвет (греч. хлорос — желто-зеленый).
Карл Вильгельм Шееле
(1742-1786)

Шведский химик. В 1772 г. установил, что воздух состоит из кислорода и азота. Открыл и получил много неорганических и ор-; ганических веществ (кислород, хлор, фторо-водородную кислоту, глицерин и др.).
Бром открыт в 1826 г. французским химиком А. Баларом. Элемент назван так за свой запах (греч. бромос — зловонный).
Иод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс — фиолетовый).
1. Строение атомов галогенов и их степени окисления.
2. Физические свойства галогенов.
3. Химические свойства галогенов: взаимодействие с металлами, водородом, растворами солей.
4. Изменение окислительно-восстановительных свойств галогенов от фтора к иоду.
Рассчитайте, какую массу будет иметь 1 л фтора и хлора при н. у. Найдите их относительную плотность по водороду и воздуху.
Растворы хлора, брома и иода в воде соответственно называются хлорной, бромной и йодной водой. Почему нет фторной воды?
Проведите аналогию между реакциями щелочных металлов и галогенов с растворами солей.
Рассчитайте степени окисления атомов химических элементов в следующих соединениях: КСlO3 (бертолетова соль), НСlO (хлорноватистая кислота), НСlO4 (хлорная кислота). Напишите формулы оксидов, соответствующих кислотам.
Укажите, изменением каких условий можно сместить химическое равновесие процесса вправо:
H2 + I2 (гaз) <-> 2HI + Q
Рассмотрите зависимость скорости химической реакции от природы реагирующих веществ на примере взаимодействия галогенов с водородом.
Какой объем хлора (н. у.) потребуется для вытеснения всего иода из 300 г 15%-ного раствора иодида калия? Какое количество новой соли при этом образуется?
Какой объем хлороводорода образуется при взаимодействии 150 л хлора с 200 л водорода? Какой газ взят в избытке? Какой объем займет избыток этого газа?
Во многих странах фтор носит другое название — флюор, что в переводе с лат. означает «текучий». Найдите объяснение этому названию, используя химические словари и другую литературу.
анекдоты к уроку химии 9 класса, практикум к уроку химии, всё для учеников для подготовки домашнего задания
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|