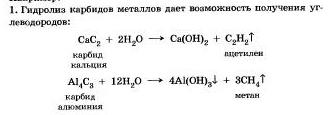|
|
|
| Строка 1: |
Строка 1: |
| | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 11 класс|Химия 11 класс]]>> Химия: Гидролиз<metakeywords>химия, 11 класс, класс, урок химии, на тему, урок на тему, урок для 11 класса, гидролиз</metakeywords>''' | | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 11 класс|Химия 11 класс]]>> Химия: Гидролиз<metakeywords>химия, 11 класс, класс, урок химии, на тему, урок на тему, урок для 11 класса, гидролиз</metakeywords>''' |
| | + | |
| | + | <h2>Определение гидролиза</h2> |
| | | | |
| | Вы знаєте, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro — вода, lysis — разложение, расиад). | | Вы знаєте, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro — вода, lysis — разложение, расиад). |
| Строка 9: |
Строка 11: |
| | <br>Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение. | | <br>Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение. |
| | | | |
| - | <br>''Гидролиз органических веществ''<br>1. Гидролиз галогеналканов используют дли получения спиртов.<br><br>Присутствие щелочи (ОН ) иоэволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования [[Спирты_(Химия_9_класс)|спирта]]. | + | <h2>Гидролиз органических веществ</h2> |
| | + | |
| | + | <h3>Гидролиз галогеналканов</h3> |
| | + | |
| | + | Гидролиз галогеналканов используют дли получения спиртов.<br><br>Присутствие щелочи (ОН ) иоэволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования [[Спирты_(Химия_9_класс)|спирта]]. |
| | + | |
| | + | <h3>Гидролиз сложных эфиров</h3> |
| | | | |
| - | <br>2. Гидролиз сложных зфнров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
| + | Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты. |
| | | | |
| - | <br>Для смещения химическое раоновесии в сторону продуктов реакции гидролиз проводят в присутствии щелочи. | + | <br>Для смещения химическое равновесии в сторону продуктов реакции гидролиз проводят в присутствии щелочи. |
| | | | |
| - | <br>Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль. нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными зфи-рами, но только «трижды сложными., производными трехатомного спирта глицерина — триглицеридамн. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением». | + | <br>Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль. нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными., производными трехатомного спирта глицерина — триглицеридамн. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением». |
| | | | |
| | Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами: | | Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами: |
| Строка 35: |
Строка 43: |
| | <br>В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла. | | <br>В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла. |
| | | | |
| - | <br>3. Как вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато.<br><br>В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании.<br>Реакцию гидролиза крахмала до [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%92%D1%83%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%B8:_%D0%B3%D0%BB%D1%8E%D0%BA%D0%BE%D0%B7%D0%B0._%D0%A8%D0%BF%D0%B0%D1%80%D0%B3%D0%B0%D0%BB%D0%BA%D0%B8 глюкозы] при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф.<br>В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4). | + | <h3>Гидролиз углеводов</h3> |
| | + | |
| | + | Как вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато.<br><br>В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании.<br>Реакцию гидролиза крахмала до [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%92%D1%83%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%B8:_%D0%B3%D0%BB%D1%8E%D0%BA%D0%BE%D0%B7%D0%B0._%D0%A8%D0%BF%D0%B0%D1%80%D0%B3%D0%B0%D0%BB%D0%BA%D0%B8 глюкозы] при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф.<br>В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4). |
| | | | |
| | <br>Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле.<br>Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе п жареном картофеле, а также образование плотной пленки на накрал малеином белье под действием горячего утюга. | | <br>Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле.<br>Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе п жареном картофеле, а также образование плотной пленки на накрал малеином белье под действием горячего утюга. |
| Строка 47: |
Строка 57: |
| | <br>Техническими продуктами таких производств являются глицерин, этиленгликоль. органические кислоты, кормовые дрожжи, этиловый снирт, сорбит (шестиатомвый спирт). | | <br>Техническими продуктами таких производств являются глицерин, этиленгликоль. органические кислоты, кормовые дрожжи, этиловый снирт, сорбит (шестиатомвый спирт). |
| | | | |
| - | <br>4. Вы знаете, что [[Механизм_биосинтеза_белков|белки]]-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов. | + | <h3>Гидролиз белка</h3> |
| | + | |
| | + | Вы знаете, что [[Механизм_биосинтеза_белков|белки]]-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов. |
| | | | |
| | <br> | | <br> |
| Строка 55: |
Строка 67: |
| | <br> | | <br> |
| | | | |
| - | 5. Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается.<br><br>Обратный процесс образование ЛТФ из АДФ протекпет с поглощением энергии. Следовательно. АТФ это универсальное энергетическое вещество клетки.<br>Водные растворы солей имеют разные значения ph и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем. что соли в водных растворах могут подвергаться гидролизу.
| + | <h3>Гидролиз аденозинтрифосфорной кислоты</h3> |
| | + | |
| | + | Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается.<br><br>Обратный процесс образование ЛТФ из АДФ протекпет с поглощением энергии. Следовательно. АТФ это универсальное энергетическое вещество клетки.<br>Водные растворы солей имеют разные значения ph и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу. |
| | + | |
| | + | <h3>Гидролиз солей</h3> |
| | | | |
| - | <br>Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссо-циирующее соединение (слабый электролит). А в водном jmc творе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно. | + | <br>Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссо-циирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно. |
| | | | |
| | <br>Любую соль можно представить как продукт взаимодействия основания с кислотой. | | <br>Любую соль можно представить как продукт взаимодействия основания с кислотой. |
| Строка 67: |
Строка 83: |
| | <br> | | <br> |
| | | | |
| - | Рассмотрим повеление солей различных типов в раствору | + | '''Рассмотрим поведение солей различных типов в растворе''' |
| | | | |
| - | I. Соли, образованные сильным основанием и слабой кислотой<br>[[Image:Onov18.jpg|Гидролиз]]
| + | <h4>Соли, образованные сильным основанием и слабой кислотой</h4><br>[[Image:Onov18.jpg|Гидролиз]] |
| | | | |
| | <br> | | <br> |
| Строка 83: |
Строка 99: |
| | Подведем итог тому, что вы узнали о гидролизе по аниону:<br>а) во аниону соли, кпк правило, гидролиэуются обратимо;<br>б) химическое равновесие в таких реакциях сильно смещено влево;<br>в) реакция среды в растворах подобных солеи щелочная (рН > 7);<br>г) при гидролизе солей, образованных слабыми многоос-новными кислотами, получаются кислые соли. | | Подведем итог тому, что вы узнали о гидролизе по аниону:<br>а) во аниону соли, кпк правило, гидролиэуются обратимо;<br>б) химическое равновесие в таких реакциях сильно смещено влево;<br>в) реакция среды в растворах подобных солеи щелочная (рН > 7);<br>г) при гидролизе солей, образованных слабыми многоос-новными кислотами, получаются кислые соли. |
| | | | |
| - | <br>Соли, образованные сильной кислотой и слабым основанием. | + | <h4>Соли, образованные сильной кислотой и слабым основанием.</h4> |
| | | | |
| | <br>Например, рассмотрим гидролиз иодида аммония NН4I. | | <br>Например, рассмотрим гидролиз иодида аммония NН4I. |
| Строка 117: |
Строка 133: |
| | Выводы:<br>а) если соли гидролизируются и по катиону, и но аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;<br>б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;<br>в) соли могут гидролизироваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции. | | Выводы:<br>а) если соли гидролизируются и по катиону, и но аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;<br>б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;<br>в) соли могут гидролизироваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции. |
| | | | |
| - | <br>IV. Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами. | + | <h4>Соли, образованные сильным основанием и сильной кислотой</h4> |
| | + | |
| | + | Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами. |
| | | | |
| | <br>Рассмотрим «поведение» в растворе хлорида калия КСl. | | <br>Рассмотрим «поведение» в растворе хлорида калия КСl. |
| Строка 142: |
Строка 160: |
| | | | |
| | а) увеличить концентрацию растворенного вещества<br>б) охладить раствор;<br>а) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его г|я*дя в результате гидролиза кислотная, или подщелачивать, если — щелочная. | | а) увеличить концентрацию растворенного вещества<br>б) охладить раствор;<br>а) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его г|я*дя в результате гидролиза кислотная, или подщелачивать, если — щелочная. |
| | + | |
| | + | <h2>Значение гидролиза</h2> |
| | | | |
| | <br>Гидролиз солей имеет и практическое, и биологическое значение. | | <br>Гидролиз солей имеет и практическое, и биологическое значение. |
| Строка 157: |
Строка 177: |
| | Неоценима биологическая роль гидролиза некоторых солей, входящих в состав организма.<br>[[Image:Onov25.jpg|Гидролиз]] | | Неоценима биологическая роль гидролиза некоторых солей, входящих в состав организма.<br>[[Image:Onov25.jpg|Гидролиз]] |
| | | | |
| - | <br>Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.<br><br>1. Выберите примеры органических веществ, подвергающихся гидролизу:<br>глюкоза, этанол, бромметан, метаналь, сахароза, метиловый эфир муравьиной кислоты, стеариновая кислота, 2-метил бутан. | + | <br>Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.<br> |
| | + | |
| | + | <h2>Задания</h2> |
| | + | |
| | + | <br>1. Выберите примеры органических веществ, подвергающихся гидролизу:<br>глюкоза, этанол, бромметан, метаналь, сахароза, метиловый эфир муравьиной кислоты, стеариновая кислота, 2-метил бутан. |
| | | | |
| | <br>Составьте уравнения реакций гидролиза; в случае обратимого гидролиза укажите условия, позволяющие сместить химическое равновесие в сторону образования продукта реакции. | | <br>Составьте уравнения реакций гидролиза; в случае обратимого гидролиза укажите условия, позволяющие сместить химическое равновесие в сторону образования продукта реакции. |
Версия 20:16, 8 июня 2015
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Гидролиз
Определение гидролиза
Вы знаєте, что, согласно теории электролитической диссоциации, в водном растворе частицы растворенного вещества взаимодействуют с молекулами воды. Такое взаимодействие может привести к реакции гидролиза (от греческого hydro — вода, lysis — разложение, расиад).
Гидролиз — это реакция обменного разложения веществ водой.
Гидролизу подвергаются различные вещества: неорганические - соли, карбиды и гидриды металлов, галогениды неметаллов; органические — гялогеналканы. сложные зфиры и жиры, углеводы, белки, полинуклеотиды.
Реакции гидролиза могут протекать обратимо и необратимо. Рассмотрим разные случаи этого процесса и его значение.
Гидролиз органических веществ
Гидролиз галогеналканов
Гидролиз галогеналканов используют дли получения спиртов.
Присутствие щелочи (ОН ) иоэволяет «связать» получающуюся кислоту и сместить равновесие в сторону образования спирта.
Гидролиз сложных эфиров
Гидролиз сложных эфиров протекает обратимо в кислотной среде (в присутствии неорганической кислоты) с образованием соответствующего спирта и карбоновой кислоты.
Для смещения химическое равновесии в сторону продуктов реакции гидролиз проводят в присутствии щелочи.
Исторически первым примером такой реакции было щелочное расщепление сложных эфиров высших жирных кислот, что привело к получению мыла. Это произошло в 1811 г., когда французский ученый Э. Шеврёль. нагревая жиры с водой в щелочной среде, получил глицерин и мыла — соли высших карбоновых кислот. На основании этого эксперимента был установлен состав жиров, они оказались сложными эфирами, но только «трижды сложными., производными трехатомного спирта глицерина — триглицеридамн. А процесс гидролиза сложных эфиров в щелочной среде до сих пор называют «омылением».
Например, омыление эфира, образованного глицерином, пальмитиновой и стеариновой кислотами:
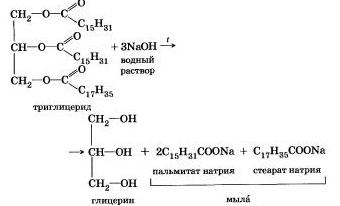
Натриевые соли высших карбоновых кислот — основные компоненты твердого мыла, калиевые соли — жидкого мыла.
Французский химик М. Бертло в 1854 г. осуществил реакцию этерификации и впервые синтезировал жир. Следовательно, гидролиз жиров (как и других сложных эфиров) протекает обратимо. Уравнение реакции можно упрощенно записать так:
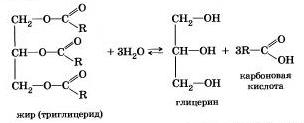
В живых организмах происходит ферментативный гидролиз жиров. В кишечнике под влиянием фермента липазы жиры пищи гидратизуются на глицерин и органические кислоты, которые всасываются стенками кишечника, и в организме синтезируются новые жиры, свойственные данному организму. Они по лимфатической системе поступают в кровь, а затем в жировую ткань. Отсюда жиры поступают в другие органы и ткани организма, где в процессе обмена веществ в клетках опять гидролиэу-ются и затем постепенно окисляются до оксида углерода и воды с выделеиием энергии, необходимой для жизнедеятельности.
В технике гидролиз жиров используют для получения глицерина, высших карбоновых кислот, мыла.
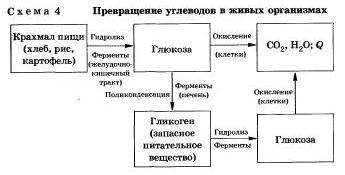
Гидролиз углеводов
Как вы зияете, углеводы являются важнейшими компонентами нашей пищи. Причем ди- (сахароза, лактоза, мальтоза) и полисахариды {крахмал, гликогеи) непосредственно не усваиваются организмом. Они, так же как и жиры, сначала подвергаются гидролизу. Гидролиз крахмала идет ступенчато.
В лабораторных и промышленных условиях в качестве катализатора этих процессов используют кислоту. Реакции осуществляют при нагревании.
Реакцию гидролиза крахмала до глюкозы при каталитическом действии серной кислоты осуществил в 1811 г. русский ученый К. С. Кирхгоф.
В организме человека и животных гидролиз углеводов происходит под действием ферментов (схема 4).
Промышленным гидролизом крахмала получают глюкозу и патоку (смесь декстринов, мальтозы и глюкозы). Патоку применяют в кондитерском деле.
Декстрины как продукт частичного гидролиза крахмала обладают клеящим действием: с ними связано появление корочки на хлебе п жареном картофеле, а также образование плотной пленки на накрал малеином белье под действием горячего утюга.
Еще один известный вам полисахарид — целлюлоза — также может гидролизоваться до глюкозы при длительном нагревании с минеральными кислотами. Процесс идет стуненчато, но кратко. Этот процесс лежит в основе многих гидролизных производств. Они служат для получения пищевых, кормовых и технических продуктов из непищевого растительиого сырья — отходов лесозаготовок, деревообработки (опилки, стружка, щепа), переработки сельскохозяйственных культур (соломы, шелухи семян, кочерыжек кукурузы и т. д.).
Техническими продуктами таких производств являются глицерин, этиленгликоль. органические кислоты, кормовые дрожжи, этиловый снирт, сорбит (шестиатомвый спирт).
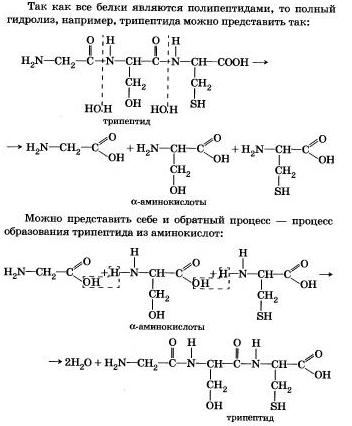
Гидролиз белка
Вы знаете, что белки-биополимеры — основа жизни всех живых организмов (от вируса до человека) — состоят главным образом из аминокислот (наиболее часто встречаются 20). Установление последовательности расположения остатков аминокислот, составляющих молекулу белка, является первоначальной целью при исследовании его структуры. И установить ее помогает ступенчатый гидролиз белка, который осуществляют при нагревании с кислотами или щелочами, а также при действии ферментов.
Гидролиз аденозинтрифосфорной кислоты
Неизмеримо важную роль в организме играет процесс гидролиза аденозинтрифосфорной кислоты (ЛТФ). Это вещество служит источником энергии для всевозможных биохимических реакций (построения белка, сокращения мышц и др.). При гидролизе ЛТФ до аденозиндифосфорной кислоты (АДФ) энергия высвобождается.
Обратный процесс образование ЛТФ из АДФ протекпет с поглощением энергии. Следовательно. АТФ это универсальное энергетическое вещество клетки.
Водные растворы солей имеют разные значения ph и различные типы сред — кислотную (рН < 7), щелочную (рН > 7), нейтральную (рН - 7). Это объясняется тем, что соли в водных растворах могут подвергаться гидролизу.
Гидролиз солей
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате этого взаимодействия образуется малодиссо-циирующее соединение (слабый электролит). А в водном растворе соли появляется избыток свободных ионов Н- или ОН+ и распор соли становится кислотным или щелочным соответственно.
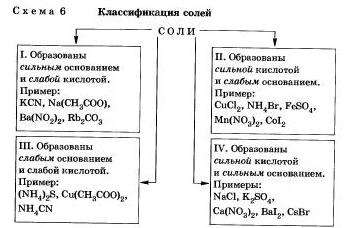
Любую соль можно представить как продукт взаимодействия основания с кислотой.
В зависимости от силы основания и кислоты можно выделить 4 типа солей (схема 6).
Рассмотрим поведение солей различных типов в растворе
Соли, образованные сильным основанием и слабой кислотой
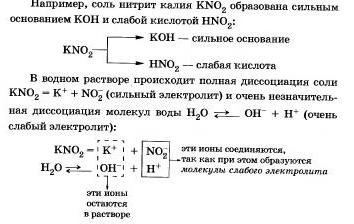
Этот процесс обратим, химическое равновесие смещено влево (в сторону образования исходных веществ), так как вода - значительно более слабый электролит, чем азотистая кислота.
Сокращенное ионное уравнение гидролиза покалывает, что:
а) в растворе есть свободные гидроксидионы ОН и концентрация их больше, чем в чистой воде, поэтому раствор соли KN02 имеет щелочную среду (рН > 7);
б) в реакции с водой участвуют анионы N02-; в таком случае говорят, что идет гидролиз по аниону.
Другие примеры анионов, которые участвуют в реакции с водой:
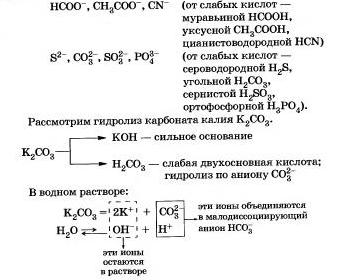
Подведем итог тому, что вы узнали о гидролизе по аниону:
а) во аниону соли, кпк правило, гидролиэуются обратимо;
б) химическое равновесие в таких реакциях сильно смещено влево;
в) реакция среды в растворах подобных солеи щелочная (рН > 7);
г) при гидролизе солей, образованных слабыми многоос-новными кислотами, получаются кислые соли.
Соли, образованные сильной кислотой и слабым основанием.
Например, рассмотрим гидролиз иодида аммония NН4I.
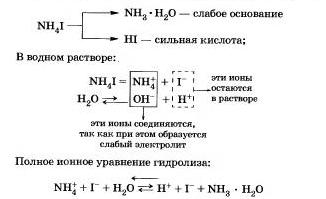
Процесс обратим, химическое равновесие смещено в сторону образования исходных веществ, так как вода Н20 значительно более слабый электролит, чем гидрат аммиака.
Уравнение показывает, что:
а) в растворе есть свободные ионы водорода Н и их концентрация больше, чем в чистой воде, поэтому раствор соли имеет кислотную среду (рН < 7);
б) в реакции с водой участвуют катионы аммония; в таком случае говорят, что идет гидролиз по катиону.
В реакции с водой могут участвовать и многозарядные катионы: двухзарядные М2+ , кроме катионов щелочноземельных металлов, трехраэрядные
М3+ .
Рассмотрим гидролиз хлорида никеля NiСl2.
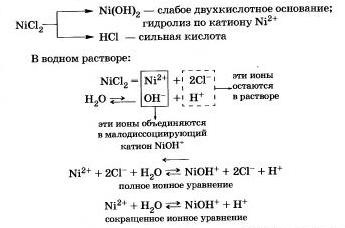
Продукты гидролиза — основная соль Ni0НСl и соляная кислота НСl.
Среда водного раствора хлорида никеля кислотная (рН < 7), потому что в растворе увеличивается концентрация ионов Н+.
Гидролиз соли Ni0НСl протекает в значительно меньшей степени, и им можно пренебречь.
Подведем ктог тому, что вы узнали о гидролизе по катиону: а) по катиону соли, как праймдо. гилродизутотся обратимо
б) химическое равновесие реакций силывосвииванво влево
III. Соли, образованные слабым основанием и слабой кислотой.
Вам, очевидно, уже ясно, что такие соли подвергаются гидролизу по катиону,и по аниону.
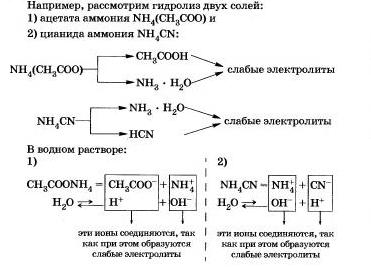
Как вы уже заметили, гидролиз большинства солей является обратимым процессом. Однако некоторые соли полностью разлагаются водой, т. е. их гидролиз является необратимым процессом.
Выводы:
а) если соли гидролизируются и по катиону, и но аниону обратимо, то химическое равновесие в реакциях гидролиза смещено вправо;
б) реакция среды при этом или нейтральная, или слабокислотная, или слабощелочная, что зависит от соотношения констант диссоциации образующегося основания и кислоты;
в) соли могут гидролизироваться и по катиону, и по аниону необратимо, если хотя бы один из продуктов гидролиза уходит из сферы реакции.
Соли, образованные сильным основанием и сильной кислотой
Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. К этому выводу вы пришли, очевидно, сами.
Рассмотрим «поведение» в растворе хлорида калия КСl.
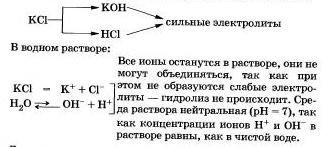
Другими примерами подобных солей могут быть нитраты, перхлораты, сульфаты, хромиты и дихроматы щелочных металлов, галогиды (кроме фторидов), нитраты и перхлораты щелочноземельных металлов.
Обобщим информацию о гидролизе солей в таблице 14. Следует также отметить, что реакции обратимого гидролиза полностью подчиняются принципу Ле Шателье. Поэтому гидролиз соли можно усилить (и даже сделать необратимым) следующими способами:
а) добавить воды (уменьшить концентрацию);
б) нагреть раствор, при этом усиливается эндотермическая диссоциация воды, а значит, увеличивается количество ионов Н и ОН , которые необходимы для осуществления гидролиза соли;

в) связать один из продуктов гидролиза в трудиорвстворимое соединение или удалить один из продуктов в газовую фазу; например, гидролиз цианид аммония будет значительно усиливаться за счет разложения гидрата аммиака с образованием аммиака, и воды.
Гидролиз можно подавить (значительно уменьшить коли чество подвергающейся гидролизу соли).
а) увеличить концентрацию растворенного вещества
б) охладить раствор;
а) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его г|я*дя в результате гидролиза кислотная, или подщелачивать, если — щелочная.
Значение гидролиза
Гидролиз солей имеет и практическое, и биологическое значение.
Еще в древности в качестве моющего средства использовали молу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе ионов ОН.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла — это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмитаты, которые гидролизуются.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рh среды.
Соли, создающие необходимую щелочную срелу раствора, содержатся в фотографическом проявителе. Это карбонат натрия, карбонат калия, бура и другие соли, гидролизующиеся но аниону.
Если кислотность почвы недостаточная, у растений появляется болезнь — хлороз. Ее признаки - пожелтение или побеление листьев, отставание в росте и развитии. Если рН> 7,5, то в нее вносят удобрение сульфат аммония, которое способствует повышению кислотности, благодаря гидролизу по катиону, проходящему в почве.
Неоценима биологическая роль гидролиза некоторых солей, входящих в состав организма.
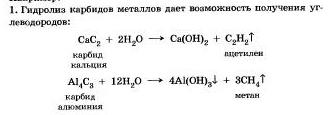
Обратите внимание, что во всех реакциях гидролиза степени окисления химических элементов не меняются. Окислительно-восстановительные реакции к реакциям гидролиза обычно не относят, хотя при этом и происходит взаимодействие вещества с водой.
Задания
1. Выберите примеры органических веществ, подвергающихся гидролизу:
глюкоза, этанол, бромметан, метаналь, сахароза, метиловый эфир муравьиной кислоты, стеариновая кислота, 2-метил бутан.
Составьте уравнения реакций гидролиза; в случае обратимого гидролиза укажите условия, позволяющие сместить химическое равновесие в сторону образования продукта реакции.
2. Кикие соли подвергаются гидролизу? Какую среду могут иметь при этом водные растворы солей? Приведите примеры.
3. Какие из солей подвергаются гидролизу по катиону? Составьте уравнения их гидролиза, укажите среду.
4. Какие из солей подвергаются гидролизу по аниону?
5*. Добавление каких из приведенных ниже веществ к раствору хлорида желеэа(ІІІ) усилит гидролиз соли: HCI, NaOH, ZnCl2? Дайте пояснения.
6. Подложите способы подавления гидролиза водного раствора сульфида калия.
задачи по химии 11 класс, ответы на тесты по химии, таблицы к урокам 11 класса
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|