Версия 20:06, 20 апреля 2012Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Кислоты. Полные уроки
Цели урока
Задачи урока
• обучающие: сформировать представление о кислотах, их составе и классификации, изучить химические свойства неорганических кислот; • развивающие: развить у учащихся умение анализировать, обобщать, сравнивать, выделять самое необходимое и делать выводы; • воспитательные: воспитание личностных качеств учащихся и расширение кругозора.
Основные термины
Кислоты – сложные вещества, которые состоят из атомов водорода и кислотного остатка. Неорганические кислоты – неорганические вещества, которые обладают комплексом физико-химических свойств, присущих кислотам.
Ход урока
Проверка домашнего задания.
Запишите формулы оснований: 1. Гидроксид натрия 2. Гидроксид цинка 3. Гидроксид лития 4. Гидроксид магния 5. Гидроксид алюминия 6. Гидроксид меди Составьте формулы оксидов, которые соответствуют гидроксидам: 1. Гидроксид кальция 2. Гидроксид железа 3. Гидроксид стронция 4. Гидроксид калия 5. Гидроксид бария 6. Гидроксид рубидия
Понятие и состав кислот.
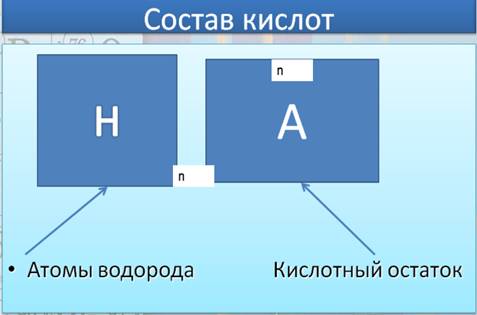
Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык , ведь среди них встречаются едкие и ядовитые. Но такие кислоты как уксусная (представлена на рисунке 1), яблочная, аскорбиновая (витамин С), лимонная, щавелевая и другие знакомы вам своим кислым вкусом. На рисунке 2 Вы можете увидеть, где именно в природе встречаются кислоты. Рис. 1. Уксусная кислота Рис. 2. Кислоты в природе Все кислоты, независимо от их происхождения, объединяет общее свойство – они содержат реакционноспособные атомы водорода. В связи с этим кислотам можно дать следующее определение: Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. На рисунке 3 показан состав кислот. Рис. 3. Состав кислот Итак, существует несколько определений кислот (рисунок 4). Рис. 4. Понятие кислот Давайте посмотрим видео, которое поможет нам усвоить, что же такое кислоты:
Классификация кислот.
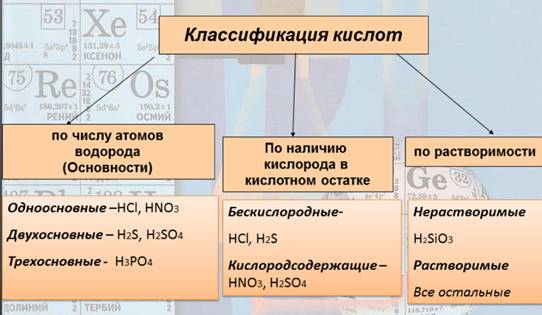
Кислоты классифицируются по разным признакам, так что давайте сначала просто выпишем их (рисунок 5). Рис. 5. Классификация кислот Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода. По первому признаку кислоты делятся на кислородсодержащие и бескислородные. По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н) Формулы и названия основных неорганических кислот.
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные и тривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой. Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая). Для разных кислородсодержащих кислот, образованных одним элементом, используется -истая для более низкой степени окисления (сернистая, азотистая). В ряде случаев для промежуточных степеней окисления дополнительно используются морфемы -новатая и -новатистая.
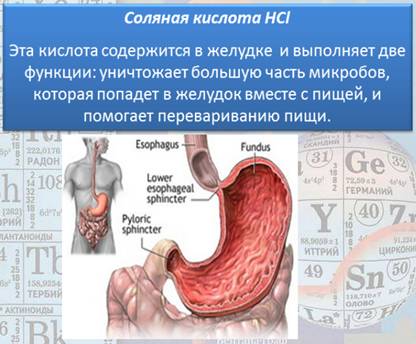
Давайте посмотрим, что же эти кислоты из себя представляют (рисунки 6, 7, 8). Рис. 6. Хлороводородная (соляная) кислота Рис. 7. Соляная кислота Рис. 8. Борная кислота А теперь давайте посмотрим на некоторые эксперименты и опыты с серной кислотой, которые помогут нам разобраться в химических свойствах кислот:
Химические свойства кислот.
Рассмотрим важнейшие химические свойства кислот. 1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет. 2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. 3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации. Давайте посмотрим на химический опыт, показывающий взаимодействие кислот с оксидами:
4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда). Давайте посмотрим на видео, как разбавленные кислоты взаимодействуют с металлами:
Выводы.
1. Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. 2. Кислоты классифицируются по числу атомов водорода (основности) – одноосновные, двухосновные и трехосновные; по наличию кислорода в кислотном остатке – бескислородные и кислородсодержащие; по растворимости – нерастворимые и растворимые. 3. К основным неорганическим кислотам относят хлороводородную (соляную) кислоту, фтороводородную кислоту, борную кислоту, серную кислоту и азотную кислоту.
Контролирующий блок.
1. Что такое кислоты? 2. Из сего состоят кислоты? 3. Какие виды кислот существуют? 4. Какие неорганические кислоты вы знаете?
Домашнее задание.
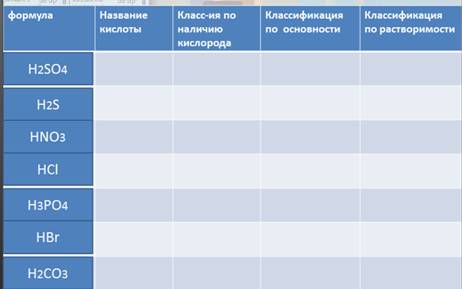
Заполните таблицу, представленную на рисунке 9. Рис. 9. Домашнее задание Интересно знать, что.
В 1772 году Дж. Пристли показал, что при действии концентрированной серной кислотой на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью и растворён в воде. Этот раствор назвали «муриевая кислота» (от слова «мурия» - рассол, солёная вода). Пристли назвал кислотой мурия соляную кислоту и её иногда до сих пор называют так. В 1756 году М.В. Ломоносов назвал раствор газа HCl в воде - соляной кислотой. В 1778 году А.Л. Лавуазье предположил, что кислоты - вещества, содержащие кислород. Однако, как вы уже знаете, он оказался неправ, т.к. существуют бескислородные кислоты. В 1814 году Г. Деви высказал мнение, что атом водорода - необходимая активная частица кислот, но атом водорода должен замещаться на металл.
Список литературы
1. Урок на тему «В мире кислот» Иванова Г.И., учитель химии, МОУ "Лицей №43", г. Саранск. 2. Урок-исследование на тему «Химические свойства кислот» Ларина С.В., учитель химии, СОШ №27, г. Нижнекамск. 3. Урок на тему «Кислоты» Денисова Ю.Н., учитель химии и биологии, гимназия №1, г. Североморск. 4. Урок на тему «Кислоты» Абакумов А.В., учитель химии, МОУ СОШ №26, г. Благовещенск. Отредактировано и выслано Борисенко И.Н.
Над уроком работали: Иванова Г.И. Ларина С.В. Денисова Ю.Н. Абакумов А.В. Борисенко И.Н.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: