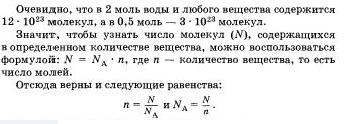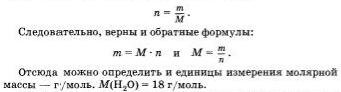|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Количество вещества'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Количество вещества</metakeywords>''' | + | '''[[Гипермаркет знаний - первый в мире!|Гипермаркет знаний]]>>[[Химия|Химия]]>>[[Химия 8 класс|Химия 8 класс]]>> Химия: Количество вещества'''<metakeywords>химия, 8 класс, класс, урок химии, на тему, урок на тему, урок для 8 класса, Количество вещества</metakeywords> |
| | | | |
| - | ''Химия'' — это наука о веществах. А как измерять вещество? В каких единицах? Вы можете предложить отсчитывать необходимое число молекул вещества, если оно состоит из них. Однако сделать это чрезвычайно сложно. Некоторые из вас предложат измерять вещество в граммах, килограммах или миллиграммах. Но ведь это единицы намерения массы. | + | ''Химия'' — это наука о веществах. А как измерять вещество? В каких единицах? Вы можете предложить отсчитывать необходимое число молекул вещества, если оно состоит из них. Однако сделать это чрезвычайно сложно. Некоторые из вас предложат измерять вещество в граммах, килограммах или миллиграммах. Но ведь это единицы намерения массы. |
| | | | |
| - | <br>Для измерения вещества была выбрана особая единица, в которой как бы соединились число молекул и масса вещества. Эта единица была названа <u>''моль''</u>.<br>Чтобы отмерить один моль вещества, нужно взять столько граммов его. какова относительная атомиая (Аr) или относительная молекулярная масса (Mr) вещества. | + | <br>Для измерения вещества была выбрана особая единица, в которой как бы соединились число молекул и масса вещества. Эта единица была названа <u>''моль''</u>.<br>Чтобы отмерить один моль вещества, нужно взять столько граммов его. какова относительная атомиая (Аr) или относительная молекулярная масса (Mr) вещества. |
| | | | |
| - | <br>Например, один моль воды имеет массу, равную 18 г, так как Мr (Н20) - 18; один моль кислорода — 32 г, так как Мr(О2) = 32; один моль железа — 56 г, так как Мr(Fе) = 56. | + | <br>Например, один моль воды имеет массу, равную 18 г, так как Мr (Н20) - 18; один моль кислорода — 32 г, так как Мr(О2) = 32; один моль железа — 56 г, так как Мr(Fе) = 56. |
| | | | |
| - | <br>А если нужно отмерить два моля воды, то сколько граммов ее нужно взять? Верно. 36 г (18 * 2). Л можно отмерить полмоля кислорода? Конечно. 0,5 моль О2 имеют массу в два раза меньше массы одного моля, то есть 16 г (32:2). Л сколько молей воды взято, если, например, отмерили 45 г воды? Очевидно, нужно эту массу разделить на массу одного моля воды (45 г : 18 г/моль = 2,5 моль), то есть взято 2.5 моль. | + | <br>А если нужно отмерить два моля воды, то сколько граммов ее нужно взять? Верно. 36 г (18 * 2). Л можно отмерить полмоля кислорода? Конечно. 0,5 моль О2 имеют массу в два раза меньше массы одного моля, то есть 16 г (32:2). Л сколько молей воды взято, если, например, отмерили 45 г воды? Очевидно, нужно эту массу разделить на массу одного моля воды (45 г : 18 г/моль = 2,5 моль), то есть взято 2.5 моль. |
| | | | |
| - | <br>А как связано с количеством вещества число его молекул? Установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6 * 10^23 честь итальянского ученого А. Лвогадро это чисто назвали постоянной Авогадро. Обозначается оно N A. | + | <br>А как связано с количеством вещества число его молекул? Установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6 * 10^23 честь итальянского ученого А. Лвогадро это чисто назвали постоянной Авогадро. Обозначается оно N A. |
| | | | |
| - | <br>Таким образом, 1 моль воды имеет массу 18 г и содержит 6 * 10^23 молекул Н2О. Один моль кислорода О2 имеет массу 32 г и также содержит 6 * 10^23 молекул O2. | + | <br>Таким образом, 1 моль воды имеет массу 18 г и содержит 6 * 10^23 молекул Н2О. Один моль кислорода О2 имеет массу 32 г и также содержит 6 * 10^23 молекул O2. |
| | | | |
| - | [[Image:him8-44.jpg]] | + | [[Image:Him8-44.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| - | | + | Теперь дадим определение понятию "моль". |
| - | Теперь дадим определение понятию "моль". | + | |
| | | | |
| | ---- | | ---- |
| | | | |
| - | <u>''Моль''</u> — это такое количество вещества, в котором содержится 6 * 10^23 молекул этого вещества. | + | <u>''Моль''</u> — это такое количество вещества, в котором содержится 6 * 10^23 молекул этого вещества. |
| | | | |
| | ---- | | ---- |
| | | | |
| - | [[Image:him8-45.jpg]] | + | [[Image:Him8-45.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| | + | Масса 1 моль вещества называется его молярной массой и обозначается буквой М.<br><br>Как вы теперь знаете, количество вещества измеряется в молях и обозначается буквой n, в некоторых учебниках — греческой буквой ''v'' (ню). Чтобы найти количество вещества, нужно его массу разделить на молярную массу:<br>[[Image:Him8-46.jpg]] |
| | | | |
| - | Масса 1 моль вещества называется его молярной массой и обозначается буквой М.<br><br>Как вы теперь знаете, количество вещества измеряется в молях и обозначается буквой n, в некоторых учебниках — греческой буквой ''v'' (ню). Чтобы найти количество вещества, нужно его массу разделить на молярную массу:<br>[[Image:him8-46.jpg]]
| + | <br> |
| | | | |
| | + | Вы Знаете, что единица массы, которая в 10041 раз больше одного грамма, называется килограммом, а единица массы в 1000 раз меньше одного грамма — милиграммом. |
| | | | |
| | + | <br>Следовательно, в количество вещества можно измерять не только в молях, но и в киломолях — к моль (1 кмоль содержит 1000 моль), и в миллимолях — ммоль (1 моль содержит 1000 ммоль).<br> |
| | | | |
| - | Вы Знаете, что единица массы, которая в 10041 раз больше одного грамма, называется килограммом, а единица массы в 1000 раз меньше одного грамма — милиграммом.
| + | Соответственно, вместо молярной массы в некоторых случаях удобнее пользоваться понятием киломолярная масса (кг/кмоль) и миляимолярная масса (мг/ммоль). |
| | | | |
| - | <br>Следовательно, в количество вещества можно измерять не только в молях, но и в киломолях — к моль (1 кмоль содержит 1000 моль), и в миллимолях — ммоль (1 моль содержит 1000 ммоль).<br>
| + | <br>Мы определили, как связаны между собой количество и масса вещества. Теперь решим задачи с использованием рассмотренных выше понятий. |
| - | | + | |
| - | Соответственно, вместо молярной массы в некоторых случаях удобнее пользоваться понятием киломолярная масса (кг/кмоль) и миляимолярная масса (мг/ммоль).
| + | |
| - | | + | |
| - | <br>Мы определили, как связаны между собой количество и масса вещества. Теперь решим задачи с использованием рассмотренных выше понятий. | + | |
| - | | + | |
| - | <br>''Задача 1.'' Сколько молекул содержится в 11 г углекислого газа СO2?<br> <br>[[Image:him8-47.jpg]]
| + | |
| | | | |
| | + | <br>''Задача 1.'' Сколько молекул содержится в 11 г углекислого газа СO2?<br> <br>[[Image:Him8-47.jpg]] |
| | | | |
| | + | <br> |
| | | | |
| | 1. Количество вещества. | | 1. Количество вещества. |
| | | | |
| - | 2. Моль, киломоль, миллимоль.<br> | + | 2. Моль, киломоль, миллимоль.<br> |
| | | | |
| - | 3. Молярная, киломолярная и миллимолярная массы.<br> | + | 3. Молярная, киломолярная и миллимолярная массы.<br> |
| | | | |
| - | 4. Число Авогадро.<br> | + | 4. Число Авогадро.<br> |
| | | | |
| - | Сколько молекул содержит: а) 1 кмоль вещества; б) 1 ммоль вещества? | + | Сколько молекул содержит: а) 1 кмоль вещества; б) 1 ммоль вещества? |
| | | | |
| - | [[Image:him8-48.jpg]] | + | [[Image:Him8-48.jpg]] |
| | | | |
| - | Вставьте пропущенные слова в предложения: «Масса измеряется в миллиграммах ... килограммах. Количество вещества измеряется в...<br><br>Плотность, то есть масса кислорода объемом 1 л. приблизительно равна 1,3 г/л. Какое количество вещества кислорода будет содержаться в 1 л его? Сколько молекул его будет в 1 л? а сколько в 1 мл? а в 1 м3?<br> | + | Вставьте пропущенные слова в предложения: «Масса измеряется в миллиграммах ... килограммах. Количество вещества измеряется в...<br><br>Плотность, то есть масса кислорода объемом 1 л. приблизительно равна 1,3 г/л. Какое количество вещества кислорода будет содержаться в 1 л его? Сколько молекул его будет в 1 л? а сколько в 1 мл? а в 1 м3?<br> |
| | | | |
| - | <br><br> <sub>картинки и иллюстрации [[Химия|к уроку химии]], самая большая [[Гипермаркет_знаний_-_первый_в_мире!|библиотека учебников]], уроки [[Химия_8_класс|химии]]</sub> | + | <br><br> <sub>картинки и иллюстрации [[Химия|к уроку химии]], самая большая [[Гипермаркет знаний - первый в мире!|библиотека учебников]], уроки [[Химия 8 класс|химии]]</sub> |
| | | | |
| | '''<u>Содержание урока</u>''' | | '''<u>Содержание урока</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] конспект урока ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект урока ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] опорный каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] опорный каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентация урока | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://school.xvatit.com/index.php?title=%D0%9A%D0%B0%D1%82%D0%B5%D0%B3%D0%BE%D1%80%D0%B8%D1%8F:%D0%9A%D0%BE%D0%BB%D0%B8%D1%87%D0%B5%D1%81%D1%82%D0%B2%D0%BE_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%B0_(%D0%A5%D0%B8%D0%BC%D0%B8%D1%8F_8_%D0%BA%D0%BB%D0%B0%D1%81%D1%81)._%D0%9F%D1%80%D0%B5%D0%B7%D0%B5%D0%BD%D1%82%D0%B0%D1%86%D0%B8%D1%8F презентация урока] |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративные методы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративные методы |
| - | [[Image:1236084776 kr.jpg|10x10px]] интерактивные технологии | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] интерактивные технологии |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачи и упражнения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачи и упражнения |
| - | [[Image:1236084776 kr.jpg|10x10px]] самопроверка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] самопроверка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикумы, тренинги, кейсы, квесты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикумы, тренинги, кейсы, квесты |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашние задания | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашние задания |
| - | [[Image:1236084776 kr.jpg|10x10px]] дискуссионные вопросы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] дискуссионные вопросы |
| - | [[Image:1236084776 kr.jpg|10x10px]] риторические вопросы от учеников | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] риторические вопросы от учеников |
| - |
| + | |
| | '''<u>Иллюстрации</u>''' | | '''<u>Иллюстрации</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] аудио-, видеоклипы и мультимедиа ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] аудио-, видеоклипы и мультимедиа ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] фотографии, картинки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фотографии, картинки |
| - | [[Image:1236084776 kr.jpg|10x10px]] графики, таблицы, схемы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] графики, таблицы, схемы |
| - | [[Image:1236084776 kr.jpg|10x10px]] юмор, анекдоты, приколы, комиксы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] юмор, анекдоты, приколы, комиксы |
| - | [[Image:1236084776 kr.jpg|10x10px]] притчи, поговорки, кроссворды, цитаты | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] притчи, поговорки, кроссворды, цитаты |
| | | | |
| | '''<u>Дополнения</u>''' | | '''<u>Дополнения</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] рефераты''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рефераты''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] статьи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статьи |
| - | [[Image:1236084776 kr.jpg|10x10px]] фишки для любознательных | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фишки для любознательных |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] учебники основные и дополнительные | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] учебники основные и дополнительные |
| - | [[Image:1236084776 kr.jpg|10x10px]] словарь терминов | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словарь терминов |
| - | [[Image:1236084776 kr.jpg|10x10px]] прочие | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] прочие |
| - | '''<u></u>''' | + | |
| | <u>Совершенствование учебников и уроков | | <u>Совершенствование учебников и уроков |
| - | </u>'''[[Image:1236084776 kr.jpg|10x10px]] исправление ошибок в учебнике''' | + | </u>'''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] исправление ошибок в учебнике''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] обновление фрагмента в учебнике | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обновление фрагмента в учебнике |
| - | [[Image:1236084776 kr.jpg|10x10px]] элементы новаторства на уроке | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] элементы новаторства на уроке |
| - | [[Image:1236084776 kr.jpg|10x10px]] замена устаревших знаний новыми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] замена устаревших знаний новыми |
| - |
| + | |
| | '''<u>Только для учителей</u>''' | | '''<u>Только для учителей</u>''' |
| - | <u></u>'''[[Image:1236084776 kr.jpg|10x10px]] идеальные уроки ''' | + | '''[[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] идеальные уроки ''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарный план на год | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарный план на год |
| - | [[Image:1236084776 kr.jpg|10x10px]] методические рекомендации | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методические рекомендации |
| - | [[Image:1236084776 kr.jpg|10x10px]] программы | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] программы |
| - | [[Image:1236084776 kr.jpg|10x10px]] обсуждения | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] обсуждения |
| | | | |
| | | | |
Версия 09:28, 28 мая 2012
Гипермаркет знаний>>Химия>>Химия 8 класс>> Химия: Количество вещества
Химия — это наука о веществах. А как измерять вещество? В каких единицах? Вы можете предложить отсчитывать необходимое число молекул вещества, если оно состоит из них. Однако сделать это чрезвычайно сложно. Некоторые из вас предложат измерять вещество в граммах, килограммах или миллиграммах. Но ведь это единицы намерения массы.
Для измерения вещества была выбрана особая единица, в которой как бы соединились число молекул и масса вещества. Эта единица была названа моль.
Чтобы отмерить один моль вещества, нужно взять столько граммов его. какова относительная атомиая (Аr) или относительная молекулярная масса (Mr) вещества.
Например, один моль воды имеет массу, равную 18 г, так как Мr (Н20) - 18; один моль кислорода — 32 г, так как Мr(О2) = 32; один моль железа — 56 г, так как Мr(Fе) = 56.
А если нужно отмерить два моля воды, то сколько граммов ее нужно взять? Верно. 36 г (18 * 2). Л можно отмерить полмоля кислорода? Конечно. 0,5 моль О2 имеют массу в два раза меньше массы одного моля, то есть 16 г (32:2). Л сколько молей воды взято, если, например, отмерили 45 г воды? Очевидно, нужно эту массу разделить на массу одного моля воды (45 г : 18 г/моль = 2,5 моль), то есть взято 2.5 моль.
А как связано с количеством вещества число его молекул? Установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно 6 * 10^23 честь итальянского ученого А. Лвогадро это чисто назвали постоянной Авогадро. Обозначается оно N A.
Таким образом, 1 моль воды имеет массу 18 г и содержит 6 * 10^23 молекул Н2О. Один моль кислорода О2 имеет массу 32 г и также содержит 6 * 10^23 молекул O2.
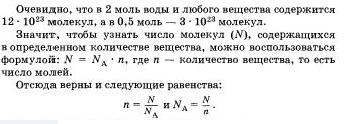
Теперь дадим определение понятию "моль".
Моль — это такое количество вещества, в котором содержится 6 * 10^23 молекул этого вещества.

Масса 1 моль вещества называется его молярной массой и обозначается буквой М.
Как вы теперь знаете, количество вещества измеряется в молях и обозначается буквой n, в некоторых учебниках — греческой буквой v (ню). Чтобы найти количество вещества, нужно его массу разделить на молярную массу:
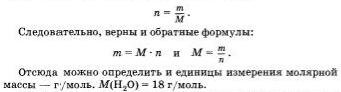
Вы Знаете, что единица массы, которая в 10041 раз больше одного грамма, называется килограммом, а единица массы в 1000 раз меньше одного грамма — милиграммом.
Следовательно, в количество вещества можно измерять не только в молях, но и в киломолях — к моль (1 кмоль содержит 1000 моль), и в миллимолях — ммоль (1 моль содержит 1000 ммоль).
Соответственно, вместо молярной массы в некоторых случаях удобнее пользоваться понятием киломолярная масса (кг/кмоль) и миляимолярная масса (мг/ммоль).
Мы определили, как связаны между собой количество и масса вещества. Теперь решим задачи с использованием рассмотренных выше понятий.
Задача 1. Сколько молекул содержится в 11 г углекислого газа СO2?

1. Количество вещества.
2. Моль, киломоль, миллимоль.
3. Молярная, киломолярная и миллимолярная массы.
4. Число Авогадро.
Сколько молекул содержит: а) 1 кмоль вещества; б) 1 ммоль вещества?

Вставьте пропущенные слова в предложения: «Масса измеряется в миллиграммах ... килограммах. Количество вещества измеряется в...
Плотность, то есть масса кислорода объемом 1 л. приблизительно равна 1,3 г/л. Какое количество вещества кислорода будет содержаться в 1 л его? Сколько молекул его будет в 1 л? а сколько в 1 мл? а в 1 м3?
картинки и иллюстрации к уроку химии, самая большая библиотека учебников, уроки химии
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|