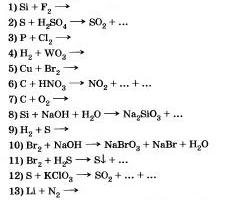|
Гипермаркет знаний>>Химия>>Химия 11 класс>> Химия: Неметаллы
Химические элементы-неметаллы
Вы, очевидно, помните, что самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Неметаллы - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрнцательности. Оиа изменяется в пределах от 2 до 4. Неметаллы - это элементы главных подгрупп, преимущественно р элементы, исключение составляет водород - s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах — соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 — газ. Его молекула, подобно галогенам, двухатомна.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах (рис. 47).
Фтор - самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя

Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего 161 Совсем немного, если учесть, что известно 114 элементов. Два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере всодержнтся 0,03% от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. Шесть неметаллов — С, Н, О, N, Р и S — биогенные элементы, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элемента ми-неметаллами (кислород О2, азот, углекислый газ СО2, водяные пары Н2О и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88%. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 — атомы водорода.
Простые вещества-неметаллы
Строение. Физические свойства
В простых веществах атомы неметаллов связаны кова-лентнон неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Ки, Вг2), двойные (например, в молекулах серы тронные (например, в молекулах азота ковалентные связи.
Как вам уже известно, простые вещества-неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы или твердые вещества и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ко-валентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала. (На рисунке 47 подчеркнуты символы тех элементов-неметаллов, которые образуют только атомные кристаллические решетки.)
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул, и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен (рис. 48).
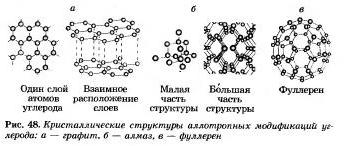
Элементы-неметаллы, обладающие свойством аллотропии, обозначены на рисунке 47 звездочкой. Так что простых веществ-неметаллов гораздо больше, чем химических элементов- неметаллов.
Вы знаете, что дли большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ-неметаллов гамма цветов значительно разнообразнее.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы - диэлектрики, так как все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая дефор-мация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Химические свойства
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ неметаллов
1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами (как вы знаете, металлы всегда восстановители):

Окислительные свойства хлора Сl2 выражены сильнее, чем у серы, поэтому и металл Ре, который имеет в соединениях устойчивые степени окислеиия +2 b +3. окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения.
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение элек-троотрицател ьности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства.
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами. Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами -неорганическими и органическими.
Сильный окислитель хлор Сl2 окисляет хлорид железа(II) в хлорид железа(III).
Вы помните, конечно, качественную реакцию на непредельные соединении — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов
При рассмотрении реакции неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности одни из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служит восстановителями при взаимодействии с кислородом:

8 Многие неметеллы могут выступать в роли восстановителя в реакциях со сложными веществами окислителями:
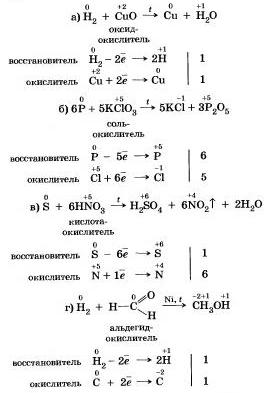
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, в восстановителем, это реакции самоокисления-самовосстановления.
Итак, подведем итоги! Большинство неметаллов могут выступал в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи одному только фтору).
Водородные соединения неметаллов
Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве которых неметалл имеет низшую степень окисления.
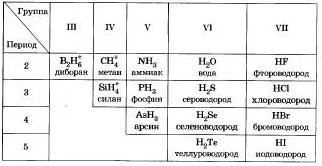
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметаллв е водородом, то есть синтезом.
Вм водородные соединении неметаллов обдоэоьаны коналентны-ми полярными свялямн, имеют молекулярное строение и при обычных условиях является газами, кроме воды (жидкость). Лла водородных соединений неметаллов характерно рвалнчное отношение к воде. Метай и енлан в ней практмческя нерастворимы. Аммиак при расстворении в воде образует слябое основание — гидрат аммиака.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителен, ведь в них неметалл имеет низшую степень окисления.
Оксиды неметаллов
и соответствующие им гидроксиды
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные, жидкие (летучие), твердые (летучие).
Оксиды неметаллов делят на две группы: несолеобразующие и голеобразующие. При растворении кислотных оксидов в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, то есть высшее ее значение, называют высшими. При рассмотрении Периодического закона мы уже характеризовали их состав и свойства.
усиление кислотных свойств оксидов и шдронепдоп В пределах одной главной подгруппы, например, VI группы действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени оксиления неметалла.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут чроявлять только окислительные свойства.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
1. К каким электронным семействам откосят элементы-неметаллы?
2. Какие элементы-неметаллы являются биогенными?
3. Какие факторы определяют валентные возможности ато-ыов неметаллов? Рассмотрите их на примере атомов кислорода и серы.
4. Почему одни неметаллы при обычных условиях — газы, другие - твердые тугоплавкие вещества? Приведите примеры простых веществ-неметаллов, существующих при обычных условиях в разном агрегатном состоянии: а) газообразном, б) жидком, в) твердом.
6. Составьте уравнения окислительно-восстановительных реакций с участием неметаллов. Какие свойство (окислительные или восстановительные) проявляют в этих реакциях неметаллы?
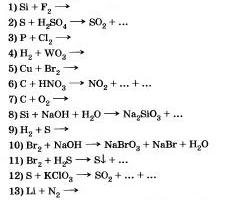
По какой причине очень сильно различаются температуры кипения воды и сероводорода, но близки между собой температуры кипения серо- и селеноводорода?
7. Почему метан устойчив на воздухе, а силен на воздухе самовозгорается: фтороводород устойчив к нагреванию, иодо-водород уже при слабом нагревании разлагается на иод и водород?
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
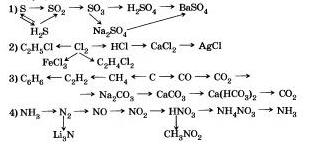
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
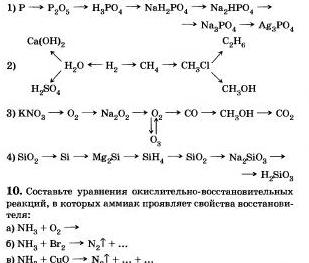
12. Через раствор, содержащий 10 г едкого натра, пропустили 20 г сероводорода. Какая соль и в какой количестве получится?
Ответ: 0.25 моль NaHS.
14. При обработке 30 г известняка соляной кислотой получилось 11 г углекислого газа. Какова массовая доля карбоната кальция в природном известняке? Ответ: 83.3%.
15. Применяемая в медицине йодная настойкп является 51% ным раствором кристаллического иода в этиловом спирте. Какой объем спирта, плотность которого 0.8 г/мл. требуется для приготовления 250 г такого раствора?
Ответ: 297 мл.
16. Смесь кремния, графита и карбоната кальция .массой 34 г обработали раствором гидроксида натрия п получили 22.4 л газа (н. у.). При обработке такой порции смеси соляной кислотой получили 2.24 л газа (н. у.). Определите массовый состав смеси.
Ответ: 14 г 81: 10 г С; 10 г СаСО2.
17. Газообразный аммиак объемом 2.24 л (н. у.) поглощен 20 г раствора фосфорной кислоты с массовой долей 49%. Какая соль образовалась, какова ее масса?
Ответ: 11,5г
19. Какой объем аммиака требуется для получения 6,3 т азотной кислоты, считая потери в производстве равными 5%?
Ответ: 2352 м3.
20. Из природного газа объемом 300 л (н. у.) с объемной долей метана в газе 96% получили ацетилен. Определите его объем, если выход продукта 65%.
Ответ: 93.6 л.
21. Определите структурную формулу углеводорода с плотностью паров по воздуху 1,862 и массовой долей углерода 88,9%. Известно, что углеводород взаимодействует с аммиачным раствором оксида серебра.
презентация урока химии, кроссворды для 11 класса, цитаты и поговорки
Содержание урока
 конспект урока конспект урока
 опорный каркас опорный каркас
 презентация урока презентация урока
 акселеративные методы акселеративные методы
 интерактивные технологии
Практика интерактивные технологии
Практика
 задачи и упражнения задачи и упражнения
 самопроверка самопроверка
 практикумы, тренинги, кейсы, квесты практикумы, тренинги, кейсы, квесты
 домашние задания домашние задания
 дискуссионные вопросы дискуссионные вопросы
 риторические вопросы от учеников
Иллюстрации риторические вопросы от учеников
Иллюстрации
 аудио-, видеоклипы и мультимедиа аудио-, видеоклипы и мультимедиа
 фотографии, картинки фотографии, картинки
 графики, таблицы, схемы графики, таблицы, схемы
 юмор, анекдоты, приколы, комиксы юмор, анекдоты, приколы, комиксы
 притчи, поговорки, кроссворды, цитаты
Дополнения притчи, поговорки, кроссворды, цитаты
Дополнения
 рефераты рефераты
 статьи статьи
 фишки для любознательных фишки для любознательных
 шпаргалки шпаргалки
 учебники основные и дополнительные учебники основные и дополнительные
 словарь терминов словарь терминов
 прочие
Совершенствование учебников и уроков прочие
Совершенствование учебников и уроков
 исправление ошибок в учебнике исправление ошибок в учебнике
 обновление фрагмента в учебнике обновление фрагмента в учебнике
 элементы новаторства на уроке элементы новаторства на уроке
 замена устаревших знаний новыми
Только для учителей замена устаревших знаний новыми
Только для учителей
 идеальные уроки идеальные уроки
 календарный план на год календарный план на год
 методические рекомендации методические рекомендации
 программы программы
 обсуждения
Интегрированные уроки обсуждения
Интегрированные уроки
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|