|
|
|
| Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Хімія: Оксиди неметалічних елементів. Сульфатна кислота і сульфати''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 10 клас|Хімія 10 клас]]>> Оксиди неметалічних елементів. Сульфатна кислота і сульфати''' <br> |
| - |
| + | |
| | | | |
| - | <br>
| + | ОКСИДИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. КИСЛОТНИЙ ХАРАКТЕР ОКСИДІВ ТА ГІДРАТІВ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. СУЛЬФАТНА КИСЛОТА І СУЛЬФАТИ. НАЙВАЖЛИВІШІ ПРИРОДНІ СУЛЬФАТИ, ЯКІСНА РЕАКЦІЯ НА СУЛЬФАТ-ІОН |
| - | <br>
| + | |
| - |
| + | |
| | | | |
| - |
| + | СУЛЬФУР утворює два [[12._Оксиди,_їх_склад,_назви|кислотні оксиди]]: оксид сульфуру (ІV) S0<sub>2 </sub>і оксид сульфуру(VI) S0<sub>3</sub>. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин. |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | ''Оксид сульфуру(IV) SO<sub>2</sub> ''(діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S0<sub>2</sub>). Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S0<sub>2 </sub>з водою, внаслідок чого утворюється сульфітна кислота: |
| - |
| + | |
| | | | |
| - | <met akeywords>Хімія, клас, урок, на тему, 10 клас, Оксиди неметалічних елементів, Кислотний характер оксидів та гідратів оксидів, оксидів неметалічних елементів, Сульфатна кислота і сульфати, Найважливіші природні сульфати, якісна реакція на сульфат-іон.</metakeywords>ОКСИДИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. КИСЛОТНИЙ ХАРАКТЕР ОКСИДІВ ТА ГІДРАТІВ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. СУЛЬФАТНА КИСЛОТА І СУЛЬФАТИ. НАЙВАЖЛИВІШІ ПРИРОДНІ СУЛЬФАТИ, ЯКІСНА РЕАКЦІЯ НА СУЛЬФАТ-ІОН
| + | S0<sub>2</sub> + Н<sub>2</sub>0 ⇔ H<sub>2</sub>S0<sub>3</sub> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Сульфітна [[Оксиди_неметалічних_елементів._Сульфатна_кислота_і_сульфати|кислота]] H<sub>2</sub>S0<sub>3</sub> — дуже нетривка сполука. Існує тільки у водних розчинах. За спроб виділити її розкладається на оксид сульфуру(ІV) і воду. Легко поглинає з повітря кисень і повільно окиснюється у сульфатну кислоту: |
| - |
| + | |
| | | | |
| - | <br> | + | 2H<sub>2</sub>S0<sub>3</sub> + 0<sub>2</sub> = 2H<sub>2</sub>S0<sub>4</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | Сульфітна кислота H<sub>2</sub>S0<sub>3</sub> двохосновна. Належить до кислот середньої сили. У водному розчині дисоціює ступіні часто, в основному за першим ступенем: |
| - |
| + | |
| | | | |
| - | <br> | + | I ступінь H<sub>2</sub>SO<sub>3</sub> ⇔H<sup>+ </sup>+ HSO<sub>3</sub><sup>-</sup> |
| - | <br>
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | <sup> гідросульфіт-іон</sup> |
| - |
| + | |
| | | | |
| - | СУЛЬФУР утворює два кислотні оксиди: оксид сульфуру (ІV) S0<sub>2 </sub>і оксид сульфуру(VI) S0<sub>3</sub>. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
| + | ІІ ступінь HSO<sub>3</sub><sup>- </sup>⇔H<sup>+ </sup>+ SO<sup>2-</sup><sub>3</sub><br> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup> сульфіт-іон</sup> |
| - |
| + | |
| | | | |
| - | <br>
| + | За другим ступенем дисоціація відбувається незначною мірою. |
| - |
| + | |
| | | | |
| - | ''Оксид сульфуру(IV) SO<sub>2</sub> ''(діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S0<sub>2</sub>). Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S0<sub>2 </sub>з водою, внаслідок чого утворюється сульфітна кислота:
| + | Як двохосновна сульфітна кислота H<sub>2</sub>SO<sub>3</sub> може утворювати два ряди [[14._Солі_(середні),_їх_склад,_назви|солей]]: а) середні солі — сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал). |
| - |
| + | |
| | | | |
| - | <br> | + | <u>NaOH</u> + <u>SO<sub>2</sub></u> = <u>NaHSO<sub>3</sub></u> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup>1 моль 1 моль гідросульфіт натрію</sup> |
| - |
| + | |
| | | | |
| - | S0<sub>2</sub> + Н<sub>2</sub>0 ⇔ H<sub>2</sub>S0<sub>3</sub>
| + | <u>2NaOH</u> + <u>SO<sub>2</sub></u> = <u>Na<sub>2</sub>SO<sub>3</sub></u> + <u>H<sub>2</sub>O</u> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup>2 моль 1моль сульфіт натрію</sup> |
| - |
| + | |
| | | | |
| - | <br>
| + | Це слід брати до уваги під час виконання дослідів та розвязування задач. |
| - |
| + | |
| | | | |
| - | Сульфітна кислота H<sub>2</sub>S0<sub>3</sub> — дуже нетривка сполука. Існує тільки у водних розчинах. За спроб виділити її розкладається на оксид сульфуру(ІV) і воду. Легко поглинає з повітря кисень і повільно окиснюється у сульфатну кислоту:
| + | Усі сульфіти — нерозчинні солі, за винятком сульфітів лужних металів і амонію. |
| - |
| + | |
| | | | |
| - | <br> | + | <u>Добування</u> |
| - |
| + | |
| | | | |
| - | <br> | + | <br> |
| - |
| + | |
| | | | |
| - | 2H<sub>2</sub>S0<sub>3</sub> + 0<sub>2</sub> = 2H<sub>2</sub>S0<sub>4</sub>
| + | Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад: |
| - |
| + | |
| | | | |
| - | <br> | + | S + O<sub>2</sub> = SO<sub>2</sub>↑ |
| - |
| + | |
| | | | |
| - | <br> | + | 2Pb + 3O<sub>2</sub> = 2PbO + 2SO<sub>2</sub>↑ |
| - |
| + | |
| | | | |
| - | Сульфітна кислота H<sub>2</sub>S0<sub>3</sub> двохосновна. Належить до кислот середньої сили. У водному розчині дисоціює ступіні часто, в основному за першим ступенем:
| + | У лабораторних умовах оксид сульфуру (IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(IV): |
| - |
| + | |
| | | | |
| - | <br> | + | Na<sub>2</sub>S0<sub>3</sub> + H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + H<sub>2</sub>S0<sub>3</sub> ↓ ↓ H<sub>2</sub>O SO<sub>2</sub>↑ <u>Застосування </u> |
| - |
| + | |
| | | | |
| - | <br> | + | Найважливіша галузь застосування оксиду сульфуру (IV) S0<sub>2</sub> — це виробництво сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. Його використовують також у виробництві сульфітів і гідросульфітів. Сірчистий газ S0<sub>2</sub> здатний знищувати [[Досягнення_в_селекції_рослин,_тварин,_мікроорганізмів|мікроорганізми]] і шкідників сільськогосподарських культур, тому його використовують для обкурювання овочесховищ і з метою перевезення ягід і фруктів. Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфікувальний засіб (для знищення плісені у підвалах, льохах, винних бочках, бродильних чанах). |
| - |
| + | |
| | | | |
| - | I ступінь H<sub>2</sub>SO<sub>3</sub> ⇔H<sup>+ </sup>+ HSO<sub>3</sub><sup><sub></sub>-</sup>
| + | <u>Фізіологічна дія</u> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид сульфуру (IV) S0<sub>2</sub> токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей. Тривала дія навіть малих концентрацій оксиду сульфуру (IV) призводить до виникнення у людини бронхіту, гастриту та інших хвороб у тому числі, можливо, й раку легенів. Оксид сульфуру (IV) S0<sub>2</sub> вважається найнебезпечнішим для здоров'я людини, оскільки викликає загальне ослаблення організму і у поєднанні з іншими забрудниками спричинює скорочення середньої тривалості життя. |
| - |
| + | |
| | | | |
| - | <br> | + | <u>Вплив на навколишнє середовище</u> |
| - |
| + | |
| | | | |
| - | <sup> гідросульфіт-іон</sup>
| + | Діоксид сульфуру S0<sub>2</sub> один з основних забрудників повітря, він отруює навколишнє середовище. |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Звідки ж береться діоксид сульфуру S0<sub>2</sub> у повітрі? |
| - |
| + | |
| | | | |
| - | <br> | + | Природним джерелом S0<sub>2</sub> є окиснення сірководню H<sub>2</sub>S атмосферним киснем й озоном: |
| - |
| + | |
| | | | |
| - | ІІ ступінь HSO<sub>3</sub><sup>- </sup>⇔H<sup>+ </sup>+ SO<sup>2-</sup><sub>3</sub>
| + | 2H<sub>2</sub>S + 30<sub>2</sub> = 2SO<sub>2</sub> + H<sub>2</sub>O H<sub>2</sub>S + O<sub>3</sub> = SO<sub>2 </sub>+ Н<sub>2</sub>0 |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Основними антропогенними джерелами діоксиду сульфуру S0<sub>2</sub> є спалювання палива, виплавляння металів (димові гази), робота автомобільного транспорту (вихлопні гази). |
| - |
| + | |
| | | | |
| - | <br> | + | Діоксид сульфуру S0<sub>2</sub>, потрапляючи у повітря, викликає утворення «кислотних дощів», шкідливих для усього живого. |
| - |
| + | |
| | | | |
| - | <sup> сульфіт-іон</sup>
| + | Як же утворюються «кислотні дощі»? |
| - |
| + | |
| | | | |
| - | <br> | + | В атмосфері діоксид сульфуру S0<sub>2</sub> під впливом незначних кількостей розпорошених металів та їхніх солей (в основному Fe і Мп) окиснюється до триоксиду сульфуру S0<sub>3</sub>: |
| - |
| + | |
| | | | |
| - | <br> | + | 2S0<sub>2</sub> + О<sub>2</sub> ⇔ 2SO<sub>3</sub>, |
| - |
| + | |
| | | | |
| - | <sup></sup>За другим ступенем дисоціація відбувається незначною мірою.<sup></sup>
| + | який взаємодіє з краплинами вологи, утворюючи сторонню для повітря речовину — сульфатну кислоту: |
| - |
| + | |
| | | | |
| - | <br> | + | SO<sub>3</sub> + H<sub>2</sub>O = H<sub>2</sub>S0<sub>4</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Аналогічним чином роблять свій «внесок» у появу «кислотних дощів» й оксиди [[Колообіг_Оксигену,_Нітрогену,_Карбону_в_природі|нітрогену]]: |
| - |
| + | |
| | | | |
| - | Як двохосновна сульфітна кислота H<sub>2</sub>SO<sub>3</sub> може утворювати два ряди солей: а) середні солі — сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал).
| + | 2NO + 0<sub>2</sub> = 2N0<sub>2</sub> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | 2N0<sub>2</sub> + Н<sub>2</sub>0 = HN0<sub>3 </sub>+ HNО<sub>2</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Кислотні опади (дощ, град, сніг тощо) негативно впливають на водні екосистеми, на ріст дерев та сільсько-господарських культур. Вплив кислотних опадів на живі організми, у тому числі на людину, ще недостатньо вивчений. Проте відомо, що в умовах забруднення атмосфери (димовими газами, що утворюються у процесі спалювання палива, або відхідними газами переробки сульфуровмісноі сировини чи викидами металургійних підприємств) не слід ходити під дощем з непокритою головою (це може стати причиною випадання волосся). |
| - |
| + | |
| | | | |
| - | <u>NaOH</u> + <u>SO<sub>2</sub></u> = <u>NaHSO<sub>3</sub></u>
| + | ''Оксид сульфуру (VІ) S0<sub>3</sub> ''(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах. Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту: |
| - |
| + | |
| | | | |
| - | <br> | + | S0<sub>3</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>4</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Він може навіть вбирати вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти. |
| - |
| + | |
| | | | |
| - | <sup>1 моль 1 моль гідросульфіт натрію</sup>
| + | Оксид сульфуру(VI) розчиняється у концентрованій cульфатній кислоті H<sub>2</sub>S0<sub>4</sub>, і цей розчин називається ''олеумом''. |
| - |
| + | |
| | | | |
| - | <br> | + | Знаючи, що S0<sub>3</sub> — типовий кислотний оксид, напишіть рівняння реакцій, характерних для нього. |
| - |
| + | |
| | | | |
| - | <br> | + | Добувають оксид сульфуру(VI) у результаті окиснення S0<sub>2 </sub>киснем повітря (напишіть рівняння реакції). |
| - |
| + | |
| | | | |
| - | <u>2NaOH</u> + <u>SO<sub>2</sub></u> = <u>Na<sub>2</sub>SO<sub>3</sub></u> + <u>H<sub>2</sub>O</u>
| + | За звичайних умов ця реакція відбувається дуже повільно. Значно швидше і легше вона відбувається за температури 450—600 °С і за наявності каталізатора оксиду ванадію(V) V<sub>2</sub>0<sub>5</sub>. |
| - |
| + | |
| | | | |
| - | <br> | + | Застосовується оксид сульфуру(VI) S0<sub>3</sub> у виробництві сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. У лабораторній практиці він використовується як водовбирний засіб. |
| - |
| + | |
| | | | |
| - | <br>
| + | НІТРОГЕН З [[Оксиген._Кисень,_склад_його_молекули,_фізичні_властивості|ОКСИГЕНОМ]] утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5: |
| - |
| + | |
| | | | |
| - | <sup>2 моль 1моль сульфіт натрію</sup>
| + | <sub>+1 +2 +3 +4 +5</sub> <br> |
| - |
| + | |
| | | | |
| - | <br> | + | N<sub>2</sub>0, NO, N<sub>2</sub>0<sub>3</sub>, N0<sub>2</sub>, N<sub>2</sub>O<sub>5</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Різний кількісний склад оксидів нітрогену (і різна їхня будова) зумовлює відмінність їхніх властивостей. |
| - |
| + | |
| | | | |
| - | Це слід брати до уваги під час виконання дослідів та розвязування задач.
| + | Усі оксиди нітрогену дуже отруйні, за винятком N<sub>2</sub>0. |
| - |
| + | |
| | | | |
| - | <br> | + | Серед них розглянемо оксид нітрогену (ІІ) NO та оксид нітрогену (IV) N0<sub>2</sub>. |
| - |
| + | |
| | | | |
| - | <br> | + | ''Оксид нітрогену (ІІ) NO'' — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів. На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N0<sub>2</sub>: 2NO + 0<sub>2 </sub>= 2N0<sub>2</sub> |
| - |
| + | |
| | | | |
| - | Усі сульфіти — нерозчинні солі, за винятком сульфітів лужних металів і амонію.
| + | ''Оксид нітрогену (IV) N02'' — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної: |
| - |
| + | |
| | | | |
| - | <br> | + | 2N0<sub>2</sub> + Н<sub>2</sub>0 = HN0<sub>3</sub> + HN0<sub>2 </sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | За наявності надлишку кисню у воді утворюється тільки нітратна кислота: |
| - |
| + | |
| | | | |
| - | <u>Добування</u>
| + | 4N0<sub>2</sub> + 2Н<sub>2</sub>0 + 0<sub>2</sub> = 4HN0<sub>3</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | Бурий газ N0<sub>2</sub> отруйний, подразнює слизові оболонки очей і дихальних шляхів. Він є шкідливим відходом хімічного виробництва. У вигляді «лисячого хвоста» бурий газ викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого. |
| - |
| + | |
| | | | |
| - | <br> | + | Тепер знайдено ряд хімічних способів боротьби з «лисячими хвостами» й захисту навколишнього середовища. Наприклад, оксид нітрогену(IV), що міститься у відхідних газах, розкладається за допомогою каталізатора (паладований оксид алюмінію) на азот і кисень:<br> |
| - |
| + | |
| | | | |
| - | Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
| + | <sub> АІ2О3, Pd</sub><br> |
| - |
| + | |
| | | | |
| - | <br> | + | 2N0<sub>2</sub> -------> N<sub>2</sub> + 20<sub>2</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Такий спосіб боротьби із забрудненням [[34._Атмосфера,_її_склад_та_будова.|атмосфери]] застосовують нині на багатьох сучасних підприємствах. |
| - |
| + | |
| | | | |
| - | S + O<sub>2</sub> = SO<sub>2</sub>↑
| + | Оксид нітрогену (І) N<sub>2</sub>0 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N<sub>2</sub>0 у суміші з киснем використовується в медицині для наркозу. Не отруйний. Оксид нітрогену(ІІІ) N<sub>2</sub>0<sub>3</sub> — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту: |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | N<sub>2</sub>О<sub>3</sub> + Н<sub>2</sub>О = 2HN0<sub>2</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | Нітритна кислота є слабкою одноосновною кислотою. Її солі — нітри-(наприклад, NaN0<sub>2</sub> — нітрит натрію) отруйні. |
| - |
| + | |
| | | | |
| - | 2Pb + 3O<sub>2</sub> = 2PbO + 2SO<sub>2</sub>↑
| + | Оксид нітрогену(V) N<sub>2</sub>0<sub>5</sub> — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту: |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | N<sub>2</sub>0<sub>5</sub> + H<sub>2</sub>О = 2HN0<sub>3</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | Нітратна кислота являє собою сильну одноосновну кислоту. Її солі — нітрати (наприклад, NaN0<sub>3</sub> — нітрат натрію) також отруйні. |
| - |
| + | |
| | | | |
| - | У лабораторних умовах оксид сульфуру (IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(IV):
| + | З оксидів фосфору (Р<sub>2</sub>0<sub>5</sub> і Р<sub>2</sub>0<sub>3</sub>) найбільше значення має оксид фосфору(V). |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | ''Оксид фосфору (V) Р<sub>2</sub>0<sub>5</sub>'' — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів. Типовий кислотний оксид. Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води: |
| - |
| + | |
| | | | |
| - | <br> | + | Р<sub>2</sub>0<sub>5</sub> + Н<sub>2</sub>0 = 2НР0<sub>3</sub> <sup> </sup><br> |
| - |
| + | |
| | | | |
| - | Na<sub>2</sub>S0<sub>3</sub> + H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + H<sub>2</sub>S0<sub>3</sub>
| + | <sup>холодна метафосфатна кислота</sup> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Р<sub>2</sub>0<sub>5 </sub> + ЗН<sub>2</sub>0 = 2Н<sub>3</sub>Р0<sub>4</sub> <sup> </sup><br> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup> гаряча ортофосфатна кислота</sup> |
| - |
| + | |
| | | | |
| - | ↓ ↓
| + | HPO<sub>3</sub> — найпростіша формула, якою умовно виражають склад метафосфатних кислот — із загальною формулою (НР0<sub>3</sub>)<sub>n</sub>. У даному разі під час взаємодії оксиду фосфору (V) з холодною водою утворюється тетраме-тафосфатна кислота: |
| - | H<sub>2</sub>O SO<sub>2</sub>↑
| + | |
| - |
| + | |
| - | <u>Застосування </u>
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | 2Р<sub>2</sub>0<sub>5 </sub>+ 2Н<sub>2</sub>0 = (НР0<sub>3</sub>)<sub>4</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | • Оксид фосфору(V) і оксид нітрогену(V) — типові кислотні оксиди. Напишіть рівняння їх взаємодії з типовими основними оксидами і лугами. ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди — С0<sub>2</sub> і СО. |
| - |
| + | |
| | | | |
| - | Найважливіша галузь застосування оксиду сульфуру (IV) S0<sub>2</sub> — це виробництво сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. Його використовують також у виробництві сульфітів і гідросульфітів. Сірчистий газ S0<sub>2</sub> здатний знищувати мікроорганізми і шкідників сільськогосподарських культур, тому його використовують для обкурювання овочесховищ і з метою перевезення ягід і фруктів. Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфікувальний засіб (для знищення плісені у підвалах, льохах, винних бочках, бродильних чанах).
| + | С0<sub>2 </sub>— оксид карбону(IV), діоксид карбону, вуглекислий газ; |
| - |
| + | |
| | | | |
| - | <br>
| + | СО — оксид карбону(II), монооксид карбону, чадний газ. |
| - |
| + | |
| | | | |
| - | <br> | + | Для елемента Силіцію характерним є SiO<sub>2</sub> —оксид силіцію(IV), діоксид силіцію, кремнезем. |
| - |
| + | |
| | | | |
| - | <u>Фізіологічна дія</u>
| + | <u>Фізичні властивості</u> |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид карбону(IV), або вуглекислий газ, С0<sub>2</sub> за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С0<sub>2</sub> зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом. |
| - |
| + | |
| | | | |
| - | <br>
| + | Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря. |
| - |
| + | |
| | | | |
| - | Оксид сульфуру (IV) S0<sub>2</sub> токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей. Тривала дія навіть малих концентрацій оксиду сульфуру (IV) призводить до виникнення у людини бронхіту, гастриту та інших хвороб у тому числі, можливо, й раку легенів. Оксид сульфуру (IV) S0<sub>2</sub> вважається найнебезпечнішим для здоров'я людини, оскільки викликає загальне ослаблення організму і у поєднанні з іншими забрудниками спричинює скорочення середньої тривалості життя.
| + | • Обчисліть відносні молекулярні маси вуглекислого та чадного газів і порівняйте їх з усередненою відносною молекулярною масою повітря, яка дорівнює 29. Чи залежить густина газу від його молекулярної маси? |
| - |
| + | |
| | | | |
| - | <br> | + | Вуглекислий газ С0<sub>2</sub> у великих кількостях шкідливий для людіни і тварин, спричинює запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати. |
| - |
| + | |
| | | | |
| - | <br>
| + | Чадний газ СО — дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти! |
| - |
| + | |
| | | | |
| - | <u>Вплив на навколишнє середовище</u>
| + | ''Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Це рівнозначно самогубству! Заслінку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...'' |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид силіцію(ІV) SiO<sub>2</sub>, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (''t''<sub>пл</sub>. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок). |
| - |
| + | |
| | | | |
| - | <br> | + | Чому ж така велика відмінність у властивостях діоксиду силіцію SiO<sub>2</sub> і діоксиду карбону С0<sub>2 </sub>(за звичайних умов С0<sub>2</sub> — газ, а Sі0<sub>2 </sub>— тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами? |
| - |
| + | |
| | | | |
| - | Діоксид сульфуру S0<sub>2</sub> один з основних забрудників повітря, він отруює навколишнє середовище.
| + | Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону (IV) і оксиду силіцію (IV) полягає у відмінності будови цих речовин. Оксид карбону (IV) складається з молекул С0<sub>2</sub>, тобто має молекулярні кристалічні ґратки, а оксид силіцію (IV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по кутах. Це можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:<br> |
| - |
| + | |
| | | | |
| - | <br>
| + | [[Image:2-2..jpg|350px|схема. фото]] |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Звідки ж береться діоксид сульфуру S0<sub>2</sub> у повітрі?
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Природним джерелом S0<sub>2</sub> є окиснення сірководню H<sub>2</sub>S атмосферним киснем й озоном:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2H<sub>2</sub>S + 30<sub>2</sub> = 2SO<sub>2</sub> + H<sub>2</sub>O
| + | |
| - | H<sub>2</sub>S + O<sub>3</sub> = SO<sub>2 </sub>+ Н<sub>2</sub>0
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Основними антропогенними джерелами діоксиду сульфуру S0<sub>2</sub> є спалювання палива, виплавляння металів (димові гази), робота автомобільного транспорту (вихлопні гази).
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Діоксид сульфуру S0<sub>2</sub>, потрапляючи у повітря, викликає утворення «кислотних дощів», шкідливих для усього живого.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Як же утворюються «кислотні дощі»?
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | В атмосфері діоксид сульфуру S0<sub>2</sub> під впливом незначних кількостей розпорошених металів та їхніх солей (в основному Fe і Мп) окиснюється до триоксиду сульфуру S0<sub>3</sub>:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2S0<sub>2</sub> + О<sub>2</sub> ⇔ 2SO<sub>3</sub>,
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | який взаємодіє з краплинами вологи, утворюючи сторонню для повітря речовину — сульфатну кислоту:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | SO<sub>3</sub> + H<sub>2</sub>O = H<sub>2</sub>S0<sub>4</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Аналогічним чином роблять свій «внесок» у появу «кислотних дощів» й оксиди нітрогену:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2NO + 0<sub>2</sub> = 2N0<sub>2</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2N0<sub>2</sub> + Н<sub>2</sub>0 = HN0<sub>3 </sub>+ HNО<sub>2</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Кислотні опади (дощ, град, сніг тощо) негативно впливають на водні екосистеми, на ріст дерев та сільсько-господарських культур. Вплив кислотних опадів на живі організми, у тому числі на людину, ще недостатньо вивчений. Проте відомо, що в умовах забруднення атмосфери (димовими газами, що утворюються у процесі спалювання палива, або відхідними газами переробки сульфуровмісноі сировини чи викидами металургійних підприємств) не слід ходити під дощем з непокритою головою (це може стати причиною випадання волосся).
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''Оксид сульфуру (VІ) S0<sub>3</sub> ''(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах.
| + | |
| - | Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | S0<sub>3</sub> + Н<sub>2</sub>0 = H<sub>2</sub>S0<sub>4</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Він може навіть вбирати вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид сульфуру(VI) розчиняється у концентрованій cульфатній кислоті H<sub>2</sub>S0<sub>4</sub>, і цей розчин називається ''олеумом''.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Знаючи, що S0<sub>3</sub> — типовий кислотний оксид, напишіть рівняння реакцій, характерних для нього.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Добувають оксид сульфуру(VI) у результаті окиснення S0<sub>2 </sub>киснем повітря (напишіть рівняння реакції).
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | За звичайних умов ця реакція відбувається дуже повільно. Значно швидше і легше вона відбувається за температури 450—600 °С і за наявності каталізатора оксиду ванадію(V) V<sub>2</sub>0<sub>5</sub>.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Застосовується оксид сульфуру(VI) S0<sub>3</sub> у виробництві сульфатної кислоти H<sub>2</sub>S0<sub>4</sub>. У лабораторній практиці він використовується як водовбирний засіб.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| | | | |
| | <br> | | <br> |
| - |
| |
| | | | |
| - | <br>
| + | Така будова оксиду силіцію (IV) й обумовлює його високу твердість і тугоплавкість. |
| - | <br>
| + | |
| - |
| + | |
| | | | |
| - | <br>
| + | Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію. |
| - |
| + | |
| | | | |
| - | НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
| + | <u>Хімічні властивості</u><br> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид карбону (ІV) С0<sub>2</sub> і оксид силіцію (ІV) Sі0<sub>2</sub> — солетвірні кислотні оксиди, а оксид карбону (ІІ) СО — несолетвірний оксид. |
| - |
| + | |
| | | | |
| - | <br> | + | ''1. Взаємодія з [[Вода._Акселеративні_методи|водою]]. ''Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С0<sub>2</sub> взаємодіє з водою з утворенням нестійкої карбонатної кислоти: |
| - |
| + | |
| | | | |
| - | <sub>+1 +2 +3 +4 +5</sub>
| + | H<sub>2</sub>O + CO<sub>2</sub> ⇔ H<sub>2</sub>CO<sub>3</sub> |
| - | N<sub>2</sub>0, NO, N<sub>2</sub>0<sub>3</sub>, N0<sub>2</sub>, N<sub>2</sub>O<sub>5</sub>
| + | |
| - |
| + | |
| | | | |
| - | <br>
| + | • Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище: |
| - |
| + | |
| | | | |
| - | <br>
| + | а) підвищуючи тиск; б) підвищуючи температуру. |
| - |
| + | |
| | | | |
| - | Різний кількісний склад оксидів нітрогену (і різна їхня будова) зумовлює відмінність їхніх властивостей.
| + | Оксид силіцію (IV) SiO<sub>2 </sub>хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H<sub>2</sub>Si0<sub>3 </sub>утворюється іншим шляхом (вивчатиметься пізніше). |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | ''2. Взаємодія з [[15._Основи,_їх_склад,_назви|основами]] і основними оксидами.'' Оксид карбону (IV) С0<sub>2</sub> реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати: |
| - |
| + | |
| | | | |
| - | <br> | + | Са(ОН)<sub>2</sub> + С0<sub>2</sub> - СаС0<sub>3</sub>↓ + Н<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | Усі оксиди нітрогену дуже отруйні, за винятком N<sub>2</sub>0.
| + | СаО + С0<sub>2 </sub>= СаС0<sub>3</sub> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид силіцію (IV) Si0<sub>2</sub> взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати: |
| - |
| + | |
| | | | |
| - | <br> | + | 2NaOH + Si0<sub>2</sub> = Na<sub>2</sub>Si0<sub>3</sub> + Н<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | Серед них розглянемо оксид нітрогену (ІІ) NO та оксид нітрогену (IV) N0<sub>2</sub>.
| + | BaO + Si0<sub>2 </sub>= BaSi0<sub>3</sub> |
| - |
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:<br> |
| - |
| + | |
| | | | |
| - | <br>
| + | а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти: |
| - |
| + | |
| | | | |
| - | ''Оксид нітрогену (ІІ) NO'' — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів. На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N0<sub>2</sub>:
| + | 2СО + О = 2С0<sub>2</sub>, Δ''H ''= -572 кДж, |
| - |
| + | |
| | | | |
| - | <br>
| + | через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві); б) здатність відновлювати метали з оксидів (під час нагрівання): |
| - |
| + | |
| | | | |
| - | <br> | + | Fe<sub>3</sub>0<sub>4 </sub>+ 4СО = 3Fe + 4С0<sub>2</sub>↑ |
| - |
| + | |
| | | | |
| - | 2NO + 0<sub>2 </sub>= 2N0<sub>2</sub>
| + | Зазначена властивість використовується під час виплавляння металів із руд. |
| - |
| + | |
| | | | |
| - | <br> | + | ''Добування оксиду карбону(ІУ).'' У лабораторних умовах С0<sub>2 </sub>добувають дією хлоридної кислоти на мармур: |
| - |
| + | |
| | | | |
| - | <br> | + | СаС0<sub>3 </sub>+ 2НСl = СаСl<sub>2</sub> + Н<sub>2</sub>0 + С0<sub>2</sub>↑ |
| - |
| + | |
| | | | |
| - | ''Оксид нітрогену (IV) N02'' — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної:
| + | • Запишіть рівняння даної реакції у повній і скороченій йонних формах. |
| - |
| + | |
| | | | |
| - | <br>
| + | У промисловості оксид карбону(ІV) добувають прожарюванням вапняку: |
| - |
| + | |
| | | | |
| - | <br> | + | СаС0<sub>3</sub> = СаО + С0<sub>2</sub>↑ |
| - |
| + | |
| | | | |
| - | 2N0<sub>2</sub> + Н<sub>2</sub>0 = HN0<sub>3</sub> + HN0<sub>2 </sub>
| + | ''Застосування.'' Вуглекислий газ С0<sub>2</sub> застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються. |
| - |
| + | |
| | | | |
| - | <br> | + | Діоксид силіцію SiO<sub>2</sub> у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів<sup>1</sup>. У вигляді кварцу Sі0<sub>2</sub> використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі0<sub>2</sub> («біла сажа») застосовується як наповнювач у виробництві гуми. |
| - |
| + | |
| | | | |
| - | <br>
| + | ''Абразиви'' (фр. ''abrasif'' — шліфувальний, від лат. ''abrado'' — зіскоблюю) — природні або штучні матеріали високої твердості. |
| - |
| + | |
| | | | |
| - | За наявності надлишку кисню у воді утворюється тільки нітратна кислота:
| + | СУЛЬФАТНА КИСЛОТА H<sub>2</sub>S0<sub>4</sub> (безводна, 100%-ва) — важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H<sub>2</sub>S0<sub>4</sub>) = 98%) за звичайних умов 1,84 г/см<sup>3</sup>. Вона нелетка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що може призвести до закипання води і розбризкування кислоти. |
| - |
| + | |
| | | | |
| - | <br>
| + | Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг. А якщо це сталося, треба швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою. Пам'ятайте таке правило: |
| - |
| + | |
| | | | |
| - | <br>
| + | ''не можна воду доливати до концентрованої сульфатної кислоти! Для розбавляння кислоту треба доливати до води невеликими порціями.'' |
| - |
| + | |
| | | | |
| - | 4N0<sub>2</sub> + 2Н<sub>2</sub>0 + 0<sub>2</sub> = 4HN0<sub>3</sub>
| + | Хімічні властивості сульфатної кислоти багато в чому залежать від її концентрації. В лабораторіях та промисловості використовують розбавлену і концентровану сульфатну кислоту, хоча такий поділ дещо умовний. |
| - |
| + | |
| | | | |
| - | <br>
| + | Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот. |
| - |
| + | |
| | | | |
| - | <br>
| + | 1. ''Дисоціація кислоти''. Сульфатна кислота двохосновна, належить до сильних кислот. У водних розчинах вона дисоціює на йони за двома ступенями (за першим — практично повністю): |
| - |
| + | |
| | | | |
| - | Бурий газ N0<sub>2</sub> отруйний, подразнює слизові оболонки очей і дихальних шляхів. Він є шкідливим відходом хімічного виробництва. У вигляді «лисячого хвоста» бурий газ викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого.
| + | I ступінь Н<sub>2</sub>S0<sub>4</sub> ⇔ Н<sup>+</sup>+ НSО<sup>-</sup><sub>4</sub> — гідросульфат-іон <br> |
| - |
| + | |
| | | | |
| - | <br> | + | II ступінь НS0<sup><sub>-</sub></sup><sub>4</sub> ⇔ Н<sup>+</sup> + S0<sup>2</sup><sup>-</sup><sub>4</sub> — сульфат-іон |
| - |
| + | |
| | | | |
| - | <br> | + | Ось чому в процесі нейтралізації розчинів сульфатної кислоти Н<sub>2</sub>S0<sub>4 </sub>утворюються два ряди солей: середні солі — сульфати і кислі солі — гідросульфати. |
| - |
| + | |
| | | | |
| - | Тепер знайдено ряд хімічних способів боротьби з «лисячими хвостами» й захисту навколишнього середовища. Наприклад, оксид нітрогену(IV), що міститься у відхідних газах, розкладається за допомогою каталізатора (паладований оксид алюмінію) на азот і кисень:
| + | 2. ''Взаємодія з основами''. Якщо у пробірку з розбавленою сульфатною кислотою добавити дві-три краплі фіолетового лакмусу, розчин набуває червоного забарвлення (кисле середовище). Потім у цю пробірку доливатимемо краплями розчин гідроксиду натрію доти, доки вміст пробірки набуде фіолетового забарвлення (нейтральне середовище):<br> |
| - |
| + | |
| | | | |
| - | <br> | + | 2NaОН + Н<sub>2</sub>S0<sub>4</sub> = <u>Nа<sub>2</sub>SО</u><sub><u>4</u></sub> + 2Н<sub>2</sub>0<br> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup></sup><sup>сульфат натрію</sup> |
| - |
| + | |
| | | | |
| - | <sub> АІ2О3, Pd</sub>
| + | Якщо ж розчину лугу Na0Н не вистачає для нейтралізації усієї кислоти, то сіль, що утворюється, буде кислою: |
| - |
| + | |
| | | | |
| - | <br> | + | Na0H + Н<sub>2</sub>S0<sub>4</sub> = <u>NаНS0<sub>4</sub></u> + Н<sub>2</sub>0 <br> |
| - |
| + | |
| | | | |
| - | <br> | + | <sup>гідросульфат </sup><sup> натрію</sup> |
| - |
| + | |
| | | | |
| - | 2N0<sub>2</sub> -------> N<sub>2</sub> + 20<sub>2</sub>
| + | Отже, гідросульфати утворюються тоді, коли кислота береться у надлишку. |
| - |
| + | |
| | | | |
| - | <br> | + | Більшість сульфатів добре розчиняються у воді. Малорозчинним є сульфат кальцію CaS0<sub>4</sub>, ще менше розчиняється сульфат плюмбуму PbS0<sub>4</sub> і практично нерозчинній є сульфат барію BaS0<sub>4</sub> (див. таблицю розчинності). |
| - |
| + | |
| | | | |
| - | <br>
| + | 3. ''Взаємодія з [[Відео_до_уроку:_Багатоманітність_речовин._Прості_й_складні_речовини._Метали_й_неметали|оксидами металів]]''. Сульфатна кислота реагує з основними та амфотерними оксидами, утворюючі солі, наприклад: |
| - |
| + | |
| | | | |
| - | Такий спосіб боротьби із забрудненням атмосфери застосовують нині на багатьох сучасних підприємствах.
| + | MgO + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | <br> | + | ZnO + H<sub>2</sub>S0<sub>4</sub> = ZnS0<sub>4</sub> + H<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | <br>
| + | 4. ''Взаємодія з [[14._Солі_(середні),_їх_склад,_назви|солями]]''. Сульфатна кислота сильна і нелетка, одна з найстійкіших із відомих мінеральних кислот. Вона може вступати в реакцію обміну з солями, утвореними слабкішими або леткими кислотами і навіть сильними кислотами, якщо вони менш стійкі: |
| - |
| + | |
| | | | |
| - | Оксид нітрогену (І) N<sub>2</sub>0 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N<sub>2</sub>0 у суміші з киснем використовується в медицині для наркозу. Не отруйний. Оксид нітрогену(ІІІ) N<sub>2</sub>0<sub>3</sub> — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
| + | Na<sub>2</sub>C0<sub>3 </sub>+ H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + С0<sub>2</sub><span lang="EN-US">↑</span> + H<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | <br> | + | 2KN0<sub>3</sub> + H<sub>2</sub>S0<sub>4</sub> = K<sub>2</sub>S0<sub>4</sub> + 2HN0<sub>3</sub><span lang="EN-US">↑</span> |
| - |
| + | |
| | | | |
| - | <br> | + | 2KCl0<sub>4 </sub>+ H<sub>2</sub>S0<sub>4</sub> = K<sub>2</sub>S0<sub>4</sub> + 2HCl0<sub>4</sub> |
| - |
| + | |
| | | | |
| - | N<sub>2</sub>О<sub>3</sub> + Н<sub>2</sub>О = 2HN0<sub>2</sub>
| + | BaCl<sub>2 </sub>+ H<sub>2</sub>S0<sub>4</sub> = BaS0<sub>4</sub>↓+ 2НСl<span lang="EN-US">↑</span> |
| - |
| + | |
| | | | |
| - | <br> | + | Останнє рівняння відображує якісну реакцію на кислоту та її солі, бо утворюється нерозчинний у воді сульфат барію BaS0<sub>4</sub>. |
| - |
| + | |
| | | | |
| - | <br>
| + | Сульфатна кислота може взаємодіяти із своїми солями — сульфатами. При цьому середні солі — сульфати перетворюються на кислі солі гідросульфати: |
| - |
| + | |
| | | | |
| - | Нітритна кислота є слабкою одноосновною кислотою. Її солі — нітри-(наприклад, NaN0<sub>2</sub> — нітрит натрію) отруйні.
| + | Na<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>S0<sub>4</sub> = 2NaHS0<sub>4</sub> |
| - |
| + | |
| | | | |
| - | <br>
| + | Усі реакції, рівняння яких наведені у пункті 4, є реакціями йонного обміну. Напишіть їх у повній і скороченій йонних формах. |
| - |
| + | |
| | | | |
| - | <br>
| + | ''Лабораторна робота 2 '' |
| - |
| + | |
| | | | |
| - | Оксид нітрогену(V) N<sub>2</sub>0<sub>5</sub> — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту:
| + | <u>Визначення сульфат-іонів у [[Конспект_уроку_на_тему_«Вода_–_найпоширеніша_речовина_на_Землі._Розчини_у_природі_та_побуті,_приготування_розчинів»|розчині]]</u> |
| - |
| + | |
| | | | |
| - | <br>
| + | Налийте у першу пробірку трохи розбавленої сульфатної кислоти, у другу — розчину сульфату натрію, у третю — розчину нітрату натрію. До кожної з пробірок додайте кілька крапель розчину хлориду барію (або нітрату барію). Що спостерігається? До білого осаду, що утворився у двох пробірках (чому?), додайте по кілька крапель розбавленої нітратної кислоти. |
| - |
| + | |
| | | | |
| - | <br> | + | Якщо осад не розчиняється, то це — сульфат барію BaS0<sub>4</sub>. Він свідчить про те, що в цих пробірках розчини містили йони S0<sub>4</sub><sup>2-</sup>. |
| - |
| + | |
| | | | |
| - | N<sub>2</sub>0<sub>5</sub> + H<sub>2</sub>О = 2HN0<sub>3</sub>
| + | Напишіть рівняння здійснених реакцій у молекулярній, повній і скороченій йонних формах. |
| - |
| + | |
| | | | |
| - | <br> | + | Отже, про наявність у розчині сульфатної кислоти та її солей можна робити висновок на підставі утворення білого осаду BaS0<sub>4</sub>, який практично не розчиняється ні у воді, ні в нітратній кислоті. |
| - |
| + | |
| | | | |
| - | <br> | + | Таким чином, реактивом на сульфат-іони S0<sup>2-</sup><sub>4</sub> є йони барію Ва<sup>2+</sup>: |
| - |
| + | |
| | | | |
| - | Нітратна кислота являє собою сильну одноосновну кислоту. Її солі — нітрати (наприклад, NaN0<sub>3</sub> — нітрат натрію) також отруйні.
| + | Ва<sup>2+</sup> + SO<sup>2-</sup><sub>4</sub> = BaS0<sub>4</sub>↓<br> 5. ''Взаємодія з металами''. Розбавлена сульфатна кислота реагує, наприклад, з магнієм, цинком, залізом з виділенням водню: |
| - |
| + | |
| | | | |
| - | <br> | + | Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub><span lang="EN-US">↑</span> |
| - |
| + | |
| | | | |
| - | <br> | + | Zn + H<sub>2</sub>S0<sub>4</sub> = ZnSO<sub>4</sub> + H<sub>2</sub><span lang="EN-US">↑</span> |
| - |
| + | |
| | | | |
| - | З оксидів фосфору (Р<sub>2</sub>0<sub>5</sub> і Р<sub>2</sub>0<sub>3</sub>) найбільше значення має оксид фосфору(V).
| + | Fe + H<sub>2</sub>S0<sub>4</sub> = FeS0<sub>4</sub> + H<sub>2</sub><span lang="EN-US">↑</span> |
| - |
| + | |
| | | | |
| - | <br>
| + | Малоактивні метали (мідь, срібло, золото) з розбавленою сульфатною кислотою не реагують. |
| - |
| + | |
| | | | |
| - | <br>
| + | Концентрована сульфатна кислота — сильний окисник. Вона може взаємодіяти з малоактивними металами, наприклад з міддю: |
| - |
| + | |
| | | | |
| - | ''Оксид фосфору (V) Р<sub>2</sub>0<sub>5</sub>'' — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів. Типовий кислотний оксид. Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
| + | <sub> 0 +6 +2 +4</sub> |
| - |
| + | |
| | | | |
| - | <br> | + | Cu + 2H<sub>2</sub>S0<sub>4</sub> = CuS0<sub>4</sub> + S0<sub>2</sub><span lang="EN-US">↑</span> + 2Н<sub>2</sub>0 |
| - |
| + | |
| | | | |
| - | <br> | + | <sub> 0 </sub> <sub>- </sub> <sub> окиснення</sub> <sub> +2</sub> |
| - |
| + | |
| | | | |
| - | Р<sub>2</sub>0<sub>5</sub> + Н<sub>2</sub>0 = 2НР0<sub>3</sub>
| + | Cu - 2''e'' ------------------------> Cu |
| - | <sup> холодна метафосфатна кислота</sup>
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | <sup>Відновник</sup> |
| - |
| + | |
| | | | |
| - | <br> | + | <sub>+6 </sub> <sub>- </sub> <sub>відновлення +4</sub> |
| - |
| + | |
| | | | |
| - | Р<sub>2</sub>0<sub>5 </sub> + ЗН<sub>2</sub>0 = 2Н<sub>3</sub>Р0<sub>4</sub>
| + | S + 2e -------------------------> S |
| - | <sup> гаряча ортофосфатна
| + | |
| - | кислота</sup>
| + | |
| - |
| + | |
| | | | |
| - | <br> | + | <sup>Окисник</sup> |
| - |
| + | |
| | | | |
| - | <br> | + | Зверніть увагу: під час взаємодії концентрованої сульфатної кислоти з малоактивними металами відновлюється не Гідроген кислоти, а Сульфур, тому газоподібний водень Н<sub>2</sub> не виділяється! |
| - |
| + | |
| | | | |
| - | HPO<sub>3</sub> — найпростіша формула, якою умовно виражають склад метафосфатних кислот — із загальною формулою (НР0<sub>3</sub>)<sub>n</sub>. У даному разі під час взаємодії оксиду фосфору (V) з холодною водою утворюється тетраме-тафосфатна кислота:
| + | '''ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ''' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''1. Схарактеризуйте оксид сульфуру(ІV). З якою метою він використовується? На яких властивостях ґрунтується його використання? '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''2. Обчисліть густину за повітрям і масу 1 л сірчистого газу (н.у.). Зробіть висновок, чи можна збирати SO<sub>2</sub> у циліндр витісненням повітря. '' |
| - |
| + | |
| | | | |
| - | 2Р<sub>2</sub>0<sub>5 </sub>+ 2Н<sub>2</sub>0 = (НР0<sub>3</sub>)<sub>4</sub>
| + | ''3. Яка фізіологічна дія оксиду сульфуру(IV)? '' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''4. Що вам відомо про сульфітну кислоту? Чому її розчин треба оберігати від доступу повітря? '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''5. Чому внаслідок пропускання S0<sub>2 </sub>крізь вапняну воду вона так само стає каламутною, як і внаслідок пропускання вуглекисло газу? Напишіть відповідні рівняння реакцій. '' |
| - |
| + | |
| | | | |
| - | • Оксид фосфору(V) і оксид нітрогену(V) — типові кислотні оксиди. Напишіть рівняння їх взаємодії з типовими основними оксидами і лугами.
| + | ''6. Наведіть рівняння реакції добування сульфіту барію розчинних солей. '' |
| - |
| + | |
| - |
| + | |
| - | ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди — С0<sub>2</sub> і СО.
| + | |
| - |
| + | |
| | | | |
| - | <br>
| + | ''7. Який об'єм діоксиду сульфуру (н. у.) можна добути внаслідок розкладання під час нагрівання сульфіту магнію масою 650кг з масовою часткою домішок 20 %? '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''8. Чи вистачить 14 м<sup>3</sup> кисню для окиснення 30 м<sup>3 </sup>діоксиду сульфуру за нормальних умов? '' |
| - |
| + | |
| | | | |
| - | С0<sub>2 </sub>— оксид карбону(IV), діоксид карбону, вуглекислий газ;
| + | ''9. Визначте об'ємні частки оксиду сульфуру(IV) і кисню суміші (н. у.), якщо з 200 мл її після реакції утворилось 0,438г оксиду сульфуру(VI). Візьміть до уваги, що S0<sub>2</sub> прореагував повністю. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''10. Порівняйте фізичні властивості діоксиду карбону С0<sub>2</sub> й монооксиду карбону CO. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''11. Схарактеризуйте фізичні властивості діоксиду силіцію SiO<sub>2</sub>. '' |
| - |
| + | |
| | | | |
| - | СО — оксид карбону(II), монооксид карбону, чадний газ.
| + | ''12. Під час спалювання оксиду карбону (ІІ) об'ємом 112 л (н. у.) утворюється оксид карбону (IV) об'ємом (а) 28 л; (в) 112 л; (б) 56 л; (г) 224 л. '' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''13. В результаті окиснення вуглецю кількістю речовини 4 моль утворюється оксид карбону (ІІ) об'ємом (н. у.) (а) 22,4 л; (в) 11,2 л; (б) 89,6 л; (г) 5,6 л. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''14. Прожарюванням вапняку масою 250 кг, масова частка домішок в якому 20 %, можна добути вуглекислий газ об'ємом (н.у.) (а) 44,8 м<sup>3</sup>; (в) 89,6 м<sup>3</sup>; (б) 22,4 м<sup>3</sup>; (г) 112 м<sup>3</sup>. '' |
| - |
| + | |
| | | | |
| - | Для елемента Силіцію характерним є SiO<sub>2</sub> —оксид силіцію(IV), діоксид силіцію, кремнезем.
| + | ''15. У лабораторії для добування чистого силіцію використовують кварцовий пісок і магній. З підпалюванням суміші утворюється білий порошок оксиду магнію та кристалічний силіцій. Напишіть рівняння реакції і запропонуйте спосіб очищення силіцію від домішки оксиду магнію. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''16. Під час відновлення вуглецем у дугових печах за 1800 <sup>0</sup>С 1 кг оксиду силіцію (ІV), масова частка домішок в якому 10 % можна добути кристалічний силіцій масою (а) 28 г; (в) 840 г; (б) 280 г; (г) 420 г. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''17. Суміш оксиду карбону (ІІ) СО й оксиду карбону (ІV) С0<sub>2</sub> об'ємом 16 мл (н. у.) спалили в надлишку кисню, після чого об'єм суміші зменшився на 2 мл. Обчисліть масову частку СО в суміші. '' |
| - |
| + | |
| | | | |
| - | <u>Фізичні властивості</u>
| + | ''18. Схарактеризуйте фізичні й хімічні властивості суліфатної кислоти. Напишіть відповідні рівняння реакцій. '' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''19. У чому подібність і відмінність властивостей суліфатної кислоти і властивостей інших відомих вам кислот, наприклад хлоридної? '' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''20. Сульфатну кислоту нейтралізують розчином гідроксиду кальцію. Як піде процес нейтралізації за наявності надлишку: а) гідроксиду кальцію; б) сульфатної кислоти? Напишіть, відповідні рівняння реакцій і назвіть утворені солі. '' |
| - |
| + | |
| | | | |
| - | Оксид карбону(IV), або вуглекислий газ, С0<sub>2</sub> за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С0<sub>2</sub> зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
| + | ''21. Щоб утворилася кисла сіль — гідросульфіт натрію, з їдким натром масою 20 г мас прореагувати оксид сульфуру (ІV) об'ємом (н. у.) (а) 11,2 л; (в) 33,6 л; (б) 22,4 л; (г) 44,8 л. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''22. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: Н<sub>2</sub>S0<sub>4</sub><sub> </sub><sub> ↓ </sub> ZnS → S0<sub>2</sub> → КНS0<sub>3</sub> '' |
| - |
| + | |
| | | | |
| - | <br>
| + | ''23. В одній пробірці міститься розчин сульфатної кислоти, в іншій — хлоридної. Як розпізнати, де яка кислота міститься? '' |
| - |
| + | |
| | | | |
| - | Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря.
| + | ''24. Для добування оксиду карбону(IV) на карбонат кальцію діють хлоридною кислотою. Чому для цієї мети не можна використати сульфатну кислоту? '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''25. Як здійснити такі перетворення: S → S02 → SОз → Н<sub>2</sub>S0<sub>4</sub> → Fе<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>'' |
| - |
| + | |
| | | | |
| - | <br> | + | '' ↓ ↑ РЬS — Na<sub>2</sub>S0<sub>4</sub> → NаНS0<sub>4</sub> ?'' |
| - |
| + | |
| | | | |
| - | • Обчисліть відносні молекулярні маси вуглекислого та чадного газів і порівняйте їх з усередненою відносною молекулярною масою повітря, яка дорівнює 29. Чи залежить густина газу від його молекулярної маси?
| + | ''Напишіть рівняння реакцій. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''26. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: S → FeS → Н<sub>2</sub>S → S0<sub>2</sub> →Na<sub>2</sub>S0<sub>3</sub> → Na<sub>2</sub>S0<sub>4</sub> → ВаS0<sub>4</sub>. '' |
| - |
| + | |
| | | | |
| - | <br> | + | ''27. Визначте масу розчину хлориду барію з масовою часткою ВаСl<sub>2</sub> 10 %, необхідного для осадження сульфат-іонів, які містяться у 5 г розчину сульфату натрію з масовою часткою Na<sub>2</sub>S0<sub>4</sub> 6 %. Яка маса утвореного осаду? '' |
| - |
| + | |
| | | | |
| - | Вуглекислий газ С0<sub>2</sub> у великих кількостях шкідливий для людіни і тварин, спричинює запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
| + | ''28. До розчину сульфату купруму (ІІ) масою 62 г з масовою часткою СuS0<sub>4</sub> 5 % долили розчин хлориду барію масою 31,2 г з масовою часткою ВаСl<sub>2</sub> 20 %. Осад відфільтрували. Які речовини і якої маси містяться у фільтраті? Визначте їхню масу.'' |
| - |
| + | |
| | | | |
| - | <br>
| |
| - |
| |
| | | | |
| - | <br>
| |
| - |
| |
| | | | |
| - | Чадний газ СО — дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
| + | ''Н.М. Буринська, Л.П. Величко, [[Хімія_10_клас|Хімія, 10 клас]]''[[Хімія_10_клас|Хімія_10_клас]] |
| - |
| + | |
| | | | |
| - | <br>
| + | ''Вислано читачами з інтернет-сайтів '' |
| - |
| + | |
| | | | |
| - | <br> | + | <br> |
| - |
| + | |
| | | | |
| - | ''Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Це рівнозначно самогубству! Заслінку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...''
| + | <sub>Скачати підручники та [[Гіпермаркет Знань - перший в світі!|книги онлайн]], планування [[Хімія|з хімії]], курси та завдання [[Хімія 10 клас|з хімії для 10 класу]]</sub> |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид силіцію(ІV) SiO<sub>2</sub>, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (''t''<sub>пл</sub>. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Чому ж така велика відмінність у властивостях діоксиду силіцію SiO<sub>2</sub> і діоксиду карбону С0<sub>2 </sub>(за звичайних умов
| + | |
| - | С0<sub>2</sub> — газ, а Sі0<sub>2 </sub>— тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами?
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону (IV) і оксиду силіцію (IV) полягає у відмінності будови цих речовин. Оксид карбону (IV) складається з молекул С0<sub>2</sub>, тобто має молекулярні кристалічні ґратки, а оксид силіцію (IV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по кутах. Це можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | [[Image:2-2..jpg]]
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Така будова оксиду силіцію (IV) й обумовлює його високу твердість і тугоплавкість.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <u>Хімічні властивості</u>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид карбону (ІV) С0<sub>2</sub> і оксид силіцію (ІV) Sі0<sub>2</sub> — солетвірні кислотні оксиди, а оксид карбону (ІІ) СО — несолетвірний оксид.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''1. Взаємодія з водою. ''Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С0<sub>2</sub> взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | H<sub>2</sub>O + CO<sub>2</sub> ⇔ H<sub>2</sub>CO<sub>3</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | • Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | а) підвищуючи тиск; б) підвищуючи температуру.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид силіцію (IV) SiO<sub>2 </sub>хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H<sub>2</sub>Si0<sub>3 </sub>утворюється іншим шляхом (вивчатиметься пізніше).
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''2. Взаємодія з основами і основними оксидами.'' Оксид карбону (IV) С0<sub>2</sub> реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Са(ОН)<sub>2</sub> + С0<sub>2</sub> - СаС0<sub>3</sub>↓ + Н<sub>2</sub>0
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | СаО + С0<sub>2 </sub>= СаС0<sub>3</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид силіцію (IV) Si0<sub>2</sub> взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2NaOH + Si0<sub>2</sub> = Na<sub>2</sub>Si0<sub>3</sub> + Н<sub>2</sub>0
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | BaO + Si0<sub>2 </sub>= BaSi0<sub>3</sub>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | 2СО + О = 2С0<sub>2</sub>, Δ''H ''= -572 кДж,
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві);
| + | |
| - | б) здатність відновлювати метали з оксидів (під час нагрівання):
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Fe<sub>3</sub>0<sub>4 </sub>+ 4СО = 3Fe + 4С0<sub>2</sub>↑
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Зазначена властивість використовується під час виплавляння металів із руд.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''Добування оксиду карбону(ІУ).'' У лабораторних умовах С0<sub>2 </sub>добувають дією хлоридної кислоти на мармур:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | СаС0<sub>3 </sub>+ 2НСl = СаСl<sub>2</sub> + Н<sub>2</sub>0 + С0<sub>2</sub>↑
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | • Запишіть рівняння даної реакції у повній і скороченій йонних формах.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | СаС0<sub>3</sub> = СаО + С0<sub>2</sub>↑
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''Застосування.'' Вуглекислий газ С0<sub>2</sub> застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | Діоксид силіцію SiO<sub>2</sub> у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів<sup>1</sup>. У вигляді кварцу Sі0<sub>2</sub> використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі0<sub>2</sub> («біла сажа») застосовується як наповнювач у виробництві гуми.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | ''Абразиви'' (фр. ''abrasif'' — шліфувальний, від лат. ''abrado'' — зіскоблюю) — природні або штучні матеріали високої твердості.
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - | <br>
| + | |
| - |
| + | |
| | | | |
| | <br> | | <br> |
| - |
| |
| | | | |
| - | <br>
| |
| - | <br>
| |
| - |
| |
| | | | |
| - | <br>
| |
| - |
| |
| - |
| |
| - | СУЛЬФАТНА КИСЛОТА H<sub>2</sub>S0<sub>4</sub> (безводна, 100%-ва) — важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H<sub>2</sub>S0<sub>4</sub>) = 98%) за звичайних умов 1,84 г/см<sup>3</sup>. Вона нелетка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що може призвести до закипання води і розбризкування кислоти.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг. А якщо це сталося, треба швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою.
| |
| - |
| |
| - | Пам'ятайте таке правило:
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | ''не можна воду доливати до концентрованої сульфатної кислоти! Для розбавляння кислоту треба доливати до води невеликими порціями.''
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Хімічні властивості сульфатної кислоти багато в чому залежать від її концентрації. В лабораторіях та промисловості використовують розбавлену і концентровану сульфатну кислоту, хоча такий поділ дещо умовний.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 1. ''Дисоціація кислоти''. Сульфатна кислота двохосновна, належить до сильних кислот. У водних розчинах вона дисоціює на йони за двома ступенями (за першим — практично повністю):
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | I ступінь Н<sub>2</sub>S0<sub>4</sub> ⇔ Н<sup>+</sup>+ НSО<sup>-</sup><sub>4</sub> — гідросульфат-іон
| |
| - | II ступінь НS0<sup><sub>-</sub></sup><sub>4</sub> ⇔ Н<sup>+</sup> + S0<sup>2</sup><sup>-</sup><sub>4</sub> — сульфат-іон
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Ось чому в процесі нейтралізації розчинів сульфатної кислоти Н<sub>2</sub>S0<sub>4 </sub>утворюються два ряди солей: середні солі — сульфати і кислі солі — гідросульфати.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 2. ''Взаємодія з основами''. Якщо у пробірку з розбавленою сульфатною кислотою добавити дві-три краплі фіолетового лакмусу, розчин набуває червоного забарвлення (кисле середовище). Потім у цю пробірку доливатимемо краплями розчин гідроксиду натрію доти, доки вміст пробірки набуде фіолетового забарвлення (нейтральне середовище):
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 2NaОН + Н<sub>2</sub>S0<sub>4</sub> = <u>Nа<sub>2</sub>SО</u><sub><u>4</u></sub> + 2Н<sub>2</sub>0
| |
| - | <sup>сульфат натрію</sup>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Якщо ж розчину лугу Na0Н не вистачає для нейтралізації усієї кислоти, то сіль, що утворюється, буде кислою:
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Na0H + Н<sub>2</sub>S0<sub>4</sub> = <u>NаНS0<sub>4</sub></u> + Н<sub>2</sub>0
| |
| - | <sup></sup> <sup>гідросульфат </sup>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sup> натрію</sup>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Отже, гідросульфати утворюються тоді, коли кислота береться у надлишку.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Більшість сульфатів добре розчиняються у воді. Малорозчинним є сульфат кальцію CaS0<sub>4</sub>, ще менше розчиняється сульфат плюмбуму PbS0<sub>4</sub> і практично нерозчинній є сульфат барію BaS0<sub>4</sub> (див. таблицю розчинності).
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 3. ''Взаємодія з оксидами металів''. Сульфатна кислота реагує з основними та амфотерними оксидами, утворюючі солі, наприклад:
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | MgO + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub>0
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | ZnO + H<sub>2</sub>S0<sub>4</sub> = ZnS0<sub>4</sub> + H<sub>2</sub>0
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 4. ''Взаємодія з солями''. Сульфатна кислота сильна і нелетка, одна з найстійкіших із відомих мінеральних кислот. Вона може вступати в реакцію обміну з солями, утвореними слабкішими або леткими кислотами і навіть сильними кислотами, якщо вони менш стійкі:
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Na<sub>2</sub>C0<sub>3 </sub>+ H<sub>2</sub>S0<sub>4</sub> = Na<sub>2</sub>S0<sub>4</sub> + С0<sub>2</sub><span lang="EN-US">↑</span> + H<sub>2</sub>0
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 2KN0<sub>3</sub> + H<sub>2</sub>S0<sub>4</sub> = K<sub>2</sub>S0<sub>4</sub> + 2HN0<sub>3</sub><span lang="EN-US">↑</span>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 2KCl0<sub>4 </sub>+ H<sub>2</sub>S0<sub>4</sub> = K<sub>2</sub>S0<sub>4</sub> + 2HCl0<sub>4</sub>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | BaCl<sub>2 </sub>+ H<sub>2</sub>S0<sub>4</sub> = BaS0<sub>4</sub>↓+ 2НСl<span lang="EN-US">↑</span>
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Останнє рівняння відображує якісну реакцію на кислоту та її солі, бо утворюється нерозчинний у воді сульфат барію BaS0<sub>4</sub>.
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Сульфатна кислота може взаємодіяти із своїми солями — сульфатами. При цьому середні солі — сульфати перетворюються на кислі солі гідросульфати:
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Na<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>S0<sub>4</sub> = 2NaHS0<sub>4</sub>
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Усі реакції, рівняння яких наведені у пункті 4, є реакціями йонного обміну. Напишіть їх у повній і скороченій йонних формах.
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | ''Лабораторна робота 2 ''
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <u>Визначення сульфат-іонів у розчині</u>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Налийте у першу пробірку трохи розбавленої сульфатної кислоти, у другу — розчину сульфату натрію, у третю — розчину нітрату натрію. До кожної з пробірок додайте кілька крапель розчину хлориду барію (або нітрату барію). Що спостерігається? До білого осаду, що утворився у двох пробірках (чому?), додайте по кілька крапель розбавленої нітратної кислоти.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Якщо осад не розчиняється, то це — сульфат барію BaS0<sub>4</sub>. Він свідчить про те, що в цих пробірках розчини містили йони S0<sub>4</sub><sup>2-</sup>.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Напишіть рівняння здійснених реакцій у молекулярній, повній і скороченій йонних формах.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Отже, про наявність у розчині сульфатної кислоти та її солей можна робити висновок на підставі утворення білого осаду BaS0<sub>4</sub>, який практично не розчиняється ні у воді, ні в нітратній кислоті.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Таким чином, реактивом на сульфат-іони S0<sup>2-</sup><sub>4</sub> є йони барію Ва<sup>2+</sup>:
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Ва<sup>2+</sup> + SO<sup>2-</sup><sub>4</sub> = BaS0<sub>4</sub>↓
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 5. ''Взаємодія з металами''. Розбавлена сульфатна кислота реагує, наприклад, з магнієм, цинком, залізом з виділенням
| |
| - | водню:
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Mg + H<sub>2</sub>S0<sub>4</sub> = MgS0<sub>4</sub> + Н<sub>2</sub><span lang="EN-US">↑</span>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Zn + H<sub>2</sub>S0<sub>4</sub> = ZnSO<sub>4</sub> + H<sub>2</sub><span lang="EN-US">↑</span>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Fe + H<sub>2</sub>S0<sub>4</sub> = FeS0<sub>4</sub> + H<sub>2</sub><span lang="EN-US">↑</span>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Малоактивні метали (мідь, срібло, золото) з розбавленою сульфатною кислотою не реагують.
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Концентрована сульфатна кислота — сильний окисник. Вона може взаємодіяти з малоактивними металами, наприклад з міддю:
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sub> 0 +6 +2 +4</sub>
| |
| - | Cu + 2H<sub>2</sub>S0<sub>4</sub> = CuS0<sub>4</sub> + S0<sub>2</sub><span lang="EN-US">↑</span> + 2Н<sub>2</sub>0
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sub> 0 </sub> <sub>- </sub> <sub> окиснення</sub> <sub> +2</sub>
| |
| - | Cu - 2''e'' ------------------------> Cu
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sup>Відновник</sup>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sub>+6 </sub> <sub>- </sub> <sub>відновлення +4</sub>
| |
| - | S + 2e -------------------------> S
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sup>Окисник</sup>
| |
| - |
| |
| - | Зверніть увагу: під час взаємодії концентрованої сульфатної кислоти з малоактивними металами відновлюється не Гідроген кислоти, а Сульфур, тому газоподібний водень Н<sub>2</sub> не виділяється!
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <u></u><u>ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ</u>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | 1. Схарактеризуйте оксид сульфуру(ІV). З якою метою він використовується? На яких властивостях ґрунтується його використання?
| |
| - | 2. Обчисліть густину за повітрям і масу 1 л сірчистого газу (н.у.). Зробіть висновок, чи можна збирати SO<sub>2</sub> у циліндр витісненням повітря.
| |
| - | 3. Яка фізіологічна дія оксиду сульфуру(IV)?
| |
| - | 4. Що вам відомо про сульфітну кислоту? Чому її розчин треба оберігати від доступу повітря?
| |
| - | 5. Чому внаслідок пропускання S0<sub>2 </sub>крізь вапняну воду вона так само стає каламутною, як і внаслідок пропускання вуглекисло газу? Напишіть відповідні рівняння реакцій.
| |
| - | 6. Наведіть рівняння реакції добування сульфіту барію розчинних солей.
| |
| - | 7. Який об'єм діоксиду сульфуру (н. у.) можна добути внаслідок розкладання під час нагрівання сульфіту магнію масою 650кг з масовою часткою домішок 20 %?
| |
| - | 8. Чи вистачить 14 м<sup>3</sup> кисню для окиснення 30 м<sup>3 </sup>діоксиду сульфуру за нормальних умов?
| |
| - | 9. Визначте об'ємні частки оксиду сульфуру(IV) і кисню суміші (н. у.), якщо з 200 мл її після реакції утворилось 0,438г оксиду сульфуру(VI). Візьміть до уваги, що S0<sub>2</sub> прореагував повністю. <u></u>
| |
| - | 10. Порівняйте фізичні властивості діоксиду карбону С0<sub>2</sub> й монооксиду карбону CO.
| |
| - | 11. Схарактеризуйте фізичні властивості діоксиду силіцію SiO<sub>2</sub>.
| |
| - | 12. Під час спалювання оксиду карбону (ІІ) об'ємом 112 л (н. у.) утворюється оксид карбону (IV) об'ємом
| |
| - | (а) 28 л; (в) 112 л;
| |
| - | (б) 56 л; (г) 224 л.
| |
| - | 13. В результаті окиснення вуглецю кількістю речовини 4 моль утворюється оксид карбону (ІІ) об'ємом (н. у.)
| |
| - | (а) 22,4 л; (в) 11,2 л;
| |
| - | (б) 89,6 л; (г) 5,6 л.
| |
| - | 14. Прожарюванням вапняку масою 250 кг, масова частка домішок в якому 20 %, можна добути вуглекислий газ об'ємом
| |
| - | (н.у.)
| |
| - | (а) 44,8 м<sup>3</sup>; (в) 89,6 м<sup>3</sup>;
| |
| - | (б) 22,4 м<sup>3</sup>; (г) 112 м<sup>3</sup>.
| |
| - | 15. У лабораторії для добування чистого силіцію використовують кварцовий пісок і магній. З підпалюванням суміші утворюється білий порошок оксиду магнію та кристалічний силіцій. Напишіть рівняння реакції і запропонуйте спосіб очищення силіцію від домішки оксиду магнію.
| |
| - | 16. Під час відновлення вуглецем у дугових печах за 1800 <sup>0</sup>С 1 кг оксиду силіцію (ІV), масова частка домішок в якому 10 %
| |
| - | можна добути кристалічний силіцій масою
| |
| - | (а) 28 г; (в) 840 г;
| |
| - | (б) 280 г; (г) 420 г.
| |
| - | 17. Суміш оксиду карбону (ІІ) СО й оксиду карбону (ІV) С0<sub>2</sub> об'ємом 16 мл (н. у.) спалили в надлишку кисню, після чого об'єм суміші зменшився на 2 мл. Обчисліть масову частку СО в суміші.
| |
| - | 18. Схарактеризуйте фізичні й хімічні властивості суліфатної кислоти. Напишіть відповідні рівняння реакцій.
| |
| - | 19. У чому подібність і відмінність властивостей суліфатної кислоти і властивостей інших відомих вам кислот, наприклад
| |
| - | хлоридної?
| |
| - | 20. Сульфатну кислоту нейтралізують розчином гідроксиду кальцію. Як піде процес нейтралізації за наявності надлишку: а) гідроксиду кальцію; б) сульфатної кислоти? Напишіть, відповідні рівняння реакцій і назвіть утворені солі.
| |
| - | 21. Щоб утворилася кисла сіль — гідросульфіт натрію, з їдким натром масою 20 г мас прореагувати оксид сульфуру (ІV) об'ємом
| |
| - | (н. у.)
| |
| - | (а) 11,2 л; (в) 33,6 л;
| |
| - | (б) 22,4 л; (г) 44,8 л.
| |
| - | 22. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
| |
| - | Н<sub>2</sub>S0<sub>4</sub>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sub> ↓ </sub>
| |
| - | ZnS → S0<sub>2</sub> → КНS0<sub>3</sub>
| |
| - | 23. В одній пробірці міститься розчин сульфатної кислоти, в іншій — хлоридної. Як розпізнати, де яка кислота міститься?
| |
| - | 24. Для добування оксиду карбону(IV) на карбонат кальцію діють хлоридною кислотою. Чому для цієї мети не можна використати сульфатну кислоту?
| |
| - | 25. Як здійснити такі перетворення:
| |
| - | S → S02 → SОз → Н<sub>2</sub>S0<sub>4</sub> → Fе<sub>2</sub>(S0<sub>4</sub>)<sub>3</sub>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | ↓ ↑
| |
| - | РЬS — Na<sub>2</sub>S0<sub>4</sub> → NаНS0<sub>4</sub> ?
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | Напишіть рівняння реакцій.
| |
| - | 26. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
| |
| - | S → FeS → Н<sub>2</sub>S → S0<sub>2</sub> →Na<sub>2</sub>S0<sub>3</sub> → Na<sub>2</sub>S0<sub>4</sub> → ВаS0<sub>4</sub>.
| |
| - | 27. Визначте масу розчину хлориду барію з масовою часткою ВаСl<sub>2</sub> 10 %, необхідного для осадження сульфат-іонів, які містяться у 5 г розчину сульфату натрію з масовою часткою Na<sub>2</sub>S0<sub>4</sub> 6 %. Яка маса утвореного осаду?
| |
| - | 28. До розчину сульфату купруму (ІІ) масою 62 г з масовою часткою СuS0<sub>4</sub> 5 % долили розчин хлориду барію масою 31,2 г з масовою часткою ВаСl<sub>2</sub> 20 %. Осад відфільтрували. Які речовини і якої маси містяться у фільтраті? Визначте їхню масу.
| |
| - |
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | ''Н.М. Буринська, Л.П. Величко, Хімія, 10 клас''
| |
| - | Вислано читачами з інтернет-сайтів
| |
| - |
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <sub>Скачати підручники та [[Гіпермаркет Знань - перший в світі!|книги онлайн]], планування [[Хімія|з хімії]], курси та завдання [[Хімія 10 клас|з хімії для 10 класу]]</sub>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| | | | |
| | <br> | | <br> |
| - |
| |
| - |
| |
| - | <br>
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - | <br>
| |
| - |
| |
| - |
| |
| - | <br>
| |
| - |
| |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| Строка 1795: |
Строка 474: |
| | | | |
| | <br> Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. | | <br> Если у вас есть исправления или предложения к данному уроку, [http://xvatit.com/index.php?do=feedback напишите нам]. |
| - |
| |
| | | | |
| - | <br> | + | <br> |
| - | <br>
| + | |
| - |
| + | |
| - | | + | |
| - |
| + | |
| - |
| + | |
| - |
| + | |
| | | | |
| | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. | | Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - [http://xvatit.com/forum/ Образовательный форум]. |
Версия 19:39, 14 августа 2012
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Оксиди неметалічних елементів. Сульфатна кислота і сульфати
ОКСИДИ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. КИСЛОТНИЙ ХАРАКТЕР ОКСИДІВ ТА ГІДРАТІВ ОКСИДІВ НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. СУЛЬФАТНА КИСЛОТА І СУЛЬФАТИ. НАЙВАЖЛИВІШІ ПРИРОДНІ СУЛЬФАТИ, ЯКІСНА РЕАКЦІЯ НА СУЛЬФАТ-ІОН
СУЛЬФУР утворює два кислотні оксиди: оксид сульфуру (ІV) S02 і оксид сульфуру(VI) S03. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
Оксид сульфуру(IV) SO2 (діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02). Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 ⇔ H2S03
Сульфітна кислота H2S03 — дуже нетривка сполука. Існує тільки у водних розчинах. За спроб виділити її розкладається на оксид сульфуру(ІV) і воду. Легко поглинає з повітря кисень і повільно окиснюється у сульфатну кислоту:
2H2S03 + 02 = 2H2S04
Сульфітна кислота H2S03 двохосновна. Належить до кислот середньої сили. У водному розчині дисоціює ступіні часто, в основному за першим ступенем:
I ступінь H2SO3 ⇔H+ + HSO3-
гідросульфіт-іон
ІІ ступінь HSO3- ⇔H+ + SO2-3
сульфіт-іон
За другим ступенем дисоціація відбувається незначною мірою.
Як двохосновна сульфітна кислота H2SO3 може утворювати два ряди солей: а) середні солі — сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал).
NaOH + SO2 = NaHSO3
1 моль 1 моль гідросульфіт натрію
2NaOH + SO2 = Na2SO3 + H2O
2 моль 1моль сульфіт натрію
Це слід брати до уваги під час виконання дослідів та розвязування задач.
Усі сульфіти — нерозчинні солі, за винятком сульфітів лужних металів і амонію.
Добування
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
У лабораторних умовах оксид сульфуру (IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(IV):
Na2S03 + H2S04 = Na2S04 + H2S03 ↓ ↓ H2O SO2↑ Застосування
Найважливіша галузь застосування оксиду сульфуру (IV) S02 — це виробництво сульфатної кислоти H2S04. Його використовують також у виробництві сульфітів і гідросульфітів. Сірчистий газ S02 здатний знищувати мікроорганізми і шкідників сільськогосподарських культур, тому його використовують для обкурювання овочесховищ і з метою перевезення ягід і фруктів. Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфікувальний засіб (для знищення плісені у підвалах, льохах, винних бочках, бродильних чанах).
Фізіологічна дія
Оксид сульфуру (IV) S02 токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей. Тривала дія навіть малих концентрацій оксиду сульфуру (IV) призводить до виникнення у людини бронхіту, гастриту та інших хвороб у тому числі, можливо, й раку легенів. Оксид сульфуру (IV) S02 вважається найнебезпечнішим для здоров'я людини, оскільки викликає загальне ослаблення організму і у поєднанні з іншими забрудниками спричинює скорочення середньої тривалості життя.
Вплив на навколишнє середовище
Діоксид сульфуру S02 один з основних забрудників повітря, він отруює навколишнє середовище.
Звідки ж береться діоксид сульфуру S02 у повітрі?
Природним джерелом S02 є окиснення сірководню H2S атмосферним киснем й озоном:
2H2S + 302 = 2SO2 + H2O H2S + O3 = SO2 + Н20
Основними антропогенними джерелами діоксиду сульфуру S02 є спалювання палива, виплавляння металів (димові гази), робота автомобільного транспорту (вихлопні гази).
Діоксид сульфуру S02, потрапляючи у повітря, викликає утворення «кислотних дощів», шкідливих для усього живого.
Як же утворюються «кислотні дощі»?
В атмосфері діоксид сульфуру S02 під впливом незначних кількостей розпорошених металів та їхніх солей (в основному Fe і Мп) окиснюється до триоксиду сульфуру S03:
2S02 + О2 ⇔ 2SO3,
який взаємодіє з краплинами вологи, утворюючи сторонню для повітря речовину — сульфатну кислоту:
SO3 + H2O = H2S04
Аналогічним чином роблять свій «внесок» у появу «кислотних дощів» й оксиди нітрогену:
2NO + 02 = 2N02
2N02 + Н20 = HN03 + HNО2
Кислотні опади (дощ, град, сніг тощо) негативно впливають на водні екосистеми, на ріст дерев та сільсько-господарських культур. Вплив кислотних опадів на живі організми, у тому числі на людину, ще недостатньо вивчений. Проте відомо, що в умовах забруднення атмосфери (димовими газами, що утворюються у процесі спалювання палива, або відхідними газами переробки сульфуровмісноі сировини чи викидами металургійних підприємств) не слід ходити під дощем з непокритою головою (це може стати причиною випадання волосся).
Оксид сульфуру (VІ) S03 (триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах. Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
S03 + Н20 = H2S04
Він може навіть вбирати вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти.
Оксид сульфуру(VI) розчиняється у концентрованій cульфатній кислоті H2S04, і цей розчин називається олеумом.
Знаючи, що S03 — типовий кислотний оксид, напишіть рівняння реакцій, характерних для нього.
Добувають оксид сульфуру(VI) у результаті окиснення S02 киснем повітря (напишіть рівняння реакції).
За звичайних умов ця реакція відбувається дуже повільно. Значно швидше і легше вона відбувається за температури 450—600 °С і за наявності каталізатора оксиду ванадію(V) V205.
Застосовується оксид сульфуру(VI) S03 у виробництві сульфатної кислоти H2S04. У лабораторній практиці він використовується як водовбирний засіб.
НІТРОГЕН З ОКСИГЕНОМ утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Різний кількісний склад оксидів нітрогену (і різна їхня будова) зумовлює відмінність їхніх властивостей.
Усі оксиди нітрогену дуже отруйні, за винятком N20.
Серед них розглянемо оксид нітрогену (ІІ) NO та оксид нітрогену (IV) N02.
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів. На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02: 2NO + 02 = 2N02
Оксид нітрогену (IV) N02 — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної:
2N02 + Н20 = HN03 + HN02
За наявності надлишку кисню у воді утворюється тільки нітратна кислота:
4N02 + 2Н20 + 02 = 4HN03
Бурий газ N02 отруйний, подразнює слизові оболонки очей і дихальних шляхів. Він є шкідливим відходом хімічного виробництва. У вигляді «лисячого хвоста» бурий газ викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого.
Тепер знайдено ряд хімічних способів боротьби з «лисячими хвостами» й захисту навколишнього середовища. Наприклад, оксид нітрогену(IV), що міститься у відхідних газах, розкладається за допомогою каталізатора (паладований оксид алюмінію) на азот і кисень:
АІ2О3, Pd
2N02 -------> N2 + 202
Такий спосіб боротьби із забрудненням атмосфери застосовують нині на багатьох сучасних підприємствах.
Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N20 у суміші з киснем використовується в медицині для наркозу. Не отруйний. Оксид нітрогену(ІІІ) N203 — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
N2О3 + Н2О = 2HN02
Нітритна кислота є слабкою одноосновною кислотою. Її солі — нітри-(наприклад, NaN02 — нітрит натрію) отруйні.
Оксид нітрогену(V) N205 — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту:
N205 + H2О = 2HN03
Нітратна кислота являє собою сильну одноосновну кислоту. Її солі — нітрати (наприклад, NaN03 — нітрат натрію) також отруйні.
З оксидів фосфору (Р205 і Р203) найбільше значення має оксид фосфору(V).
Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів. Типовий кислотний оксид. Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна кислота
HPO3 — найпростіша формула, якою умовно виражають склад метафосфатних кислот — із загальною формулою (НР03)n. У даному разі під час взаємодії оксиду фосфору (V) з холодною водою утворюється тетраме-тафосфатна кислота:
2Р205 + 2Н20 = (НР03)4
• Оксид фосфору(V) і оксид нітрогену(V) — типові кислотні оксиди. Напишіть рівняння їх взаємодії з типовими основними оксидами і лугами. ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди — С02 і СО.
С02 — оксид карбону(IV), діоксид карбону, вуглекислий газ;
СО — оксид карбону(II), монооксид карбону, чадний газ.
Для елемента Силіцію характерним є SiO2 —оксид силіцію(IV), діоксид силіцію, кремнезем.
Фізичні властивості
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого час-тина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря.
• Обчисліть відносні молекулярні маси вуглекислого та чадного газів і порівняйте їх з усередненою відносною молекулярною масою повітря, яка дорівнює 29. Чи залежить густина газу від його молекулярної маси?
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин, спричинює запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
Чадний газ СО — дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Це рівнозначно самогубству! Заслінку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
Чому ж така велика відмінність у властивостях діоксиду силіцію SiO2 і діоксиду карбону С02 (за звичайних умов С02 — газ, а Sі02 — тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами?
Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону (IV) і оксиду силіцію (IV) полягає у відмінності будови цих речовин. Оксид карбону (IV) складається з молекул С02, тобто має молекулярні кристалічні ґратки, а оксид силіцію (IV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по кутах. Це можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:
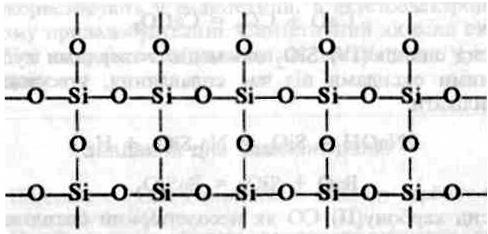
Така будова оксиду силіцію (IV) й обумовлює його високу твердість і тугоплавкість.
Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію.
Хімічні властивості
Оксид карбону (ІV) С02 і оксид силіцію (ІV) Sі02 — солетвірні кислотні оксиди, а оксид карбону (ІІ) СО — несолетвірний оксид.
1. Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
• Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище:
а) підвищуючи тиск; б) підвищуючи температуру.
Оксид силіцію (IV) SiO2 хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H2Si03 утворюється іншим шляхом (вивчатиметься пізніше).
2. Взаємодія з основами і основними оксидами. Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, ΔH = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві); б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.
Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
• Запишіть рівняння даної реакції у повній і скороченій йонних формах.
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів1. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.
Абразиви (фр. abrasif — шліфувальний, від лат. abrado — зіскоблюю) — природні або штучні матеріали високої твердості.
СУЛЬФАТНА КИСЛОТА H2S04 (безводна, 100%-ва) — важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2S04) = 98%) за звичайних умов 1,84 г/см3. Вона нелетка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що може призвести до закипання води і розбризкування кислоти.
Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг. А якщо це сталося, треба швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою. Пам'ятайте таке правило:
не можна воду доливати до концентрованої сульфатної кислоти! Для розбавляння кислоту треба доливати до води невеликими порціями.
Хімічні властивості сульфатної кислоти багато в чому залежать від її концентрації. В лабораторіях та промисловості використовують розбавлену і концентровану сульфатну кислоту, хоча такий поділ дещо умовний.
Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот.
1. Дисоціація кислоти. Сульфатна кислота двохосновна, належить до сильних кислот. У водних розчинах вона дисоціює на йони за двома ступенями (за першим — практично повністю):
I ступінь Н2S04 ⇔ Н++ НSО-4 — гідросульфат-іон
II ступінь НS0-4 ⇔ Н+ + S02-4 — сульфат-іон
Ось чому в процесі нейтралізації розчинів сульфатної кислоти Н2S04 утворюються два ряди солей: середні солі — сульфати і кислі солі — гідросульфати.
2. Взаємодія з основами. Якщо у пробірку з розбавленою сульфатною кислотою добавити дві-три краплі фіолетового лакмусу, розчин набуває червоного забарвлення (кисле середовище). Потім у цю пробірку доливатимемо краплями розчин гідроксиду натрію доти, доки вміст пробірки набуде фіолетового забарвлення (нейтральне середовище):
2NaОН + Н2S04 = Nа2SО4 + 2Н20
сульфат натрію
Якщо ж розчину лугу Na0Н не вистачає для нейтралізації усієї кислоти, то сіль, що утворюється, буде кислою:
Na0H + Н2S04 = NаНS04 + Н20
гідросульфат натрію
Отже, гідросульфати утворюються тоді, коли кислота береться у надлишку.
Більшість сульфатів добре розчиняються у воді. Малорозчинним є сульфат кальцію CaS04, ще менше розчиняється сульфат плюмбуму PbS04 і практично нерозчинній є сульфат барію BaS04 (див. таблицю розчинності).
3. Взаємодія з оксидами металів. Сульфатна кислота реагує з основними та амфотерними оксидами, утворюючі солі, наприклад:
MgO + H2S04 = MgS04 + Н20
ZnO + H2S04 = ZnS04 + H20
4. Взаємодія з солями. Сульфатна кислота сильна і нелетка, одна з найстійкіших із відомих мінеральних кислот. Вона може вступати в реакцію обміну з солями, утвореними слабкішими або леткими кислотами і навіть сильними кислотами, якщо вони менш стійкі:
Na2C03 + H2S04 = Na2S04 + С02↑ + H20
2KN03 + H2S04 = K2S04 + 2HN03↑
2KCl04 + H2S04 = K2S04 + 2HCl04
BaCl2 + H2S04 = BaS04↓+ 2НСl↑
Останнє рівняння відображує якісну реакцію на кислоту та її солі, бо утворюється нерозчинний у воді сульфат барію BaS04.
Сульфатна кислота може взаємодіяти із своїми солями — сульфатами. При цьому середні солі — сульфати перетворюються на кислі солі гідросульфати:
Na2SO4 + H2S04 = 2NaHS04
Усі реакції, рівняння яких наведені у пункті 4, є реакціями йонного обміну. Напишіть їх у повній і скороченій йонних формах.
Лабораторна робота 2
Визначення сульфат-іонів у розчині
Налийте у першу пробірку трохи розбавленої сульфатної кислоти, у другу — розчину сульфату натрію, у третю — розчину нітрату натрію. До кожної з пробірок додайте кілька крапель розчину хлориду барію (або нітрату барію). Що спостерігається? До білого осаду, що утворився у двох пробірках (чому?), додайте по кілька крапель розбавленої нітратної кислоти.
Якщо осад не розчиняється, то це — сульфат барію BaS04. Він свідчить про те, що в цих пробірках розчини містили йони S042-.
Напишіть рівняння здійснених реакцій у молекулярній, повній і скороченій йонних формах.
Отже, про наявність у розчині сульфатної кислоти та її солей можна робити висновок на підставі утворення білого осаду BaS04, який практично не розчиняється ні у воді, ні в нітратній кислоті.
Таким чином, реактивом на сульфат-іони S02-4 є йони барію Ва2+:
Ва2+ + SO2-4 = BaS04↓
5. Взаємодія з металами. Розбавлена сульфатна кислота реагує, наприклад, з магнієм, цинком, залізом з виділенням водню:
Mg + H2S04 = MgS04 + Н2↑
Zn + H2S04 = ZnSO4 + H2↑
Fe + H2S04 = FeS04 + H2↑
Малоактивні метали (мідь, срібло, золото) з розбавленою сульфатною кислотою не реагують.
Концентрована сульфатна кислота — сильний окисник. Вона може взаємодіяти з малоактивними металами, наприклад з міддю:
0 +6 +2 +4
Cu + 2H2S04 = CuS04 + S02↑ + 2Н20
0 - окиснення +2
Cu - 2e ------------------------> Cu
Відновник
+6 - відновлення +4
S + 2e -------------------------> S
Окисник
Зверніть увагу: під час взаємодії концентрованої сульфатної кислоти з малоактивними металами відновлюється не Гідроген кислоти, а Сульфур, тому газоподібний водень Н2 не виділяється!
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Схарактеризуйте оксид сульфуру(ІV). З якою метою він використовується? На яких властивостях ґрунтується його використання?
2. Обчисліть густину за повітрям і масу 1 л сірчистого газу (н.у.). Зробіть висновок, чи можна збирати SO2 у циліндр витісненням повітря.
3. Яка фізіологічна дія оксиду сульфуру(IV)?
4. Що вам відомо про сульфітну кислоту? Чому її розчин треба оберігати від доступу повітря?
5. Чому внаслідок пропускання S02 крізь вапняну воду вона так само стає каламутною, як і внаслідок пропускання вуглекисло газу? Напишіть відповідні рівняння реакцій.
6. Наведіть рівняння реакції добування сульфіту барію розчинних солей.
7. Який об'єм діоксиду сульфуру (н. у.) можна добути внаслідок розкладання під час нагрівання сульфіту магнію масою 650кг з масовою часткою домішок 20 %?
8. Чи вистачить 14 м3 кисню для окиснення 30 м3 діоксиду сульфуру за нормальних умов?
9. Визначте об'ємні частки оксиду сульфуру(IV) і кисню суміші (н. у.), якщо з 200 мл її після реакції утворилось 0,438г оксиду сульфуру(VI). Візьміть до уваги, що S02 прореагував повністю.
10. Порівняйте фізичні властивості діоксиду карбону С02 й монооксиду карбону CO.
11. Схарактеризуйте фізичні властивості діоксиду силіцію SiO2.
12. Під час спалювання оксиду карбону (ІІ) об'ємом 112 л (н. у.) утворюється оксид карбону (IV) об'ємом (а) 28 л; (в) 112 л; (б) 56 л; (г) 224 л.
13. В результаті окиснення вуглецю кількістю речовини 4 моль утворюється оксид карбону (ІІ) об'ємом (н. у.) (а) 22,4 л; (в) 11,2 л; (б) 89,6 л; (г) 5,6 л.
14. Прожарюванням вапняку масою 250 кг, масова частка домішок в якому 20 %, можна добути вуглекислий газ об'ємом (н.у.) (а) 44,8 м3; (в) 89,6 м3; (б) 22,4 м3; (г) 112 м3.
15. У лабораторії для добування чистого силіцію використовують кварцовий пісок і магній. З підпалюванням суміші утворюється білий порошок оксиду магнію та кристалічний силіцій. Напишіть рівняння реакції і запропонуйте спосіб очищення силіцію від домішки оксиду магнію.
16. Під час відновлення вуглецем у дугових печах за 1800 0С 1 кг оксиду силіцію (ІV), масова частка домішок в якому 10 % можна добути кристалічний силіцій масою (а) 28 г; (в) 840 г; (б) 280 г; (г) 420 г.
17. Суміш оксиду карбону (ІІ) СО й оксиду карбону (ІV) С02 об'ємом 16 мл (н. у.) спалили в надлишку кисню, після чого об'єм суміші зменшився на 2 мл. Обчисліть масову частку СО в суміші.
18. Схарактеризуйте фізичні й хімічні властивості суліфатної кислоти. Напишіть відповідні рівняння реакцій.
19. У чому подібність і відмінність властивостей суліфатної кислоти і властивостей інших відомих вам кислот, наприклад хлоридної?
20. Сульфатну кислоту нейтралізують розчином гідроксиду кальцію. Як піде процес нейтралізації за наявності надлишку: а) гідроксиду кальцію; б) сульфатної кислоти? Напишіть, відповідні рівняння реакцій і назвіть утворені солі.
21. Щоб утворилася кисла сіль — гідросульфіт натрію, з їдким натром масою 20 г мас прореагувати оксид сульфуру (ІV) об'ємом (н. у.) (а) 11,2 л; (в) 33,6 л; (б) 22,4 л; (г) 44,8 л.
22. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: Н2S04 ↓ ZnS → S02 → КНS03
23. В одній пробірці міститься розчин сульфатної кислоти, в іншій — хлоридної. Як розпізнати, де яка кислота міститься?
24. Для добування оксиду карбону(IV) на карбонат кальцію діють хлоридною кислотою. Чому для цієї мети не можна використати сульфатну кислоту?
25. Як здійснити такі перетворення: S → S02 → SОз → Н2S04 → Fе2(S04)3
↓ ↑ РЬS — Na2S04 → NаНS04 ?
Напишіть рівняння реакцій.
26. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення: S → FeS → Н2S → S02 →Na2S03 → Na2S04 → ВаS04.
27. Визначте масу розчину хлориду барію з масовою часткою ВаСl2 10 %, необхідного для осадження сульфат-іонів, які містяться у 5 г розчину сульфату натрію з масовою часткою Na2S04 6 %. Яка маса утвореного осаду?
28. До розчину сульфату купруму (ІІ) масою 62 г з масовою часткою СuS04 5 % долили розчин хлориду барію масою 31,2 г з масовою часткою ВаСl2 20 %. Осад відфільтрували. Які речовини і якої маси містяться у фільтраті? Визначте їхню масу.
Н.М. Буринська, Л.П. Величко, Хімія, 10 класХімія_10_клас
Вислано читачами з інтернет-сайтів
Скачати підручники та книги онлайн, планування з хімії, курси та завдання з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|












