|
Гипермаркет знаний>>Химия>>Химия 8 класс. Полные уроки>>Химия: Основания. Полные уроки
Цели урока:
Задачи урока:
• обучающие: сформировать знания о составе оснований, валентности гидроксильной группы, физических свойствах, применении и получении; • развивающие: содействовать развитию познавательной активности, умению задумываться над причинами его изменения; • воспитательные: воспитание положительной мотивации к обучению.
Основные термины:
Ход урока:
Проверка домашнего задания.
1. Какие вещества называются кислотами? 2. Какие вещества называются солями? 3. Что называют бинарными соединениями? 4. Что такое оксиды? Приведите пример. 5. К какому бинарному соединению относится вода? 6. Что такое летучие водородные соединения и где он используются? Приведите примеры. 7. К какому бинарному соединению относится аммиак? 8. К какому бинарному соединению относится углекислый газ? 9. На доске записаны формулы: NaCl, K2O, H2S, KNO3, H3PO4, SO3, HNO3, P2O4, CuSO4. Выпишите: а) оксиды; б) кислоты; в) соли.
Основания.
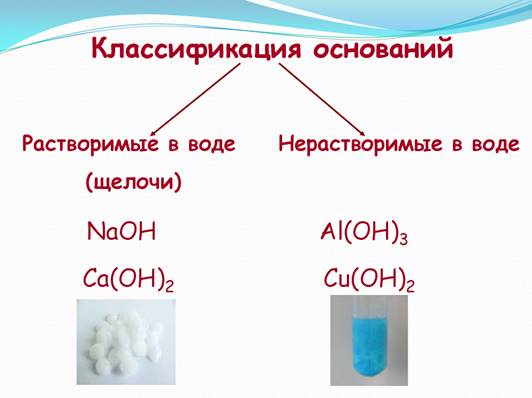
Основаниями называют сложные вещества, в состав которых входят атомы металлов и гидроксогруппы (ОН). Гидроксогруппа образуется из молекулы воды. Иными словами, молекулы оснований содержат атомы металла и атомы кислорода и водорода в виде гидроксогруппы – ОН. Особенности группы ОН (рисунок 1): 1. Эта группа является остатком от молекулы воды Н-Он, если мысленно отнять от нее один атом водорода, то останется группа –ОН 2. Гидроксогруппа представляет собой ион с зарядом -1. 3. Группа ОН- является сложным ионом, т.е. имеет общий электрический заряд и состоит из двух элементов. Рис. 1. Особенности группы OH. Давайте посмотрим, как составлять названия оснований на рисунке 2. Рис. 2. Название оснований. Далее мы должны познакомиться с физическими свойствами оснований. Основания — это твердые вещества. Растворимые в воде основания называются щелочами. Однако большинство оснований в воде не растворяются. Найдите в таблице растворимости примеры щелочей и нерастворимых оснований. Т.е. основания могут быть как растворимыми в воде, так и нерастворимые (рисунок 3). Рис. 3. Классификация оснований. Химические свойства нерастворимых оснований представлены на видео:
Щелочи - едкие вещества. Они разъедают кожу и ткани. Поэтому технические названия некоторых из них указывают на это свойство. Например: NаОН - едкий натр, КОН- едкий кали. Обращаться со щелочами нужно очень осторожно (рисунок 4). Рис. 4. Щелочь. Давайте посмотрим, как можно получить щелочь:
Техника безопасности при работе со щелочами: 1. Щелочи оказывают на организм в основном локальное действие, вызывал омертвление только тех участков кожного покрова, на которые они попали. Однако в дальнейшем организм испытывает общее отравление в результате всасывания в кровь продуктов взаимодействия мышечных тканей и щелочей. Действие щелочей, особенно концентрированных, характеризуются значительной глубиной проникновения, поскольку они растворяют белок. В связи с этим очень опасно попадание щелочей в глаза: при запоздалой первой помощи возможна полная потеря зрения. 2. Твердые щелочи очень гигроскопичны. Хранить твердые щелочи следует в емкостях из полиэтилена или в толстостенных широкогорлых стеклянных банках. 3. При проведении экспериментов твердые вещества берите из баночек только сухой ложкой или пробиркой. Наливайте жидкость и насыпайте твердые вещества в пробирку осторожно. Предварительно проверьте, не разбито ли у пробирки дно и не имеет ли она трещин. 4. Закончив работу, вымойте посуду. Банки и склянки закрывайте теми же пробками или крышками, какими они были закрыты. Пробки открываемых склянок ставьте на стол только тем концом, который не входил в горлышко склянки. 5. В случае ожога, пореза или попадания едкой и горячей жидкости на кожу или одежду немедленно обращайтесь к учителю или лаборанту. 6. При попадании щелочи на кожу необходимо промыть пораненное место обильной струей воды. Щелочь смывается плохо, промывание должно быть продолжительным (10-15 мин) и тщательным. 7. При попадании щелочи в глаза их необходимо тщательно промыть 0,2 % раствором борной кислоты. Щелочи можно распознать индикаторами (от лат. – указатели) (рисунок 5). Рис.5. Понятие индикаторов.
Рис. 6. Окраска индикаторов в различных средах. На рисунке 7 показан пример распознавания щелочи. Рис. 7. Распознавание растворов щелочи, кислоты и воды с помощью лакмуса. Давайте посмотрим, как же с помощью индикатора распознали щелочь:
И напоследок давайте посмотрим, как распознать NaOH в домашних условиях:
Выводы.
1. Основания – это сложные вещества, состоящие из ионов металлов и гидроксид-ионов. Примеры формул оснований: KOH, Mg(OH)2. 2. Основания бывают однокислотные и многокислотные. Однокислотные – основания, в формулах которых указан один гидроксид-ион: KOH, NaOH. Многокислотные – основания, в формулах которых два и более гидроксид-ионов: Ca(OH)2. 3. Все основания – твердые вещества. Поэтому их разделяют не по агрегатному состоянию, а по растворимости в воде. По этому признаку основания подразделяют на две группы - растворимые и нерастворимые основания. 4. Растворимые (их называют щелочами). Такие основания образуют металлы главной подгруппы I группы – Li, Na, K, Rb, Cs, Fr (эти металлы называют щелочными), а также некоторые металлы главной подгруппы II группы - Ca, Sr, Ba (эти металлы называют щелочно-земельными).
Контролирующий блок.
1. Что такое основания? 2. Какие по растворимости бывают основания? 3. Каким оксидам соответствуют основания?
Домашнее задание.
1. Составьте основания из оксидов: ZnO, Li2O, MgO. 2. Попробуйте сами составить оксиды из оснований: CuOH, Cu(OH)2. 3. Составить формулы по названиям: гидроксида калия, гидроксид кальция, гидроксид железа(III)
Интересно знать, что.
• Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь. Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя. • Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы. • Также основание можно получить при взаимодействия щелочного или щелочноземельного металла с водой. • Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей: • Некоторые основания можно получить обменными реакциями: • Основания металлов встречаются в природе в виде минералов, например: гидраргиллита Al(OH)3, брусита Mg(OH)2.
Список литературы:
1. Урок на тему «Основания. Химические свойства оснований» Шух Л.Ю., учитель химии, МОУ «СОШ № 56», г.Новокузнецк. 2. Урок на тему «Химические свойства оснований» Смирнова И.Г., учитель химии, МОУ СОШ №3. 3. Урок на тему «Основания» Иванов Н.В., учитель химии. 4. Минченков Е.Е., Зазнобина Л.С., Смирнова Т.В. “Химия: Учебник для 8-го класса средней общеобразовательной школы”. Москва, Школьная пресса, 2002 г.
Отредактировано и выслано Борисенко И.Н.
Над уроком работали: Шух Л.Ю. Смирнова И.Г. Иванов Н.В. Борисенко И.Н.
|
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: