|
|
|
| Строка 3: |
Строка 3: |
| | <br> <metakeywords>Хімія, клас, урок, на тему, 10 клас, Основні фізичні та хімічні властивості неметалів.</metakeywords>ОСНОВНІ ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ<br> | | <br> <metakeywords>Хімія, клас, урок, на тему, 10 клас, Основні фізичні та хімічні властивості неметалів.</metakeywords>ОСНОВНІ ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ<br> |
| | | | |
| - | <br>
| |
| | | | |
| - | Кисень 0<sub>2</sub> і озон 0<sub>3 </sub>— алотропні форми елемента Оксигену.<br>
| |
| | | | |
| - | Порівняння властивостей кисню 0<sub>2 </sub>й озону 0<sub>3 </sub>засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо):<br>
| + | Кисень 0<sub>2</sub> і озон 0<sub>3 </sub>— алотропні форми елемента Оксигену.<br> |
| | | | |
| - | 8Ag + 20<sub>3</sub> = 4Ag<sub>2</sub>0 + 0<sub>2</sub>↑ <br>
| + | Порівняння властивостей кисню 0<sub>2 </sub>й озону 0<sub>3 </sub>засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо):<br> |
| | | | |
| - | ''Таблиця 1. Властивості кисню й озону''<br><br> | + | 8Ag + 20<sub>3</sub> = 4Ag<sub>2</sub>0 + 0<sub>2</sub>↑ <br> |
| | + | |
| | + | ''Таблиця 1. Властивості кисню й озону''<br><br> |
| | | | |
| | {| cellspacing="1" cellpadding="1" border="1" width="600" | | {| cellspacing="1" cellpadding="1" border="1" width="600" |
| | |- | | |- |
| - | | Властивості простих речовин <br> | + | | Властивості простих речовин <br> |
| | | | | | |
| - | Прості речовини | + | Прості речовини |
| | | | |
| - | кисень<br> | + | кисень<br> |
| | | | |
| | | | | | |
| - | Прості речовини | + | Прості речовини |
| | | | |
| - | озон<br> | + | озон<br> |
| | | | |
| | |- | | |- |
| - | | Агрегатний стан за звичайних умов <br> | + | | Агрегатний стан за звичайних умов <br> |
| - | | Газ | + | | Газ |
| | | Газ | | | Газ |
| | |- | | |- |
| - | | Колір <br> | + | | Колір <br> |
| - | | Безбарвний <br> | + | | Безбарвний <br> |
| | | Синій | | | Синій |
| | |- | | |- |
| - | | Запах <br> | + | | Запах <br> |
| - | | Без запаху <br> | + | | Без запаху <br> |
| | | Різкий, своєрідний | | | Різкий, своєрідний |
| | |- | | |- |
| - | | Розчинність (у 100 об'ємах Н<sub>2</sub>0 при 20<sup>0</sup>С) | + | | Розчинність (у 100 об'ємах Н<sub>2</sub>0 при 20<sup>0</sup>С) |
| - | | 3 об'єми | + | | 3 об'єми |
| | | 49 об'ємів | | | 49 об'ємів |
| | |- | | |- |
| - | | Густина газу за н. у. <br> | + | | Густина газу за н. у. <br> |
| - | | 1,43 г/л <br> | + | | 1,43 г/л <br> |
| | | 2,14 г/л | | | 2,14 г/л |
| | |- | | |- |
| - | | Температура кипіння | + | | Температура кипіння |
| - | | -193 °С <br> | + | | -193 °С <br> |
| | | -112 °С | | | -112 °С |
| | |- | | |- |
| - | | Температура плавлення <br> | + | | Температура плавлення <br> |
| - | | -219 °С | + | | -219 °С |
| | | -192 °С | | | -192 °С |
| | |- | | |- |
| - | | Фізіологічна дія <br> | + | | Фізіологічна дія <br> |
| - | | Неотруйний <br> | + | | Неотруйний <br> |
| | | Дуже отруйний | | | Дуже отруйний |
| | |- | | |- |
| - | | Хімічні властивості <br> | + | | Хімічні властивості <br> |
| - | | Окисник <br> | + | | Окисник <br> |
| | | Дуже сильний окисник | | | Дуже сильний окисник |
| | |- | | |- |
| - | | Реакційна здатність <br> | + | | Реакційна здатність <br> |
| - | | Висока <br> | + | | Висока <br> |
| | | Дуже висока | | | Дуже висока |
| | |} | | |} |
| | | | |
| - | <br>Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону 03, і в реакціях окиснення беруть участь саме ці атоми Оксигену.<br>Застосування озону зумовлене його винятковими окис¬ними властивостями. Озон використовується для озонуван¬ня питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у меди¬цині; як окисник ракетного палива.<br>Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість.<br> | + | <br>Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону 0<sub>3,</sub> і в реакціях окиснення беруть участь саме ці атоми Оксигену. |
| | + | |
| | + | Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива. |
| | + | |
| | + | Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість.<br> |
| | | | |
| | Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар. | | Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар. |
Версия 15:53, 7 декабря 2009
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Хімія: Основні фізичні та хімічні властивості неметалів
ОСНОВНІ ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ
Кисень 02 і озон 03 — алотропні форми елемента Оксигену.
Порівняння властивостей кисню 02 й озону 03 засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо):
8Ag + 203 = 4Ag20 + 02↑
Таблиця 1. Властивості кисню й озону
Властивості простих речовин
|
Прості речовини
кисень
|
Прості речовини
озон
|
Агрегатний стан за звичайних умов
| Газ
| Газ
|
Колір
| Безбарвний
| Синій
|
Запах
| Без запаху
| Різкий, своєрідний
|
| Розчинність (у 100 об'ємах Н20 при 200С)
| 3 об'єми
| 49 об'ємів
|
Густина газу за н. у.
| 1,43 г/л
| 2,14 г/л
|
| Температура кипіння
| -193 °С
| -112 °С
|
Температура плавлення
| -219 °С
| -192 °С
|
Фізіологічна дія
| Неотруйний
| Дуже отруйний
|
Хімічні властивості
| Окисник
| Дуже сильний окисник
|
Реакційна здатність
| Висока
| Дуже висока
|
Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону 03, і в реакціях окиснення беруть участь саме ці атоми Оксигену.
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива.
Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість.
Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар.
Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі.
Ви вже знаєте, що кисень — дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами і багатьма складними речовинами, виявляючи властивості сильного окисника.
• Які сполуки утворюються під час взаємодії з киснем: а) водню б) алюмінію; в) метану СН4? Напишіть рівняння реакцій, зазначте у кожному з випадків ступінь окиснення елементів окисник і відновник.
Хімічна активність сірки
також доволі висока. При нагріванні вона реагує майже з усіма елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окисника, так і відновника (порівняйте з киснем), бо для неї характерні як позитиви ступені окиснення (+4, +6), так і негативний (-2).
1. Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (окрім золота), утворюючи сульфіди. Так, якщо всипати порошок міді у розплавлену сірку (мал. 3), то відбувається реакція з утворенням чорного сульфіду купруму (І) і виділенням великої кількості теплоти:
2Cu + S = Cu2S
Після початку реакції спиртівку відставляють.
• Сірка безпосередньо сполучається з залізом, цинком, натрієм, алюмінієм. Напишіть рівняння цих реакцій і зазначне назви речовин, що утворилися. 2. Взаємодія з неметалами. Сірка безпосередньо взаємоді з усіма неметалами (окрім йоду й азоту). Реакції відбуваються при нагріванні:
S + 02 = S02↑
H2 + S = H2S↑
Мал. 3. Взаємодія міді і сірки
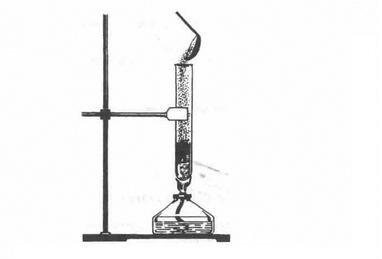
Застосування. Найбільша маса сірки і природних сульфідів витрачається на виробництво сульфатної кислоти. Сірка використовується і в інших галузях хімічної промисловості: для добування сульфітів Na2S03 і Ca(HS03)2 для легкої промисловості, сульфідів Na2S, CaS, BaS для шкіряного виробництва, виготовлення люмінофорів (речовин, здатних світитися). Сірку застосовують у виробництві барвників, гуми, чорного пороху, сірників, ліків, використовують її і в сільському господарстві для боротьби із шкідниками.
Фізичні властивості азоту
За звичайних умов азот — газ без кольору і запаху. Молекули його неполярні, тому взаємодія між ними слабка, вона не може перешкодити їхньому xaoтичному рухові. Цим пояснюється газуватий стан азоту за звичайних умов і це є причиною того, що азот зріджується (-196 °С) і твердне (-210 °С) за дуже низьких температур. У твердому стані має молекулярні кристалічні ґратки. Неполярністю молекул азоту пояснюється його низька розчинність у воді (в 1 об'ємі води за 20 °С розчиняється
0,0154 об'єми азоту). Він трохи легший за повітря, маса 1 л азоту дорівнює 1,25 г.
Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями.
Це — білий, червоний і чорний фосфор.
Білий фосфор — м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але звичайно жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка (t <subпл.</sub> = 44 °С) і легкозаймиста. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули Р4 (мал. 4). У воді не розчиняється. Розчиняється у сірковуглеці CS2 та бензині. У темряві на повітрі світиться зеленкувато-жовтим світлом (люмінесценція), при цьому виділяється теплота (хімічна енергія перетворюється на світлову). Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Під час нагрівання або на світлі він перетворюється на червоний фосфор.
Білий фосфор — надзвичайно отруйна речовина, навіть у малих дозах (50 мг) діє смертельно!
Червоний фосфор — порошок від темно-коричневого до червоного і фіолетового кольору, з атомними кристалічними гратками (структура до кінця не з'ясована), без запах, не отруйний на повітрі окиснюється повільно, у темряві не
світиться, загоряється лише при 260 °С. Легко вбирає вологу (гігроскопічний), але у воді і в сірковуглеці CS2 не розчиняється. Під час нагрівання без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор.
Чорний фосфор — речовина, схожа на графіт, має шарувату будову, металічний блиск, виявляє властивості напівпровідника, не отруйний. Це найбільш стійка алотропна форма. Утворюється з білого фосфору при тривалому нагріванні (200 °С) під великим тиском (1220 МПа).
Утворення фосфором кількох алотропних форм пояснюється різним розміщенням атомів один відносно одного у кристалічних ґратках.
У природі Нітроген зустрічається як у вільному стані, так і у зв'язаному. У вільному стані Нітроген у вигляді азоту входить до складу повітря (об'ємна частка N2 становить 78 %, масова — 75,6 %). Оскільки азот з повітря витрачається мало, його запаси в атмосфері залишаються сталими. У вигляді неорганічних сполук Нітроген у невеликих кількостях є в ґрунті. Проте у вигляді складних органічних сполук — білків — він увіходить до складу всіх живих організмів, беручи участь у їх життєдіяльності.
На відміну від Нітрогену Фосфор зустрічається в природі тільки в сполуках (чому?). Найважливіші мінерали, до складу яких уходить фосфат кальцію Са3(Р04)2, — це фосфорити и апатити. Найбільше у світі родовище апатитів на Кольському півострові у Хібінських горах.
В Україні родовища фосфоритів зустрічаються у Придністров'ї, на Харківщині, в Чернігівській та Запорізькій областях.
Елемент Фосфор — важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор — життєво важливий елемент для всіх організмів.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Що собою являє озон за звичайних умов? З якою метою він застосовується? 2. Які хімічні властивості характерні для кисню і сірки? Наведіть рівняння відповідних реакцій.
3. Порівняйте взаємодію водню з киснем і сіркою. У чому подібність і відмінність цих реакцій?
4. Напишіть рівняння реакцій сірки з киснем і цинком. Яку роль відіграє сірка в одній і в другій реакціях?
5. Який тип хімічного зв'язку у сполуках Сульфуру з металами?
6. Чому кисень виявляє окисні властивості, а сірка, як окисні, так і відновні?
7. Наведіть кілька прикладів рівнянь реакцій, які засвідчують, що у кисню окисні властивості виявляються сильніше, ніж у
сірки.
8. Якщо 31 г заліза взаємодіє з сіркою за умови, що масова частка використання заліза становить 90 %, то в результаті реакції утворюється сульфід феруму масою
(а) ~ 12 г; (в) ~ 44 г;
(б) ~ 22 г; (г) ~ 88 г.
9. Маючи аналогічну електронну конфігурацію зовнішнього шару, атоми хімічних елементів Оксигену і Полонію різко відрізняються один від одного за властивостями. Як ви гадаєте, чим це можна пояснити?
10. Якого типу кристалічні гратки в азоту? На підставі яких фізичних властивостей азоту можна про це робити висновок?
11. Доведіть розрахунком, що азот трохи легший за повітря.
12. Обчисліть густину азоту за воднем.
13. Що таке алотропія? Схарактеризуйте найголовніші алотропні форми Фосфору. Розкрийте причину відмінності їхніх властивостей.
14. Як ви гадаєте, чому азот — газ, а фосфор — тверда речовина?
15. Порівняйте алотропію Оксигену і Фосфору. Що тут спільного і в чому відмінність?
16. Розкрийте фізіологічну роль Нітрогену і Фосфору.
17. У якому вигляді Нітроген і Фосфор зустрічаються в природі і чому?
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Вислано читачами з інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 10 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|











