|
Гіпермаркет Знань>>Хімія>>Хімія 10 клас>> Хімія: Основні фізичні та хімічні властивості неметалів
Кисень 02 і озон 03 — алотропні форми елемента Оксигену. Порівняння властивостей кисню 02 й озону 03 засвідчує, що окисна активність озону вища, ніж кисню. Наприклад, вже за звичайних умов він окиснює багато які малоактивні прості речовини (срібло, ртуть тощо): 8Ag + 203 = 4Ag20 + 02↑ Таблиця 1. Властивості кисню й озону
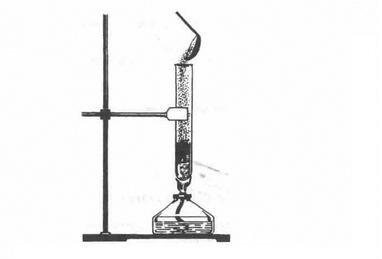
Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива. Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморочення, стомленість. Проте озон може бути не лише шкідливим, а й корисним. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст — вищий, ніж у сільській місцевості. 3 віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20 — 25 км. Там утворюється так званий озоновий шар. Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом С02 поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі. Ви вже знаєте, що кисень — дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами і багатьма складними речовинами, виявляючи властивості сильного окисника. • Які сполуки утворюються під час взаємодії з киснем: а) водню б) алюмінію; в) метану СН4? Напишіть рівняння реакцій, зазначте у кожному з випадків ступінь окиснення елементів окисник і відновник. Хімічна активність сірки також доволі висока. При нагріванні вона реагує майже з усіма елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окисника, так і відновника (порівняйте з киснем), бо для неї характерні як позитиви ступені окиснення (+4, +6), так і негативний (-2). 1. Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (окрім золота), утворюючи сульфіди. Так, якщо всипати порошок міді у розплавлену сірку (мал. 3), то відбувається реакція з утворенням чорного сульфіду купруму (І) і виділенням великої кількості теплоти: 2Cu + S = Cu2S Після початку реакції спиртівку відставляють. • Сірка безпосередньо сполучається з залізом, цинком, натрієм, алюмінієм. Напишіть рівняння цих реакцій і зазначне назви речовин, що утворилися. 2. Взаємодія з неметалами. Сірка безпосередньо взаємоді з усіма неметалами (окрім йоду й азоту). Реакції відбуваються при нагріванні: S + 02 = S02↑ H2 + S = H2S↑ Мал. 3. Взаємодія міді і сірки
Фізичні властивості азоту За звичайних умов азот — газ без кольору і запаху. Молекули його неполярні, тому взаємодія між ними слабка, вона не може перешкодити їхньому xaoтичному рухові. Цим пояснюється газуватий стан азоту за звичайних умов і це є причиною того, що азот зріджується (-196 °С) і твердне (-210 °С) за дуже низьких температур. У твердому стані має молекулярні кристалічні ґратки. Неполярністю молекул азоту пояснюється його низька розчинність у воді (в 1 об'ємі води за 20 °С розчиняється Хімічний елемент Фосфор, на відміну від Нітрогену, утворює кілька простих речовин, які помітно різняться за властивостями. Це — білий, червоний і чорний фосфор. Білий фосфор — м'яка кристалічна речовина, у чистому вигляді зовсім безбарвна і прозора, але звичайно жовтуватого кольору (схожа на віск), летка, має запах часнику, легкоплавка (tпл. = 44 °С) і легкозаймиста. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули Р4. У воді не розчиняється. Розчиняється у сірковуглеці CS2 та бензині. У темряві на повітрі світиться зеленкувато-жовтим світлом (люмінесценція), при цьому виділяється теплота (хімічна енергія перетворюється на світлову). Таке явище спричинюється повільним окисненням. Теплота, що виділяється при цьому, може розплавити фосфор і призвести до його займання. Через це білий фосфор зберігають під водою. Під час нагрівання або на світлі він перетворюється на червоний фосфор. Білий фосфор — надзвичайно отруйна речовина, навіть у малих дозах (50 мг) діє смертельно! Червоний фосфор — порошок від темно-коричневого до червоного і фіолетового кольору, з атомними кристалічними гратками (структура до кінця не з'ясована), без запах, не отруйний на повітрі окиснюється повільно, у темряві не Чорний фосфор — речовина, схожа на графіт, має шарувату будову, металічний блиск, виявляє властивості напівпровідника, не отруйний. Це найбільш стійка алотропна форма. Утворюється з білого фосфору при тривалому нагріванні (200 °С) під великим тиском (1220 МПа). Утворення фосфором кількох алотропних форм пояснюється різним розміщенням атомів один відносно одного у кристалічних ґратках. У природі Нітроген зустрічається як у вільному стані, так і у зв'язаному. У вільному стані Нітроген у вигляді азоту входить до складу повітря (об'ємна частка N2 становить 78 %, масова — 75,6 %). Оскільки азот з повітря витрачається мало, його запаси в атмосфері залишаються сталими. У вигляді неорганічних сполук Нітроген у невеликих кількостях є в ґрунті. Проте у вигляді складних органічних сполук — білків — він увіходить до складу всіх живих організмів, беручи участь у їх життєдіяльності. На відміну від Нітрогену Фосфор зустрічається в природі тільки в сполуках (чому?). Найважливіші мінерали, до складу яких уходить фосфат кальцію Са3(Р04)2, — це фосфорити и апатити. Найбільше у світі родовище апатитів на Кольському півострові у Хібінських горах. В Україні родовища фосфоритів зустрічаються у Придністров'ї, на Харківщині, в Чернігівській та Запорізькій областях. Елемент Фосфор — важлива складова частина організму людини, тварин і рослин. З рослин найбагатші на Фосфор бобові, соняшник і горіхи. В організмі людини Фосфор виявлений в усіх тканинах, особливо у нервовій і кістковій. Він входить до складу деяких ферментів, міститься в зубах, фосфор — життєво важливий елемент для всіх організмів. ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Н.М. Буринська, Л.П. Величко, Хімія, 10 клас
Зміст уроку
Если у вас есть исправления или предложения к данному уроку, напишите нам. Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: