|
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Особливості будови атома Карбону в основному і збудженому станах. Утворення ковалентних зв’язків. Структурні формули органічних речовин
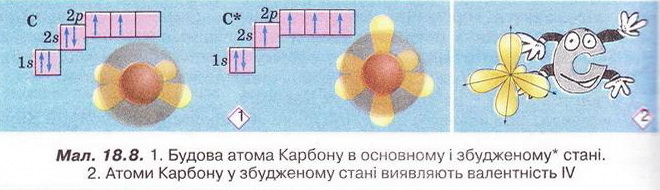
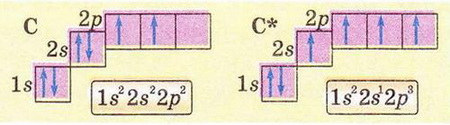
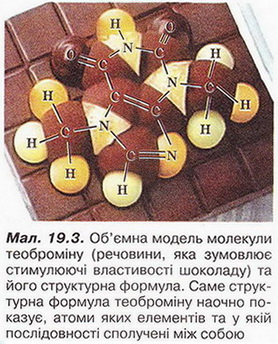
Спільні й відмінні ознаки органічних і неорганічних сполук. Особливості будови атома Карбону в основному й збудженому станах. Утворення ковалентних зв'язків між атомами Карбону Після опрацювання § 18 ви зможете: називати елементи-органогени; порівнювати органічні й неорганічні речовини. На шляху до успіху пригадаємо з вивчених курсів природознавства й хімії: за якими ознаками класифікують речовини; як за хімічною формулою визначають якісний і кількісний склад речовини; чим аналіз відрізняється від синтезу; що таке електронна формула атома та її графічний варіант; яка форма s- і р-елекгронних орбіталей і як вони розташовані в просторі навколо ядра; як змінюються атомні радіуси в головних підгрупах; як утворюються ковалентні зв'язки; що таке колообіг елемента в природі; як пов'язані жива і нежива природа. Органічна хімія — це хімія сполук Карбону. Щоправда, слід зважати на те, що існують і неорганічні сполуки Карбону - чадний і вуглекислий гази, крейда тощо (пригадайте систематичні назви і хімічні формули цих сполук). Під час синтезу органічних сполук, дослідження їхнього складу та властивостей науковці виявили чимало дивного. Насамперед - кількість і розмаїття сполук, утворених обмеженим числом хімічних елементів (пригадайте, яких саме). Дослідників бентежила відсутність прийнятних пояснень того, чому десятки зовсім різних речовин мають однаковий якісний склад. Однак найбільше дивувало існування органічних сполук з однаковим якісним і кількісним складом, але різними фізичними й хімічними властивостями. Це явище, яке Берцеліус назвав ізомерією, подекуди траплялося й поміж неорганічних сполук, однак найяскравіше воно виявилося саме в царині органічних речовин. Оскільки на той час уявлення про існування молекул ще не були загальновизнаними, науковцям важко було пояснити ці факти. Тому, як зазначав у 1835 р. Ф. Велер, органічна хімія ввижалася їм «...дрімучим лісом, повним дивних речей, величезною хащею без виходу, без кінця, куди не насмілюєшся проникнути...» Однак завдяки допитливому розуму і наполегливій праці багатьох дослідників ці складнощі було подолано. Сформувалися й розвинулися теоретичні уявлення про атоми та їхню здатність сполучатися в молекули відповідно до валентності. Було визначено валентність багатьох хімічних елементів, зокрема атомів Карбону - неодмінної складової усіх органічних речовин. Науковці з'ясували, що атоми цього елемента в органічних сполуках чотирьохвалентні. Вони здатні сполучатися між собою, утворюючи ланцюги різної будови нерозгалужені, розгалужені, замкнуті тощо. Причини цих унікальних особливостей атомів Карбону були пояснені значно пізніше на основ: уявлень про електронну будову атомів. • Тому, аби у XXI ст. не заблукати на теренах органічної хімії, розгляньмо особливості будови атома Карбону. Пам'ятайте: порядковий номер хімічного елемента в періодичній системі - джерело знань про будову його атома. За періодичною системою хімічних елементів ви легко пригадаєте, як за номером групи визначити кількість електронів на зовнішньому (другому) енергетичному рівні атомі Карбону. Якщо атом Карбону перебуває в основному стані (мал. 18.8), то на зовнішньому (другому від ядра) енергетичному рівні містяться два s- і р-електрони. Завдання Визначте, які з електронів зовнішнього рівня в атомі Карбону в основному стані спарені, а які - ні. Під час хімічних реакцій атом Карбону одержує ззовні енергію (теплову, світлову тощо) і переходить у так званий збуджений стан. Унаслідок цього один з 28-електронів, поглинувши порцію енергії, займає вільну 2р-орбіталь. Тобто на зовнішньому рівні в атомі Карбону всі чотири електрони стають неспареними. Ось чому атому Карбону в збудженому стані властива валентність IV. Унікальні властивості атомів Карбону зумовлені двома чинниками. Наявність чотирьох електронів на зовнішньому енергетичному рівні й найменший у IVА-пігрупі радіус атома (мал. 18.9) - причина того, що атом Карбону не схильний ані втрачати, ані приєднувати електрони. Тобто утвореній йонних зв'язків для нього не характерне. Тому Карбон утворює здебільшого ковалентні, а не йонні зв'язки. • Утворення ковалентних зв'язків між атомами Карбону та атомами інших неметалічних елементів (Н, О, Р, S тощо) є причиною того, що в органічних сполуках кристалічні ґратки переважно молекулярні. Натомість поміж неорганічних речовин - значна частка йонних Завдання Пригадайте властивості речовин з різними типами кристалічних ґраток (§ 2). Спрогнозуйте, які фізичні властивості мають бути притаманні органічним речовинам порівняно з неорганічними. Особливості будови органічних сполук позначаються й на їхніх хімічних властивостях. Приміром, реакції між електролітами у водних зачинах відбуваються майже миттєво. А реакції за участю органічних сполук часто проходять досить повільно, у кількох напрямах і у кілька стадій та супроводжуються утворенням побічних продуктів. Чималу чистку поміж таких реакцій становлять оборотні процеси. Зверніть увагу на малюнки 18.8-18.9. Вони певною мірою допомогли ваМ зримо уявити собі деякі поняття та реальні об'єкти. Про моделі мо¬лекул і особливе значення моделювання в хімії, насамперед органічній, йтиметься у наступному параграфі. Стисло про головне Оцтова кислота, цукор, поліетилен, гемоглобін, крохмаль, глюкоза хлорофіл, аспірин - добре відомі вам органічні речовини. Кількість природних і синтетичних органічних сполук значно більша за кількість неорганічних речовин. Поняття «органічна хімія» й «органічні речовини» уперше ввів шведський хімік И.Я. Берцеліус. Тривалий час вважалося, що синтез органічних речовин (на відміну від неорганічних) поза тваринними чи рослинними організмами неможливий. Згодом ці хибні уявлення був спростовано. На початку XIX ст. стрімкий розвиток промисловості спонукав науковців дослідити елементний склад і властивості органічних сполук порівняно з неорганічними. Було виявлено, що всі органічні сполуки містять Карбон, сформульовано актуальне й донині визначення органічної хімії як хімії сполук Карбону. Під час синтезу органічних сполук, дослідження їхнього складу властивостей науковці відкрили існування чималої кількості ізомерів - речовин з однаковим якісним і кількісним складом, але різними властивостями. Вченим важко було пояснити явище ізомерії, оскільки на той час уявлення про існування молекул ще не були загальнознаними. З розвитком науки сформувалися й розвинулися теоретичні уявлення про атоми та їхню здатність сполучатися в молекули відповідно до валентності. Було визначено, що атоми Карбону в органічних сполуках чотирьохвалентні. З'ясовано, що вони здатні сполучатися між собою ковалентними зв'язками, утворюючи ланцюги різної будови - нерозгалужені, розгалужені, замкнуті тощо. Протонне число Карбону збігається з його порядковим номером у періодичній системі і дорівнює шести. Позитивний заряд шести проте - у ядрі атома Карбону компенсується негативним зарядом шести електронів його електронної оболонки. Карбон - елемент ІVА-підгрупи періодичної системи, тому на зовнішньому (другому) енергетичному рівні його атома містяться чотири електрони. В основному стані - лік спарені s- і два неспарені р-електрони. Під час хімічних реакцій атом Карбону переходить у так званий зближений стан. Унаслідок цього один з 2s-електронів, поглинувши порцію, енергії, займає вільну 2р-орбіталь, усі чотири електрони зовнішнього рівня стають неспареними. Тому валентність IV властива атомам Карбону в збудженому стані В органічних сполуках кристалічні ґратки переважно молекулярні, тож вони мають невисокі температури плавлення та кипіння й менш термостійкі порівняно з неорганічними. Особливості будови органічних сполук позначаються й на їхніх хімічних властивостях. Реакції за участю органічних сполук часто оборотні, проходять досить повільно, у кількох напрямах і у кілька стадій та супроводжуються утворенням побічних продуктів. • Структурні формули органічних речовин - знакові моделі, у яких символи хімічних елементів сполучені рисочками, кількість яких відповідає валентності атома цього елемента в сполуці (мал. 19.3). Завдання 1. За малюнком 19.3 запишіть молекулярну формулу теоброміну.
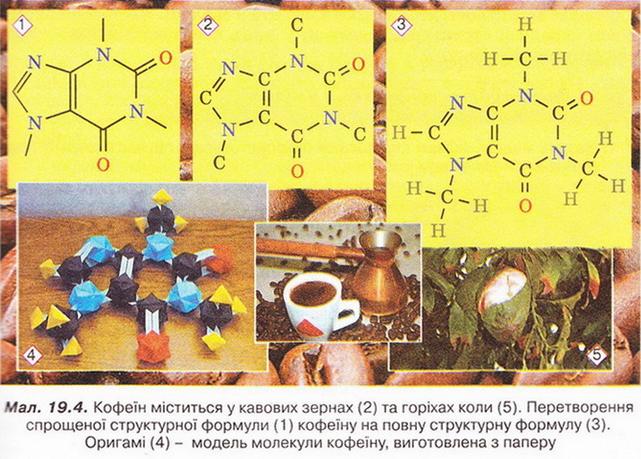
Ви, звичайно, пам’ятаєте, що ковалентний зв'язок утворюється за рахунок спільних електронних пар. Тобто, зобразивши в структурній формулі речовини замість рисочок пари електронів, ми перетворимо структурну формулу на електронну. Приміром, структурна формула водню H-H, а його електронна формула H · · H. Часто використовують спрощені структурні формули органічних речовин, у яких показують зв’язки лише між атомами Карбону (мал.19.4,1). Аби правильно інтерпретувати спрощену структурну формулу, приміром кофеїну, помістімо символи Карбону в кожну точку перетину й у закінчення кожної лінії (мал. 19.4,2). Потім кожний символ Карбону сполучімо рисками із символами Гідрогену так, щоб загальна кількість зв’язків біля кожного атома Карбону дорівнювала чотирьом (поясніть, чому). Уміння інтерпретувати кулестержневі та об’ємні (масштабні) моделі молекул, повні й спрощені структурні формули знадобиться вам під час подальшого вивчення органічних речовин. Про їхній склад, будову, властивості, застосування, знаходження в природі й добування йтиметься в наступних параграфах. Стисло про головне Структурні формули органічних речовин - знакові моделі, у яких символи хімічних елементів сполучені рисочками, кількість яких відповідає валентності атома цього елемента в сполуці. Часто використовують спрощені структурні формули, у яких показують зв'язки лише між атомами Карбону. Застосуйте свої знання й уміння 1. Виберіть протонне число хімічного елемента, який входить до складу всіх органічних сполук: А 12; Б 7; В 6; Г 20. 2. Сечовина - складова сечі й нітрогеновмісне добриво. Його друга назва - карбамід. З'ясуйте, використовуючи різноманітні джерела інформації, до складу яких популярних товарів входить ця органічна речовина. 3. Виберіть ознаки, притаманні більшості органічних речовин: 4. Заповніть таблицю «Порівняльна характеристика органічних і неорганічних речовин».
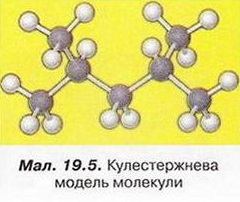
8. Виберіть процес за участю неорганічних речовин, одним із продуктів якого є органічна речовина: 9. Поміркуйте й висловіть припущення, чи існує чітка межа між неорганічними та органічними речовинами. Аргументуйте свою думку. 10. Поясніть, що таке структурні формули, для чого їх застосовують. 11. Запишіть повну структурну формулу молекули зображеної на малюнку 19.5, та й хімічну формулу. Скарбничка досвіду 1. Складіть схему «Класифікація речовин», як приклади сполук використайте ті, що добре відомі вам з повсякденного життя. Схему можна оформити як колекцію (віртуальну або реальну) - зі зразками речовин, їхніми зображеннями чи етикетками відповідних товарів. 2. Бакмінстерфулерен - сполука Карбону. Дізнайтеся, використовуючи різноманітні джерела інформації, про її склад, властивості та застосування. До яких сполук - неорганічних чи органічних - належить ця речовина?
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: