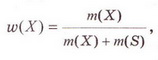|
|
|
| Строка 7: |
Строка 7: |
| | Обчисліть масову частку Оксигену в кальцій карбонаті. Для цього спочатку обчисліть відносну формульну масу цієї сполуки. Далі визначте відносну масу атомів Оксигену в ній. Частка від ділення відносної маси атомів Оксигену на відносну формульну масу сполуки і буде шуканою величиною. Величини, які називають частками компонентів (складових частин) системи, або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (''x'') об ємні (''ф'') та масові (''w'') частки компонентів. З малюнка 7.1 легко зрозуміти, що сума часток компонентів становить 1, або 100 %. | | Обчисліть масову частку Оксигену в кальцій карбонаті. Для цього спочатку обчисліть відносну формульну масу цієї сполуки. Далі визначте відносну масу атомів Оксигену в ній. Частка від ділення відносної маси атомів Оксигену на відносну формульну масу сполуки і буде шуканою величиною. Величини, які називають частками компонентів (складових частин) системи, або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (''x'') об ємні (''ф'') та масові (''w'') частки компонентів. З малюнка 7.1 легко зрозуміти, що сума часток компонентів становить 1, або 100 %. |
| | | | |
| - | [[Image:47_1_chemistry.jpg]]<br> | + | [[Image:47 1 chemistry.jpg]]<br> |
| | | | |
| | <u>''Завдання''</u> | | <u>''Завдання''</u> |
| Строка 17: |
Строка 17: |
| | Масову частку розчиненої речовини в бінарному розчині обчислюють за формулою | | Масову частку розчиненої речовини в бінарному розчині обчислюють за формулою |
| | | | |
| - | [[Image:51_chemistry.jpg]] | + | [[Image:51 chemistry.jpg]] |
| | | | |
| | де ''w''(Х) - масова частка розчиненої речовини X;<br>''m''(Х) - маса розчиненої речовини X, г;<br>''m''(S) - маса розчинника S, r;<br>''m''(розчину) = ''m''(Х) + ''m''(S), г. | | де ''w''(Х) - масова частка розчиненої речовини X;<br>''m''(Х) - маса розчиненої речовини X, г;<br>''m''(S) - маса розчинника S, r;<br>''m''(розчину) = ''m''(Х) + ''m''(S), г. |
| Строка 25: |
Строка 25: |
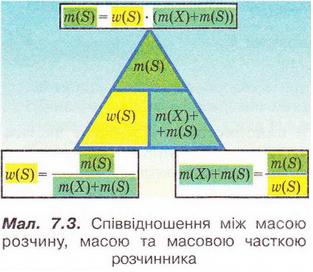
| | Запишемо скорочено умову задачі й виконаємо необхідні розрахунки. Які формули для цього знадобляться, легко зрозуміти зі співвідношень, наведених на схемах (мал. 7.2). | | Запишемо скорочено умову задачі й виконаємо необхідні розрахунки. Які формули для цього знадобляться, легко зрозуміти зі співвідношень, наведених на схемах (мал. 7.2). |
| | | | |
| - | [[Image:48_chemistry.jpg]]<br> | + | [[Image:48 chemistry.jpg]]<br> |
| | | | |
| - | [[Image:48_2_chemistry.jpg]] | + | [[Image:48 2 chemistry.jpg]] |
| | | | |
| | <u>''Завдання''</u> | | <u>''Завдання''</u> |
| Строка 35: |
Строка 35: |
| | Розглянемо ще один приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масу калій гідроксиду і об'єм води, потрібні для виготовлення розчину масою 800 г з масовою часткою лугу 0,2. Потрібні формули наведені на малюнках 7.2 і 7.3. Використовуючи їх, можна, зокрема, обчислити масу речовини у розчині за її масовою часткою та масою розчину, вирахувати масу води у ньому та її об'єм. | | Розглянемо ще один приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масу калій гідроксиду і об'єм води, потрібні для виготовлення розчину масою 800 г з масовою часткою лугу 0,2. Потрібні формули наведені на малюнках 7.2 і 7.3. Використовуючи їх, можна, зокрема, обчислити масу речовини у розчині за її масовою часткою та масою розчину, вирахувати масу води у ньому та її об'єм. |
| | | | |
| - | [[Image:48_3_chemistry.jpg]]<br> | + | [[Image:48 3 chemistry.jpg]]<br> |
| | | | |
| - | [[Image:49_chemistry.jpg]] | + | [[Image:49 chemistry.jpg]] |
| | | | |
| | <u>''Завдання''</u> | | <u>''Завдання''</u> |
| | | | |
| - | [[Image:49_2_chemistry.jpg]]<br> | + | [[Image:49 2 chemistry.jpg]]<br> |
| | | | |
| | <u>''Завдання''</u><br>Усно обчисліть масову частку натрій нітрату в його насиченому розчині за 35 °С. | | <u>''Завдання''</u><br>Усно обчисліть масову частку натрій нітрату в його насиченому розчині за 35 °С. |
| Строка 49: |
Строка 49: |
| | Наприклад, обчислимо об'єм води й масу купрум(ІІ) сульфату, пентагідрату, необхідні для виготовлення розчину купрум(ІІ) сульфату масою 200 г з масовою часткою солі 0,08. Для цього пригадаємо: яка хімічна формула відповідає назві купрум(ІІ) сульфат, пентагідрат; як обчислюють молярну масу кристалогідрату; як обчислюють масу речовини за її кількістю (у молях). | | Наприклад, обчислимо об'єм води й масу купрум(ІІ) сульфату, пентагідрату, необхідні для виготовлення розчину купрум(ІІ) сульфату масою 200 г з масовою часткою солі 0,08. Для цього пригадаємо: яка хімічна формула відповідає назві купрум(ІІ) сульфат, пентагідрат; як обчислюють молярну масу кристалогідрату; як обчислюють масу речовини за її кількістю (у молях). |
| | | | |
| - | [[Image:50_chemistry.jpg]]<br> | + | [[Image:50 chemistry.jpg]]<br> |
| | | | |
| | Отже, ці та інші типи розрахунків, пов'язані з виготовленням розчинів (розбавляння, упарювання, добавляння розчинюваної речовини, змішування кількох розчинів), ґрунтуються на розумінні понять «ціле», «частка від цілого», «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, представлених на малюнках 7.2 і 7.3, та вмінні ними оперувати.<br> | | Отже, ці та інші типи розрахунків, пов'язані з виготовленням розчинів (розбавляння, упарювання, добавляння розчинюваної речовини, змішування кількох розчинів), ґрунтуються на розумінні понять «ціле», «частка від цілого», «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, представлених на малюнках 7.2 і 7.3, та вмінні ними оперувати.<br> |
| Строка 97: |
Строка 97: |
| | <br> ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів'' | | <br> ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів'' |
| | | | |
| - | <br> <sub>Повний перелік тем з хімії, календарний план по всім предметам згідно шкільної програми, домашня робота, курси та завдання з хімії для 9 класу</sub> | + | <br> <sub>Повний перелік тем [[Хімія|з хімії]], календарний план по всім предметам згідно шкільної програми, домашня робота, курси та завдання з хімії для 9 класу</sub> |
| | | | |
| | <br> | | <br> |
Версия 12:39, 19 марта 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розв'язування розрахункових задач №1
РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №1
Завдання
Обчисліть масову частку Оксигену в кальцій карбонаті. Для цього спочатку обчисліть відносну формульну масу цієї сполуки. Далі визначте відносну масу атомів Оксигену в ній. Частка від ділення відносної маси атомів Оксигену на відносну формульну масу сполуки і буде шуканою величиною. Величини, які називають частками компонентів (складових частин) системи, або просто частками, використовують для кількісної характеристики складу речовини, суміші або розчину. Обчислюють мольні (x) об ємні (ф) та масові (w) частки компонентів. З малюнка 7.1 легко зрозуміти, що сума часток компонентів становить 1, або 100 %.
Завдання
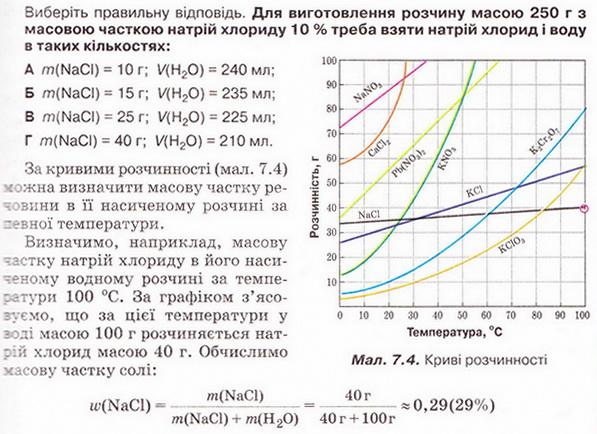
Виберіть правильне твердження. Масова частка води в розчині з масовою часткою сульфатної кислоти 0,3 становить: А 30 %; Б 40 %; В 70 %; Г 7 %; Д 3 %.
• Масова частка розчиненої речовини — це відношення її маси до загальної маси розчину.
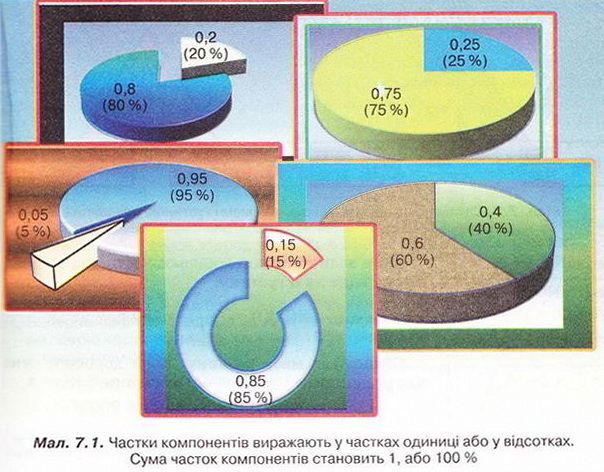
Масову частку розчиненої речовини в бінарному розчині обчислюють за формулою
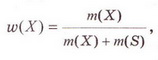
де w(Х) - масова частка розчиненої речовини X;
m(Х) - маса розчиненої речовини X, г;
m(S) - маса розчинника S, r;
m(розчину) = m(Х) + m(S), г.
Розгляньмо приклад розрахунків з використанням масової частки чиненої речовини. Визначимо масову частку натрій нітрату розчині, для виготовлення якого було взято натрій нітрат масою 20 г воду об'ємом 180 мл.
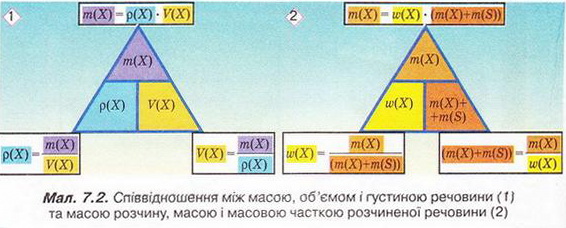
Запишемо скорочено умову задачі й виконаємо необхідні розрахунки. Які формули для цього знадобляться, легко зрозуміти зі співвідношень, наведених на схемах (мал. 7.2).

Завдання
Виберіть правильні відповіді. Масова частка цукру в розчині, для виготовлення якого було взято цукор масою 200 г і воду об'ємом 300 мл, становить: А 20 %; Б 40 %; В 6,6 %; Г 30 %; Д 0,4; Е 0,02; Ж 0,3.
Розглянемо ще один приклад розрахунків з використанням масової частки розчиненої речовини. Визначимо масу калій гідроксиду і об'єм води, потрібні для виготовлення розчину масою 800 г з масовою часткою лугу 0,2. Потрібні формули наведені на малюнках 7.2 і 7.3. Використовуючи їх, можна, зокрема, обчислити масу речовини у розчині за її масовою часткою та масою розчину, вирахувати масу води у ньому та її об'єм.

Завдання
Завдання
Усно обчисліть масову частку натрій нітрату в його насиченому розчині за 35 °С.
Ви вже знаєте, що чимало речовин, солей зокрема, кристалізуються з розчинів у вигляді гідратів. Тому, якщо треба виготовити розчин з використанням кристалогідрату, слід спочатку обчислити масу та кількість (у молях) безводної солі, яка відповідає необхідній масі кристалогідрату. Оскільки кількості (у молях) безводної солі й кристалогідрату рівні, можна обчислити масу кристалогідрату. Масу води обчислюють за різницею маси розчину й кристалогідрату.
Наприклад, обчислимо об'єм води й масу купрум(ІІ) сульфату, пентагідрату, необхідні для виготовлення розчину купрум(ІІ) сульфату масою 200 г з масовою часткою солі 0,08. Для цього пригадаємо: яка хімічна формула відповідає назві купрум(ІІ) сульфат, пентагідрат; як обчислюють молярну масу кристалогідрату; як обчислюють масу речовини за її кількістю (у молях).

Отже, ці та інші типи розрахунків, пов'язані з виготовленням розчинів (розбавляння, упарювання, добавляння розчинюваної речовини, змішування кількох розчинів), ґрунтуються на розумінні понять «ціле», «частка від цілого», «розчин», «розчинник», «розчинювана речовина», «масова частка компонента розчину», «кристалогідрат», знанні співвідношень, представлених на малюнках 7.2 і 7.3, та вмінні ними оперувати.
Уміння обчислювати маси компонентів розчину необхідні під час роботи в хімічних лабораторіях і на багатьох виробництвах. Знадобляться вони й у побуті, щоб виготовити розчини залізного або мідного купоросу (пригадайте, для чого їх застосовують), розчини для засолювання овочів. Одержання столового оцту розбавлянням оцтової есенції також потребує згадуваних умінь. Як правильно виготовити розчин з певною масовою часткою розчиненої речовини, ви дізнаєтеся з наступного параграфа.
Застосуйте свої знання й уміння
1. Виберіть правильне твердження. Масова частка розчиненої речовини - це:
А Відношення маси розчину до маси розчиненої речовини; Б Відношення маси розчинника до маси розчину; В Відношення маси розчиненої речовини до маси розчинника; Г Відношення маси розчиненої речовини до маси розчину.
2. Виберіть правильне твердження. Масову частку розчиненої речовини позначають літерою: А w; Б p; В x; Г ф.
3. Виберіть усі правильні твердження. Масову частку розчиненої речовини виражають у: А Літрах; Б Відсотках; В Градусах; Г Частках від одиниці; Д Грамах.
4. Встановіть відповідність між складом розчинів і масовими частками розчинених речовин.
|
Склад розчинів
(NaСІ), г V(Н2О), мл
1 15 285
2 20 180
3 5 395
4 4 196
|
Масова частка розчиненої речовини,%
А 10
Б 5
В 1,25
Г 2
Д 2,5
|
5. Обчисліть масу оцтової кислоти в 6 %-му столовому оцті об'ємом 1 л і густиною 1кгл
6. Обчисліть масу оцтової кислоти в оцтовій есенції масою 250 г з масовою часткою оцтової кислоти 0,7.
7. Обчисліть масу порції столового оцту з масовою часткою оцтової кислоти 9%, якщо маса оцтової кислоти в ній становить 175 г. Обчисліть об’єм води в цій порції оцту.
8. У так званому фізіологічному розчині масова частка натрій хлориду становить 0,9%. Обчисліть масу солі та об’єм води, потрібні для виготовлення фізіологічного розчину об'ємом 1 л та густиною 1 кгл. Поясніть, як перевірити, істинним чи колоїдним є фізіологічний розчин.
9. Обчисліть масу води в нашатирному спирті об'ємом 40 мл - розчині з масовою часткою амоніаку 10 % та густиною 1 гмл.
10. Обчисліть масові частки солей у насичених розчинах: а) калій нітрату за 20°С; б) калій хлориду за 10°С; в) калій дихромату за 100°С; г) калій хлориду за 70 °С; д) кальцій хлориду за 70°С; ж) плюмбум(ІІ) нітрату за 55 °С.
11. Виберіть правильну відповідь. Масова частка ферум(ІІ) сульфату в розчині, для виготовлення якого було взято залізний купорос масою 27,8 г і воду об'ємом 744,8 мл, дорівнює:
А 10 %; Б 2 %; В 27,8 %; Г 13,9 %; Д 7,6 %.
12. Визначте масову частку купрум(II) сульфату в розчині, який утвориться внаслідок змішування мідного купоросу масою 50 г з водою об'ємом 750 мл.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Повний перелік тем з хімії, календарний план по всім предметам згідно шкільної програми, домашня робота, курси та завдання з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|