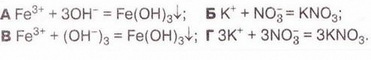|
|
|
| Строка 3: |
Строка 3: |
| | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Розв'язування розрахункових задач №3.</metakeywords>РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №3<br> | | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Розв'язування розрахункових задач №3.</metakeywords>РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №3<br> |
| | | | |
| - | <br> | + | <br> |
| | | | |
| - | ЛАБОРАТОРНІ ДОСЛІДИ
| + | ''<u>Завдання</u>''<br> |
| | | | |
| - | Пригадайте й неухильно виконуйте ПРАВИЛА ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС РОБОТИ З ОБЛАДНАННЯМ І РЕАКТИВАМИ
| + | Виберіть скорочене йонне рівняння, яке відповідає реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині: |
| | | | |
| - | <u>Реакції обміну в розчинах електролітів</u>
| + | [[Image:Chemistry_81_3.jpg]] |
| | | | |
| - | <u>''Завдання''</u>'' ''
| + | З'ясуймо, за яких ще умов, окрім утворення осаду, реакції обміну у розчинах електролітів будуть необоротними - тобто відбуватимуться до кінця. Дослідімо реакцію між натрій гідроксидом і нітратною кислотою у розчині. Наочно пересвідчитися у перебігу реакції нейтралізації допоможе застосування індикатора. До розчину натрій гідроксиду добавмо кілька крапель спиртового розчину фенолфталеїну - специфічного індикатора лужного середовища. Ви, звичайно, пам'ятаєте, що під дією гідроксид-аніонів фенолфталеїн набуває малинового забарвлення. Краплями, щоразу обережно струшуючи колбу, добавлятимемо розбавлену нітратну кислоту (мал. 12.3), аж поки малинове забарвлення фенолфталеїну не зникне. Знебарвлення розчину свідчить про нейтралізацію лугу кислотою: |
| | | | |
| - | 1. Проробіть досліди (варіант виконання вкаже вчитель хімії). Для ліпшого спостереження за перебігом реакцій використовуйте чорно-білий екран. Якщо досліди виконуєте у заглибинах пластини, беріть реактивів удвічі менше порівняно з кількостями, потрібними для дослідів у пробірках.
| + | NaOH + HNO<sub>3</sub> = NaN0<sub>3</sub> + Н<sub>2</sub>0 |
| | | | |
| - | 2. Опишіть і поясніть спостереження, складіть рівняння реакцій, запишіть їх у повній і (де це можливо) скороченій йонній формі. За потреби скористайтесь таблицею «Розчинність кислот, основ і солей у воді» (див. додаток).
| + | [[Image:Chemistry_82.jpg]] |
| | | | |
| - | 3. Після завершення роботи обговоріть свої спостереження та складені скорочені йонні рівняння із сусідом по парті, який виконував інший варіант дослідів. Порівняйте висновки, яких ви дійшли. Які рівняння, на вашу думку, відображають суть реакцій обміну між електролітами у розчині?
| + | За допомогою таблиці розчинності (див. додаток) визначмо, що з чотирьох речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій гідроксид (луг), нітратна кислота і натрій нітрат розчинна сіль. Вода - дуже слабкий електроліт, тож практично не дисоціює. З огляду на це, запишімо повне йонне рівняння реакції між натрій гідроксидом і нітратною кислотою у розчині: |
| | | | |
| - | [[Image:Chemistry_84jpg.jpg]] | + | [[Image:Chemistry_82_3.jpg]] |
| | | | |
| - | Обладнання: штатив з пробірками або пластина із заглибинами, скляні палички, чорно-білий екран.
| + | Очевидно, що молекули води утворюються внаслідок взаємодії у розчині катіонів Гідрогену й гідроксид-аніонів. |
| | | | |
| - | ''І варіант''
| + | Отже, реакція обміну між електролітами у розчині практично необоротна, якщо один з продуктів - дуже слабкий електроліт, наприклад вода, або інша малодисоційована речовина.<br> <br> <br> |
| - | | + | |
| - | Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій нітрату, калій гідроксиду; хлоридна кислота.
| + | |
| - | | + | |
| - | № 2. Реакції обміну в розчинах електролітів з випаданням осаду
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 5 крапель розчину купрум(ІІ) сульфату і добавте 5 крапель розчину калій гідроксиду.
| + | |
| - | | + | |
| - | № 3. Реакції обміну в розчинах електролітів з виділенням газу
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі хлоридної кислоти.
| + | |
| - | | + | |
| - | № 4. Реакції обміну в розчинах електролітів з утворенням води
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 3-4 краплі розчину калій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину?
| + | |
| - | | + | |
| - | Добавте краплю хлоридної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився.
| + | |
| - | | + | |
| - | Додатково.* Змішування розчинів купрум(ІІ) сульфату і натрій нітрату.
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій нітрату. Чи є ознаки перебігу реакції? Складіть рівняння реакції, запишіть його у повному йонному вигляді. Поясніть, чи можна скласти скорочене йонне рівняння. Зробіть висновок, чи відбулася хімічна реакція.
| + | |
| - | | + | |
| - | ''II варіант''
| + | |
| - | | + | |
| - | Реактиви: розчини купрум(ІІ) сульфату, натрій карбонату, натрій хлориду, натрій гідроксиду, сульфатної кислоти.
| + | |
| - | | + | |
| - | № 2. Реакції обміну в розчинах електролітів з випаданням осаду
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 5 крапель розчину купрум(П) сульфату і добавте 5 крапель розчину натрій гідроксиду.
| + | |
| - | | + | |
| - | № 3. Реакції обміну в розчинах електролітів з виділенням газу
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку налийте концентрований розчин натрій карбонату об'ємом 1 мл і добавте 3-4 краплі розчину сульфатної кислоти.
| + | |
| - | | + | |
| - | № 4. Реакції обміну в розчинах електролітів з утворенням води
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 3-4 краплі розчину натрій гідроксиду і одну краплю розчину фенолфталеїну. Яке забарвлення розчину?<br>Добавте краплю розчину сульфатної кислоти, перемішуючи рідину скляною паличкою. Якщо розчин не знебарвиться, добавте ще краплю кислоти. Поясніть, чому розчин знебарвився.
| + | |
| - | | + | |
| - | Додатково. * Змішування розчинів купрум(П) сульфату і натрій хлориду.
| + | |
| - | | + | |
| - | Інструкція
| + | |
| - | | + | |
| - | У пробірку внесіть 3-4 краплі розчину купрум(ІІ) сульфату й добавте стільки само крапель розчину натрій хлориду. Чи є ознаки перебігу реакції? Поясніть, чи можна скласти скорочене йонне рівняння цієї реакції. Зробіть висновок, чи відбулася хімічна реакція.<br><br>
| + | |
| | | | |
| | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | | ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' |
Версия 13:10, 2 апреля 2010
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розв'язування розрахункових задач №3
РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ №3
Завдання
Виберіть скорочене йонне рівняння, яке відповідає реакції між ферум(ІІІ) нітратом і калій гідроксидом у розчині:
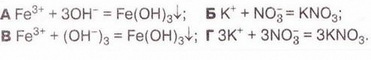
З'ясуймо, за яких ще умов, окрім утворення осаду, реакції обміну у розчинах електролітів будуть необоротними - тобто відбуватимуться до кінця. Дослідімо реакцію між натрій гідроксидом і нітратною кислотою у розчині. Наочно пересвідчитися у перебігу реакції нейтралізації допоможе застосування індикатора. До розчину натрій гідроксиду добавмо кілька крапель спиртового розчину фенолфталеїну - специфічного індикатора лужного середовища. Ви, звичайно, пам'ятаєте, що під дією гідроксид-аніонів фенолфталеїн набуває малинового забарвлення. Краплями, щоразу обережно струшуючи колбу, добавлятимемо розбавлену нітратну кислоту (мал. 12.3), аж поки малинове забарвлення фенолфталеїну не зникне. Знебарвлення розчину свідчить про нейтралізацію лугу кислотою:
NaOH + HNO3 = NaN03 + Н20

За допомогою таблиці розчинності (див. додаток) визначмо, що з чотирьох речовин - реагентів і продуктів реакції - до сильних електролітів належать три. Це натрій гідроксид (луг), нітратна кислота і натрій нітрат розчинна сіль. Вода - дуже слабкий електроліт, тож практично не дисоціює. З огляду на це, запишімо повне йонне рівняння реакції між натрій гідроксидом і нітратною кислотою у розчині:
Очевидно, що молекули води утворюються внаслідок взаємодії у розчині катіонів Гідрогену й гідроксид-аніонів.
Отже, реакція обміну між електролітами у розчині практично необоротна, якщо один з продуктів - дуже слабкий електроліт, наприклад вода, або інша малодисоційована речовина.
Г. А. Лашевська, Геометрія, 9 клас
Вислано читачами з інтернет-сайтів
Матеріали з хімії, завдання та відповіді по класам, плани конспектів уроків з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|