Версия 07:33, 31 марта 2010Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Хімія: Розчинність, її залежність від різних чинників. Фізико-хiмічна суть процесу розчинення. Поняття про кристалогідрати
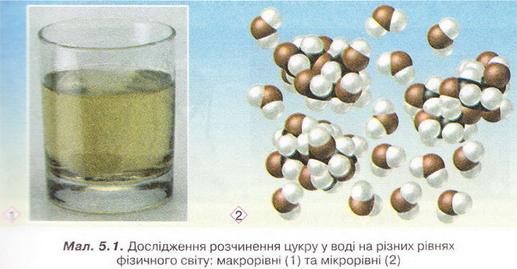
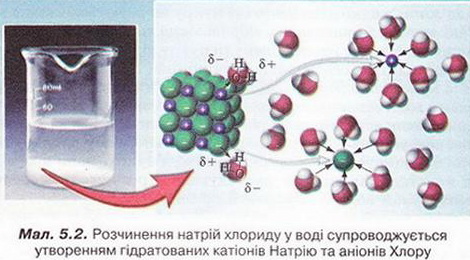
Фізико-хімічна суть процесу розчинення. Поняття про кристалогідрати та теплові явища, що супроводжують розчинення речовин Після опрацювання § 5 ви зможете: пояснювати суть процесів розчинення, вплив на них різних чинників. На шляху до успіху пригадаємо з вивчених курсів природознавства хімії, фізики: • Фізико-хімічна суть процесу розчинення, у чому вона полягає? Спробуймо відповісти на це запитання, звернувшись до простих дослідів із розчинення речовин, добре відомих вам з повсякденного життя. До склянки з водою помістимо грудочку цукру (мал. 5.1,1). Поступово вона зменшуватиметься аж до повного «зникнення». Такі зміни ми спостерігатимемо на макрорівні фізичного світу. Завдання Спираючись на власний досвід приготування чаю, назвіть дві умови, за яких розчинення цукру пришвидшується. Спостережувані явища зумовлені складними процесами, які відбуваються між молекулами цукру і води на мікрорівні. Молекули цукру містять полярні гідроксильні групи (докладніше про будову молекули сахарози ви дізнаєтеся, вивчаючи органічні речовини). Саме тому на поверхні кристала цукру між молекулами сахарози і води утворюються водневі зв'язки: з однією молекулою цукру зв'язуються кілька молекул води. Такі молекули називають гідратованими. Тепловий рух молекул л:ли змушує зв'язані з ними молекули цукру відокремлюватися від кристала й переходити у середовище розчинника. Молекули цукру, які перейшли із кристала в розчин, хаотично пересуваються у ньому разом із молекулами води завдяки тепловому руху. Це явище, добре відоме вам з курсу природознавства, називають дифузією. Процес дифузії відбувається досить повільно, тому поблизу поверхні кристалів накопичується надлишок молекул цукру. Вони вже відокремлені від кристала, але ще не дифундували в розчин. Це перешкоджає новим молекулам води наблизитися до поверхні кристала та утворити водневі зв'язки з його молекулами. Під час перемішування розчину дифузія відбувається інтенсивніше, тож розчинення цукру пришвидшується. Згодом гідратовані молекули цукру рівномірно розподіляються між молекулами води. Молекули цукру не тільки відокремлюються від кристала, а й знов приєднуються до нього з розчину. Якщо цукру взято порівняно небагато, у розчин переходить більше його молекул, ніж приєднується до кристала, - відбувається розчинення. Якщо вода контактує з більшою кількістю кристалів, то кількість молекул, які відокремлюються від кристала и приєднуються до нього, стає однаковою, розчин насичується. Тому на макрорівні спостерігаємо припинення розчинення, хоча на мікрорівні взаємозворотні процеси розчинення й кристалізації тривають. Докладніше про насичені розчини йтиметься у наступному параграфі. Під час розчинення йонних кристалів диполі води взаємодіють із йонами кристалічних ґраток завдяки електростатичним силам (особливості цієї взаємодії ви щойно вивчали на уроках фізики). Завдання За малюнком 5.2 опишіть явища, які відбуваються під час розчинення натрій хлориду (головної складової кухонної солі) у воді. Унаслідок цього процесу утворюються гідратовані йони. Які спостережувані на макрорівні зміни свідчать про це? Наприклад, у безводному купрум(II) сульфаті (мал. 5.3,1) катіон Купруму(II) безбарвний, а у водному розчині купрум(ІІ) сульфату (мал. 5.3,2) гідратований катіон Купруму(II) має блакитне забарвлення (мал. 5.3,3). Отже, розчинення речовин супроводжується взаємодією розчинника розчиненої речовини. Якщо розчинник - вода, процес називають гідра-тацією, а його продукти — гідратами. Тобто компонентами розчину є розчинник, розчинена речовина і продукти їхньої взаємодії. Під час випарювання водних розчинів деяких твердих речовин утворюються так звані кристалогідрати - кристали, до складу яких входять молекули води. Наприклад, одна формульна одиниця мідного купоросу – чи не найвідомішого кристалогідрату - містить п'ять молекул води мал. 5.3,4). Хімічна формула мідного купоросу СuS04 • 5Н20*. Кристалогідрати порівняно нестійкі й згодом розкладаються, втрачаючи кристалізаційну воду. Цьому процесу так званого вивітрювання сприяють підвищення температури та низька вологість повітря. Безводні кристали деяких речовин гігроскопічні й поглинають воду з навколишнього середовища, утворюючи кристалогідрати. Наприклад, безводний купрум(ІІ) хлорид треба зберігати у щільно закоркованій понині аби запобігти доступу повітря. Якщо посудина відкрита, безводна сіль вбирає з повітря вологу й поступово перетворюється на кристалогідрат. Чимало мінералів є кристалогідратами, наприклад трона (мал. 5.4.). Деякі речовини (поміж них є й органічні) у чистому вигляді можна добути тільки у формі кристалогідратів. Кристали добре відомої васм харчової лимонної кислоти є мононогідратом цієї речовини. Однак у складі шипучих лікарських форм і сухих концентратів солодких напоїв використовують не кристалогідрат, а везводну лимонну кислоту. Завдання Поміркуйте й висловіть припущення, чому до складу шипучих лікарських форм, сухих концентратів солодких напоїв та начинки льодяників «Шипучка» газом із питною содою входить безводна лимонна кислота, а не її моногідрат. • Мідний купорос - тривіальна назва сполуки складу СuS04 • 5Н20, за систематичною номенклатурою її називають так: купрум (II) сульфат, пентагідрат. Префікс пента- означає «п'ять». Для позначення кількості молекул кристалізаційНОЇ води у формульній одиниці кристалогідрату використовують й інші префікси: моно- - «один», ди- - «два», гепта- - «сім», дека- - «десять» тощо. Знак - « • » у формулах кристалогідратів не є знаком множення. Тому під час обчислення відносної формульної маси кристалогідрату слід до відносної формульної маси безводної солі додати відносну масу певної кількості молекул води: Мr(СuS04 • 5Н20) = Мr(СuS04) + 5Мr(Н20) = = 64 + 32 + 4 • 16 + 5 • (2 • 1 + 16) = 250 Розгляньмо найважливіші кристалогідрати, які широко використовують у повсякденному житті. Мідний купорос запобігає розвитку пліснявих грибів, тому входить до складу численних сумішей, які використовують у будівництві та ремонті квартир. Також він ефективний у боротьбі зі шкідниками рослин і як мікродобриво. З цією ж метою застосовують інший кристалогідрат - ферум(ІІ) сульфат, гептагідрат -залізний купорос FеS04 • 7Н20. Натрій сульфат, декагідрат - глауберова сіль Nа2S04 • 10Н2О - перевірене часом послаблююче у медицині та ветеринарії. Натрій карбонат, декагідрат -кристалічна сода Nа2С03 • 10Н2О. Цю сполуку застосовують, зокрема, у виробництві засобів для миття і чищення. Вже згадуваний мінерал трону використовують як компонент пральних порошків нового покоління. Отже окрім розчинника та розчинюваної речовини, у водному розчині містяться й продукти їхньої взаємодії - гідрати. У процесі розчинення беруть участь сили як фізичної, так і хімічної природи. Процес розчинення внаслідок взаємодії компонентів розчину супроводжується різними явищами, наприклад зміною кольору під час гідратації деяких йонів або зменшенням об'єму розчину етилового спирту у воді, порівняно із сумою об'ємів цих рідин до змішування (мал. 5.5). • Теплові явища, що супроводжують розчинення речовин, також є наслідком взаємодії компонентів розчину. Молекули води руйнують зв'язки між структурними частинками розчинюваної речовини молекулами або йонами. Під час цього процесу утворюються продукти приєднання молекул води до частинок розчинюваної речовини - гідрати. На руйнування зв'язків між частинками розчинюваної речовини енергія (Е1) витрачається. Утворення зв'язків між частинками розчиненої речовини і молекулами розчинника супроводжується виділенням енергії (Е2). Якщо Е1 > Е2, розчин охолоджується, якщо Е1 < Е2, розчин нагрівається. Приміром, якщо до шматочків льоду обережно добавити концентровану сульфатну кислоту, лід розтопиться. Адже розчинення у воді концентрованої сульфатної кислоти супроводжується виділенням теплоти. Виконаємо дослід. Доведемо, що розчинення амоній тіоціанату супроводжується поглинанням теплоти. Добавимо воду у хімічну склянку з амоній тіоціанатом. Змочимо водою фанерну дощечку. Розчин охолоджується настільки, що хімічна склянка примерзає до дощечки. Теплові явища під час розчинення використовують для виготовлення охолоджувальних сумішей і так званих хімічних грілок. Органічна речовина карбамід (сечовина), наприклад, відома вам як складова деяких жувальних гумок. Її розчинення у воді супроводжується поглинанням теплоти, тому цю сполуку у складі пакетів швидкого охолодження застосовують для надання першої медичної допомоги. Також у таких пакетах використовують амоній нітрат. Зворотним до процесу розчинення є процес кристалізації, який також може супроводжуватися помітними тепловими ефектами. Докладніше про це йтиметься у наступному параграфі. Стисло про головне Розчин - однофазна гомогенна система, яка складається з розчинюваної речовини, розчинника і продуктів їхньої взаємодії. Розчинення - складний фізико-хімічний процес, його не можна зводити до простого механічного розподілення частинок розчинюваної речовини поміж частинками розчинника. Під час розчинення змінюють деякі властивості компонентів розчину, розриваються одні й утворюються інші хімічні зв'язки. Однак розчин не має сталого складу. Тож його не можна вважати ані сумішшю, ані індивідуальною сполукою. Спостережувані на макрорівні явища, якими супроводжується розчинення, зумовлені складними процесами, які відбуваються на мікрорівні між структурними частинками розчинюваної речовини і диполями води. Розчинення речовин з полярними молекулами супроводжується утворенням водневих зв'язків між ними і диполями води. Руйнування під час розчинення кристалічних ґраток йонних речовин зумовлене електростатичними йон-дипольними взаємодіями. Наприклад, коли кристали натрій хлориду (кухонної солі) потрапляють у воду, то під впливом електростатичних сил притягання утворюються зв'язки між йонами кристалічних ґраток і диполями води. Кристалічні ґратки натрій хлориду руйнуються, і утворюються гідратовані йони. Під час розчинення речовин структурні частинки розчинника і розчиненої речовини взаємодіють. Про це свідчать різноманітні зовнішні ефекти: зміна кольору під час гідратації деяких йонів, зменшення об'єму розчину порівняно із сумою об'ємів рідин до змішування та теплові явища. Якщо розчинник - вода, процес взаємодії її молекул із частинками розчинюваної речовини називають гідратацією, а його продукти - гідратами. Під час випарювання водних розчинів деяких твердих речовин утворюються так звані кристалогідрати - кристали, до складу яких входять молекули Кристалогідратами є чимало мінералів. Найважливіші кристалогідрати, широко використовувані у повсякденному житті, - харчова лимонна кислота, мідний і залізний купороси, глауберова сіль, кристалічна сода тощо. Застосуйте свої знання й уміння 1. Наведіть уточнене визначення поняття «розчин». 2. Виберіть рівень фізичного світу, на якому відбувається взаємодія між структурними частинками розчинника і розчинюваної речовини: А Мікросвіт; Б Макросвіт; В Мегасвіт. 3. Назвіть рівень фізичного світу, який відповідає зовнішнім ефектам, що супроводжують розчинення речовин. 4. Установіть відповідність між речовинами і типами взаємодії їхніх структурних частинок із молекулами води під час розчинення.
5. Назвіть тип зв'язків, які утворюються у розчині між молекулами цукру (сахарози) і диполями води. 6. Виберіть назву процесу взаємодії молекул води із частинками розчинюваої речовини у розчині: 7. Виберіть загальну назву продуктів взаємодії структурних частинок розчиненої речовини з молекулами води у розчині: 8. Визначте, модель якого процесу описано: на першому поверсі великого двоповерхового супермаркету розташовані службові приміщення й камера схову, а на другому - торговельний зал. Поверхи сполучені двома ескалаторами. На початку робочого дня перші покупці піднімаються в торговельний зал, потік їх усе збільшується, але зворотного руху поки що немає, оскільки ніхто ще не встигнув зробити покупки. Згодом зворотний потік покупців починає збільшуватися, ідо середини робочого дня потоки покупців на обох ескалаторах вирівнюються. Встановлюється своєрідна рівновага: чисельність покупців у торговельному залі практично незмінна, хоча щохвилини відбувається їхнє оновлення. Аргументуйте свою думку. 9. Прочитайте уривок із твору Михайла Булгакова «Собаче серце»: «У приймальні, - покірно відповів Шариков, - зелена, як купорос. Зелена книжка...» Висловіть припущення, про яку речовину йдеться. Скарбничка досвіду Роздивіться фрагмент (1) малюнка 5.6, опишіть його і поясніть зміни, зображені на ньому. Спрогнозуйте зміни, які відбудуться з «чарівною» статуеткою, кщо її: а) зволожити (2); б) висушити гарячим повітрям (3). Дізнайтеся, використовуючи різноманітні джерела інформації, шаром якої речовини вкрито статуетку. Запропонуйте практичне застосування цієї властивості речовини. Під керівництвом учителя хімії реалізуйте свій проект. За результатами дослідження підготуйте презентацію.
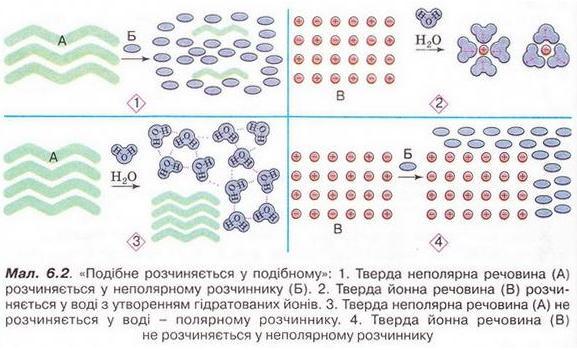
Розчинність, її залежність від різних чинників. Насичені й ненасичені розчини Після опрацювання § 6 ви зможете: пояснювати вплив різних чинників на розчинення; розрізняти насичені й ненасичені розчини. На шляху до успіху пригадаємо з вивчених курсів природознавства, хімії, фізики, географії: • Розчинність - це максимальна маса речовини, яка може за певних умов (температури, тиску) розчинитися у розчиннику масою 100 г. Розчинність залежить від природи розчинюваної речовини і розчинника, температури й (для газуватих речовин) тиску. Деякі речовини необмежено розчиняються у воді. Це сульфатна, нітратна, оцтова кислоти, гідроген пероксид, винний спирт (етанол) тощо. Розрізняють добре розчинні речовини. їхня розчинність становить понад 10 г. Пригадайте курс хімії 8-го класу: гідроген хлорид добре розчиняється у воді. Розчинність малорозчинних речовин становить від 0,001 г до 1 г. Азот малорозчинний у воді. Кальцій карбонат (крейда) - приклад практично нерозчинної речовини, оскільки її розчинність у воді менша за 0,001 г. Завдання Проте абсолютно нерозчинних речовин не існує. Навіть малоактивні метали здатні незначним чином розчинятися у воді. Аби мати гладеньку шкіру та ніжний рум'янець, слов'янські красуні здавна вмивались водою із срібного глечика. Й дотепер люди використовують бактерицидні властивості срібла. Розгляньмо чинники, які впливають на розчинність речовин, докладніше. Неабияке значення мають природа розчинюваної речовини і розчинника. Як це пояснити? Під час утворення розчину зв'язки між частинками кожного з його компонентів замінюються на зв'язки між частинками різних компонентів. Аби нові зв'язки могли утворюватися, компоненти розчину повинні мати однотипні зв'язки, тобто бути однієї природи (мал. 6.1). Саме тому у неполярних розчинниках добре розчиняється чимало молекулярних речовин із ковалентним неполярним типом зв'язку. Приміром, кисень, малорозчинна у воді речовина, значно ліпше розчиняється у неполярному розчиннику - бензені. Різну розчинність речовин використовують для розділення сумішей. Наприклад, розділення суміші йоду й спирту ґрунтується на різній розчинності йоду у воді й спирті. У спирті неполярна речовина йод розчиняється значно ліпше. Це пояснюється більшою полярністю молекул води порівняно з молекулами спирту. Натомість спирт і вода мають необмежену взаємну розчинність. Якщо налити у склянку однакові порції миртової йодної настойки й холодної води, то незабаром на дно склянки осядуть кристали йоду. Завдання Поміркуйте й поясніть, у яких розчинниках - полярних чи неполярних - мають ліпше розчинятися йонні речовини (мал. 6.2). Розчинність твердих речовин з підвищенням температури здебільшого зростає. Розчинність газів залежить не лише від температури, а й від тиску. Певні висновки щодо цих закономірностей можна зробити, виконуючи прості досліди. Аби з'ясувати, як впливає зміна тиску на розчинність газів, треба лише відкоркувати бляшанку з улюбленим газованим напоєм. Тиск у закритій бляшанці з ним підвищений (мал. 6.3,1), але після відкорковування знижується до атмосферного, і з розчину починають виділятися бульбашки вуглекислого газу (мал. 6.3,2). Отже, зі зменшенням тиску розчинність вуглекислого газу зменшується. Завдання Роздивіться малюнок 6.4 і спробуйте пояснити, чому зі зростанням тиску розчинність газів збільшується. Задля з'ясування впливу температури на розчинність вуглекислого газу у воді візьмемо дві однакові пластикові пляшки з газованою водою. Одну з пляшок охолодимо у холодильнику, а другу нагріємо, зануривши з посудину з теплою водою. Одночасно відкоркуємо обидві пляшки й порівняймо інтенсивність виділення бульбашок вуглекислого газу з розчинів. На відміну від більшльшості твердих речовин, розчинність газів зі зростанням температури зменшується, тому з нагрітого розчину газ виділяється інтенсивніше, ніж з охолодженного. Застосуйте свої знання й уміння 1. Виберіть правильне продовження визначення поняття «розчинність». Це максимальна маса речовини, яка може за певних умов (температури, тиску) розчинитися в: 2. Використовуючи таблицю розчинності (див. додаток), виберіть з переліку практично нерозчинні речовини: 3. Використовуючи таблицю розчинності (див. додаток), наведіть кілька прикладів малорозчинних речовин. 4. Виберіть усі правильні твердження. Аби зробити насичений розчин ненасиченим, треба його: 5. Назвіть чинники, від яких залежить розчинність: а) кристалічних речовин; б) газів. 6. Глауберову сіль видобувають у заливі Кара-Богаз-Гол лише взимку. Влітку видобуток солі припиняють. Пригадайте чинники, які впливають на розчинність, і поясніть, чим зумовлена сезонність цього виробництва. 7. Поясніть, чому в спекотну погоду риби потерпають від нестачі кисню у водоймах. Скарбничка досвіду 1. Роздивіться малюнок 6.8. Чи хотіли б ви виростити власний «кристалічний сад»? Реалізуйте проект і підготуйте презентацію свого доробку. Вам знадобляться пластикові блюдця та столові ложки, пористий пакувальний картон, ножиці. Для виготовлення розчину необхідно взяти по дві столові ложки кухонної солі (не йодованої!), води та водорозчинні харчові барвники. Про решту компонентів ви дізнаєтеся від учителя хімії, під його керівництвом виготовите розчин. Цей розчин треба налити в пластикові блюдця з картонними фігурками дерев. Спостерігайте за перебігом подій і фіксуйте результати спостережень. Назвіть і поясніть спостережувані явища. 2. Щойно відкорковані газовані напої - пересичені розчини, отже - нестійкі системи. Візьміть кілька пластикових пляшок газованого напою, наприклад «Кока-коли». Поставте пластмасову склянку в широку посудину (наприклад, миску). Швидко наповніть щойно відкоркованим газовим напоєм склянку до половини і вкиньте в неї таблетку «Ментос» - його використовують для освіження ротової порожнини. Спостереження зафіксуйте за допомогою фотоапарата або відеокамери. Перевірте, чи відбуваються такі самі явища, якщо використати інші газовані напої та, приміром, таблетки активованого вугілля чи шипучої форми аспірину. Висловіть припущення щодо причин спостережуваних явищ. Поміркуйте, яких правил безпеки життєдіяльності варто дотримуватись у побуті під час вживання газованих напоїв.
Зміст уроку
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Авторські права | Privacy Policy |FAQ | Партнери | Контакти | Кейс-уроки
© Автор системы образования 7W и Гипермаркета Знаний - Владимир Спиваковский
При использовании материалов ресурса
ссылка на edufuture.biz обязательна (для интернет ресурсов -
гиперссылка).
edufuture.biz 2008-© Все права защищены.
Сайт edufuture.biz является порталом, в котором не предусмотрены темы политики, наркомании, алкоголизма, курения и других "взрослых" тем.
Ждем Ваши замечания и предложения на email: 
По вопросам рекламы и спонсорства пишите на email: