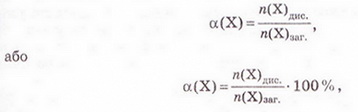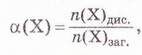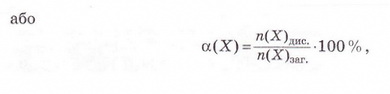|
|
|
| (6 промежуточных версий не показаны.) | | Строка 1: |
Строка 1: |
| - | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Хімія: Ступінь дисоціації. Сильні і слабкі електроліти''' | + | '''[[Гіпермаркет Знань - перший в світі!|Гіпермаркет Знань]]>>[[Хімія|Хімія]]>>[[Хімія 9 клас|Хімія 9 клас]]>> Ступінь дисоціації. Сильні і слабкі електроліти'''<br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Ступінь дисоціації, Сильні і слабкі електроліти.</metakeywords> |
| | | | |
| - | <br> <metakeywords>Хімія, клас, урок, на тему, 9 клас, Ступінь дисоціації, Сильні і слабкі електроліти.</metakeywords>СТУПІНЬ ДИСОЦІАЦІЇ. СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ | + | <br> |
| | + | |
| | + | СТУПІНЬ ДИСОЦІАЦІЇ. СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ |
| | + | |
| | + | <br> |
| | + | |
| | + | <u>Ступінь дисоціації. Сильні й слабкі електроліти</u> |
| | + | |
| | + | <br> |
| | + | |
| | + | ''• Ступінь [[Електролітична дисоціація кислот, основ, солей у водних розчинах|дисоціації]] -'' кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Вивчаючи [[Електролітична дисоціація кислот, основ, солей у водних розчинах|електролітичну дисоціацію]], ми з'ясували, що це оборотний процес. Тобто поряд із розпадом кристалів або молекул на йони може відбуватися асоціація [[Презентація уроку «Атоми, молекули, йони. Хімічні елементи, їхні назви і символи»|йонів]]. Адже гідратовані йони, які хаотично рухаються в розчині, можуть стикатися й знов сполучатися між собою. Наразі розгляньмо це питання докладніше. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули. |
| | + | |
| | + | '''Завдання''' |
| | + | |
| | + | ''Оцініть доцільність доповнення схеми на малюнку 3.2 компонентом «йонно-молекулярні розчини».'' |
| | + | |
| | + | Ступінь електролітичної дисоціації - це відношення числа молекул формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини. |
| | + | |
| | + | Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляємо «альфа»). її виражають у частках одиниці або у відсотках: |
| | + | |
| | + | [[Image:Chemistry 75.jpg|формула. фото]] |
| | + | |
| | + | де n(Х) дис. - число формульних одиниць електроліту, які розпалися на йони, а n(Х)заг. - загальне число формульних одиниць електроліту. |
| | + | |
| | + | Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул [[13. Кислоти, їх склад, назви|кислоти тридцять]] розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1): |
| | + | |
| | + | а(НF) = 0,3(30 %) |
| | + | |
| | + | [[Image:Chemistry 75 1.jpg|ступінь дисоціації фторидної кислоти. фото]] |
| | + | |
| | + | '''Завдання''' |
| | + | |
| | + | ''1. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 100 молекул якої 15 розпалися на йони:'' |
| | + | |
| | + | ''А 0,15; Б 115; В 0,015; Г 1,5.'' |
| | + | |
| | + | ''2. Виберіть співвідношення кількості дисоційованих і недисоційованих молекул кислоти, ступінь дисоціації якої 0,2 (20 %):'' |
| | + | |
| | + | ''А 1 : 5; Б 1 : 50; В 1 : 4; Г 1 : 8.'' |
| | + | |
| | + | Ступінь дисоціації [[Електроліти та неелектроліти|електролітів визначають]] експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину. |
| | + | |
| | + | ''• Сильні й слабкі електроліти ''різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими. |
| | + | |
| | + | Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. З класифікацією кислот на сильні и слабкі ви ознайомилися минулого року (див. схему). |
| | + | |
| | + | [[Image:Chemistry 76.jpg|Сильні й слабки кислоти. фото]] |
| | + | |
| | + | Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів. |
| | + | |
| | + | Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С0<sub>2</sub> • Н<sub>2</sub>0). Добре відомі вам з повсякденного<br>життя кислоти - молочна, оцтова, аскорбінова (вітамін С) й ацетил-саліцилова (аспірин) кислоти - слабкі електроліти. Сульфітна, сульфідна, силікатна кислоти (пригадайте їхні хімічні формули, за погреби зверніться до таблиці «Розчинність кислот, основ і солей у воді») також слабкі електроліти. Слабкими електролітами є й гідроксиди металічних елементів (за винятком лугів). Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 %. |
| | + | |
| | + | '''Завдання''' |
| | + | |
| | + | Роздивіться малюнок 11.2 й розташуйте зображені на ньому електроліти за зростанням їхньої сили. |
| | + | |
| | + | [[Image:Chemistry 77.jpg|Електроліти. фото]] |
| | + | |
| | + | [[Вода - найпоширеніша речовина на Землі. Повні уроки|Вода ]]- дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води. |
| | + | |
| | + | '''Стисло про головне''' |
| | + | |
| | + | Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули. |
| | + | |
| | + | Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини. |
| | + | |
| | + | Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках: |
| | + | |
| | + | [[Image:Chemistry 77 2.jpg|формула. фото]]<br> |
| | + | |
| | + | [[Image:Chemistry 78.jpg|формула. фото]] |
| | + | |
| | + | де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту. |
| | + | |
| | + | Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. |
| | + | |
| | + | Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими. |
| | + | |
| | + | Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації. |
| | + | |
| | + | Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % . |
| | + | |
| | + | Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0. |
| | + | |
| | + | '''Застосуйте свої знання й уміння''' |
| | + | |
| | + | ''1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення:'' |
| | + | |
| | + | ''A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;<br>Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;<br>В Числа молекул у розчині до числа молекул, які дисоціювали;<br>Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони.'' |
| | + | |
| | + | ''2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони:'' |
| | + | |
| | + | ''А 0,2; Б 20; В 0,02; Г 2.'' |
| | + | |
| | + | ''3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %):'' |
| | + | |
| | + | ''A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2.'' |
| | + | |
| | + | ''4. Виберіть слабкі електроліти: А HCl; Б H<sub>2</sub>S; В Н<sub>2</sub>0; Г H<sub>2</sub>S0<sub>4</sub>.'' |
| | + | |
| | + | ''5. Виберіть сильну кислоту:'' |
| | + | |
| | + | ''А Бромідна; Б Сульфідна; В Молочна; Г Силікатна.'' |
| | + | |
| | + | ''6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві?'' |
| | + | |
| | + | ''7.Встановіть відповідність між електролітами та ступенем дисоціації.'' |
| | + | |
| | + | {| cellspacing="1" cellpadding="1" border="1" width="400" |
| | + | |- |
| | + | | |
| | + | ''Електроліт'' |
| | + | |
| | + | ''1 Сильний'' |
| | + | |
| | + | ''2 Слабкий <br>'' |
| | + | |
| | + | ''<br>'' |
| | + | |
| | + | | |
| | + | ''Ступінь дисоціації'' |
| | + | |
| | + | ''А а = 0'' |
| | + | |
| | + | ''Б а → 1'' |
| | + | |
| | + | ''В 0 < а < 0,03'' |
| | + | |
| | + | |} |
| | + | |
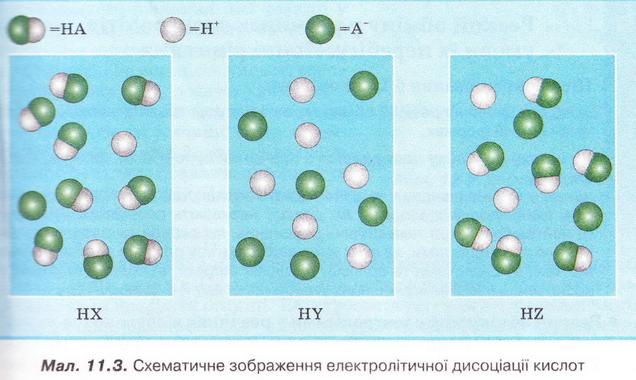
| | + | ''8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот.'' |
| | + | |
| | + | [[Image:Chemistry 79.jpg|Схематичне зображення електролітичної дисоціації кислот. фото]] |
| | | | |
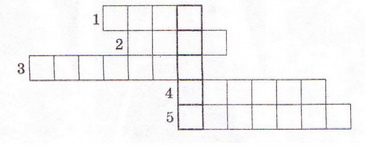
| | + | 9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом. |
| | | | |
| | + | [[Image:Chemistry 79 1.jpg|кросворд. фото]] |
| | | | |
| - | Ступінь дисоціації. Сильні й слабкі електроліти<br>Після опрацювання § 11 ви зможете:<br>наводити приклади сильних і слабких електролітів, встановлювати відмінність між ними.<br>На шляху до успіху пригадаємо з вивчених курсів хімії й математики:<br>що таке частка від цілого і як її обчислюють; що таке стандартний вигляд числа; що таке формульна одиниця речовини; які кислоти належать до сильних, а які є слабкими?<br>• Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Вивчаючи електролітичну дисоціацію, ми з'ясували, що це оборотний процес. Тобто поряд із розпадом кристалів або молекул на йони може відбуватися асоціація йонів. Адже гідратовані йони, які хаотично рухаються в розчині, можуть стикатися й знов сполучатися між собою. Наразі розгляньмо це питання докладніше. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.<br><br>Завдання<br>Оцініть доцільність доповнення схеми на малюнку 3.2 компонентом «йонно-молекулярні розчини».<br>Ступінь електролітичної дисоціації - це відношення числа молекул формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.<br>Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляємо «альфа»). її виражають у частках одиниці або у відсотках:<br><br><br>де n(Х) дис. - число формульних одиниць електроліту, які розпалися на йони, а n(Х)заг. - загальне число формульних одиниць електроліту.<br>Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1):<br>а(НF) = 0,3(30 %)<br><br>Завдання<br>1. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 100 молекул якої 15 розпалися на йони: А 0,15; Б 115; В 0,015; Г 1,5.<br>2. Виберіть співвідношення кількості дисоційованих і недисоційованих молекул кислоти, ступінь дисоціації якої 0,2 (20 %): А 1 : 5; Б 1 : 50; В 1 : 4; Г 1 : 8. <br>Ступінь дисоціації електролітів визначають експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину.<br>• Сильні й слабкі електроліти різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.<br>Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. З класифікацією кислот на сильні и слабкі ви ознайомилися минулого року (див. схему). Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів.<br>Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С02 • Н20). Добре відомі вам з повсякденного<br>життя кислоти - молочна, оцтова, аскорбінова (вітамін С) й ацетил-саліцилова (аспірин) кислоти - слабкі електроліти. Сульфітна, сульфідна, силікатна кислоти (пригадайте їхні хімічні формули, за погреби зверніться до таблиці «Розчинність кислот, основ і солей у воді») також слабкі електроліти. Слабкими електролітами є й гідроксиди металічних елементів (за винятком лугів). Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 %.<br><br>Завдання<br>Роздивіться малюнок 11.2 й розташуйте зображені на ньому електроліти за зростанням їхньої сили,<br>Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води.<br> <br>Стисло про головне<br> <br>Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах<br>на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.<br>Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.<br>Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках:<br>де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту.<br>Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо.<br>Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.<br>Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації.<br>Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % .<br>Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0.<br><br>Застосуйте свої знання й уміння<br><br>1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення:<br>A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;<br>Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;<br>В Числа молекул у розчині до числа молекул, які дисоціювали;<br>Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони.<br>2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони:<br>А 0,2; Б 20; В 0,02; Г 2.<br>3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %):<br>A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2.<br>4. Виберіть слабкі електроліти: А HCl; Б H2S; В Н20; Г H2S04.<br>5. Виберіть сильну кислоту:<br>А Бромідна; Б Сульфідна; В Молочна; Г Силікатна.<br>6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві?<br>7.Встановіть відповідність між електролітами та ступенем дисоціації.<br>Електроліт Ступінь дисоціації<br>1 Сильний Аа = 0<br>2 Слабкий Б а -> 1<br> В 0 < а < 0,03<br>8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот.<br>9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом.<br><br>Скарбничка досвіду<br>Використовуючи прилад для дослідження електропровідності рідин, дослідіть електропровідність дистильованої води та розчинів, які трапляються у побуті ( див.§ 9). З'ясуйте, чи залежить електропровідність розчину від частки розчинюваної речовини у ньому, температури тощо. Які речовини, що їх розчини було досліджено, виявилися сильними електролітами? За результатами дослідження підготуйте презентацію.<br><br>
| + | '''Скарбничка досвіду''' |
| | | | |
| - | <br> ''Г. А. Лашевська, Геометрія, 9 клас<br>Вислано читачами з інтернет-сайтів '' | + | ''Використовуючи прилад для дослідження електропровідності рідин, дослідіть електропровідність дистильованої води та розчинів, які трапляються у побуті ( див.§ 9). З'ясуйте, чи залежить електропровідність розчину від частки розчинюваної речовини у ньому, температури тощо. Які речовини, що їх розчини було досліджено, виявилися сильними електролітами? За результатами дослідження підготуйте презентацію.''<br><br> ''Г. А. Лашевська, [[Хімія 9 клас|Хімія, 9 клас]]<br>Вислано читачами з інтернет-сайтів '' |
| | | | |
| - | <br> <sub>Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 9 класу</sub> | + | <br> <sub>[[Гіпермаркет Знань - перший в світі!|Збірка конспектів]] уроків по всім класами, домашня робота, скачати реферати [[Хімія|з хімії]], книги та підручники згідно каленадарного плануванння [[Хімія 9 клас|з хімії для 9 класу]]</sub> |
| | | | |
| | <br> | | <br> |
| | | | |
| | '''<u>Зміст уроку</u>''' | | '''<u>Зміст уроку</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] конспект уроку і опорний каркас | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] конспект уроку і опорний каркас |
| - | [[Image:1236084776 kr.jpg|10x10px]] презентація уроку | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] презентація уроку |
| - | [[Image:1236084776 kr.jpg|10x10px]] акселеративні методи та інтерактивні технології | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] акселеративні методи та інтерактивні технології |
| - | [[Image:1236084776 kr.jpg|10x10px]] закриті вправи (тільки для використання вчителями) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] закриті вправи (тільки для використання вчителями) |
| - | [[Image:1236084776 kr.jpg|10x10px]] оцінювання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] оцінювання |
| | | | |
| | '''<u>Практика</u>''' | | '''<u>Практика</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] задачі та вправи,самоперевірка | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] задачі та вправи,самоперевірка |
| - | [[Image:1236084776 kr.jpg|10x10px]] практикуми, лабораторні, кейси | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] практикуми, лабораторні, кейси |
| - | [[Image:1236084776 kr.jpg|10x10px]] рівень складності задач: звичайний, високий, олімпійський | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] рівень складності задач: звичайний, високий, олімпійський |
| - | [[Image:1236084776 kr.jpg|10x10px]] домашнє завдання | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] домашнє завдання |
| | | | |
| | '''<u>Ілюстрації</u>''' | | '''<u>Ілюстрації</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа |
| - | [[Image:1236084776 kr.jpg|10x10px]] реферати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] реферати |
| - | [[Image:1236084776 kr.jpg|10x10px]] фішки для допитливих | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] фішки для допитливих |
| - | [[Image:1236084776 kr.jpg|10x10px]] шпаргалки | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] шпаргалки |
| - | [[Image:1236084776 kr.jpg|10x10px]] гумор, притчі, приколи, приказки, кросворди, цитати | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] гумор, притчі, приколи, приказки, кросворди, цитати |
| | | | |
| | '''<u>Доповнення</u>''' | | '''<u>Доповнення</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] зовнішнє незалежне тестування (ЗНТ) | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] зовнішнє незалежне тестування (ЗНТ) |
| - | [[Image:1236084776 kr.jpg|10x10px]] підручники основні і допоміжні | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] підручники основні і допоміжні |
| - | [[Image:1236084776 kr.jpg|10x10px]] тематичні свята, девізи | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] тематичні свята, девізи |
| - | [[Image:1236084776 kr.jpg|10x10px]] статті | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] статті |
| - | [[Image:1236084776 kr.jpg|10x10px]] національні особливості | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] національні особливості |
| - | [[Image:1236084776 kr.jpg|10x10px]] словник термінів | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] словник термінів |
| - | [[Image:1236084776 kr.jpg|10x10px]] інше | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] інше |
| | | | |
| | '''<u>Тільки для вчителів</u>''' | | '''<u>Тільки для вчителів</u>''' |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/Idealny_urok.html ідеальні уроки] |
| - | [[Image:1236084776 kr.jpg|10x10px]] календарний план на рік | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] календарний план на рік |
| - | [[Image:1236084776 kr.jpg|10x10px]] методичні рекомендації | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] методичні рекомендації |
| - | [[Image:1236084776 kr.jpg|10x10px]] програми | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] програми |
| - | [[Image:1236084776 kr.jpg|10x10px]] [http://xvatit.com/forum/ обговорення] | + | [[Image:1236084776 kr.jpg|10x10px|1236084776 kr.jpg]] [http://xvatit.com/forum/ обговорення] |
| | | | |
| | <br> | | <br> |
Текущая версия на 10:52, 18 июля 2012
Гіпермаркет Знань>>Хімія>>Хімія 9 клас>> Ступінь дисоціації. Сильні і слабкі електроліти
СТУПІНЬ ДИСОЦІАЦІЇ. СИЛЬНІ І СЛАБКІ ЕЛЕКТРОЛІТИ
Ступінь дисоціації. Сильні й слабкі електроліти
• Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Вивчаючи електролітичну дисоціацію, ми з'ясували, що це оборотний процес. Тобто поряд із розпадом кристалів або молекул на йони може відбуватися асоціація йонів. Адже гідратовані йони, які хаотично рухаються в розчині, можуть стикатися й знов сполучатися між собою. Наразі розгляньмо це питання докладніше. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.
Завдання
Оцініть доцільність доповнення схеми на малюнку 3.2 компонентом «йонно-молекулярні розчини».
Ступінь електролітичної дисоціації - це відношення числа молекул формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.
Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляємо «альфа»). її виражають у частках одиниці або у відсотках:
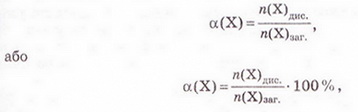
де n(Х) дис. - число формульних одиниць електроліту, які розпалися на йони, а n(Х)заг. - загальне число формульних одиниць електроліту.
Наприклад, якщо ступінь дисоціації фторидної кислоти дорівнює 30 %, або 0,3, це означає, що у водному розчині з кожних ста молекул кислоти тридцять розпалися на йони. Або з кожних десяти молекул кислоти три дисоціювали (мал. 11.1):
а(НF) = 0,3(30 %)
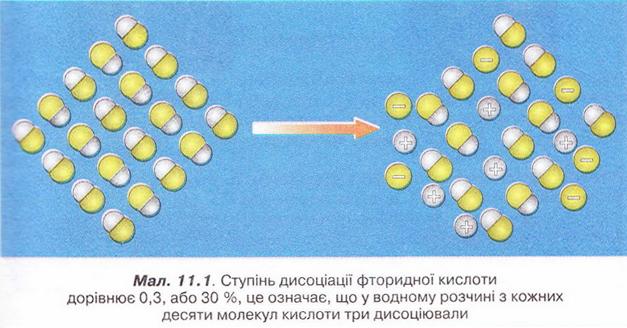
Завдання
1. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 100 молекул якої 15 розпалися на йони:
А 0,15; Б 115; В 0,015; Г 1,5.
2. Виберіть співвідношення кількості дисоційованих і недисоційованих молекул кислоти, ступінь дисоціації якої 0,2 (20 %):
А 1 : 5; Б 1 : 50; В 1 : 4; Г 1 : 8.
Ступінь дисоціації електролітів визначають експериментально. Він залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо. Чим більша полярність розчинника, тим більший ступінь дисоціації електроліту в ньому. Підвищення температури, як правило, збільшує дисоціацію, тож за нагрівання ступінь дисоціації зростає. У разі зменшення частки електроліту у розчині, тобто під час його розбавляння, ступінь дисоціації збільшується. Тож, зазначаючи ступінь дисоціації, слід зазначати й концентрацію розчину.
• Сильні й слабкі електроліти різняться здатністю дисоціювати у водних розчинах. Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. З класифікацією кислот на сильні и слабкі ви ознайомилися минулого року (див. схему).

Тепер вам зрозуміло, що критерієм цієї класифікації є ступінь електролітичної дисоціації кислот, тобто їхня приналежність до сильних чи слабких електролітів.
Пригадаймо, слабка карбонатна кислота міститься у газованих напоях (існує у вигляді гідрату С02 • Н20). Добре відомі вам з повсякденного
життя кислоти - молочна, оцтова, аскорбінова (вітамін С) й ацетил-саліцилова (аспірин) кислоти - слабкі електроліти. Сульфітна, сульфідна, силікатна кислоти (пригадайте їхні хімічні формули, за погреби зверніться до таблиці «Розчинність кислот, основ і солей у воді») також слабкі електроліти. Слабкими електролітами є й гідроксиди металічних елементів (за винятком лугів). Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 %.
Завдання
Роздивіться малюнок 11.2 й розташуйте зображені на ньому електроліти за зростанням їхньої сили.
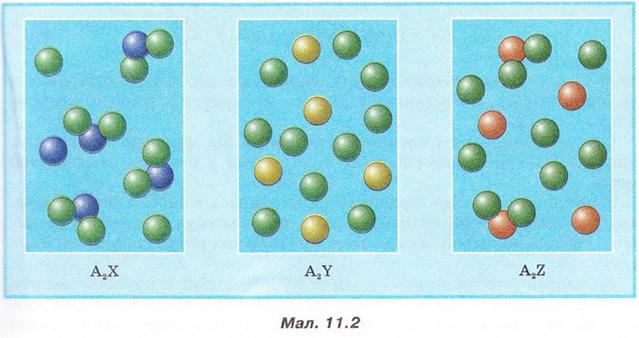
Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається де 0. Адже з кожного мільярда (1 000 000 000) молекул води на йони розгадаються лише дві. Вочевидь такої кількості йонів замало, аби забезпечити бодай трохи помітну електропровідність дистильованої води.
Стисло про головне
Ступінь дисоціації - кількісна характеристика, яку використовують для оцінювання здатності електролітів дисоціювати у водних розчинах на йони. Солі та луги - йонні речовини, тому у водних розчинах вони дисоціюють повністю. У розчинах кислот поряд з йонами є й недисоційовані молекули.
Ступінь електролітичної дисоціації - це відношення числа молекул (формульних одиниць), які розпалися на йони, до загального числа молекул (формульних одиниць) розчиненої речовини.
Ступінь дисоціації позначають літерою грецького алфавіту а (вимовляють «альфа»). Її виражають у частках одиниці або у відсотках:
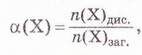
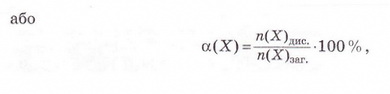
де n(X) дис. - кількість формульних одиниць електроліту, які розпалися на йони, а п(Х)заг. - загальна кількість формульних одиниць електроліту.
Ступінь дисоціації електролітів залежить від природи розчинника, природи розчинюваної речовини та її частки у розчині, температури тощо.
Електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1), називають сильними, а електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий, - слабкими.
Сильними електролітами є луги та чи не всі солі. У розбавлених розчинах сульфатна, нітратна, хлоридна, бромідна, йодидна кислоти також дисоціюють практично повністю. Силу кислот визначають за ступенем електролітичної дисоціації.
Карбонатна, сульфітна, сульфідна, силікатна, молочна, оцтова, аскорбінова (вітамін С) й ацетилсаліцилова (аспірин) кислоти, гідроксиди металічних елементів (за винятком лугів) - слабкі електроліти. Ступінь дисоціації слабких електролітів зазвичай не перевищує 3 % .
Вода - дуже слабкий електроліт. Ступінь її дисоціації наближається до 0.
Застосуйте свої знання й уміння
1. Виберіть правильне твердження. Ступінь електролітичної дисоціації - це відношення:
A Числа молекул, які розпалися на йони, до загального числа молекул розчиненої речовини;
Б Числа молекул, які розпалися на йони, до числа молекул, які не дисоціювали;
В Числа молекул у розчині до числа молекул, які дисоціювали;
Г Числа молекул, які не дисоціювали, до числа молекул, які розпалися на йони.
2. Виберіть з-поміж наведених значень ступінь дисоціації кислоти, з кожних 200 молекул якої 40 розпалися на йони:
А 0,2; Б 20; В 0,02; Г 2.
3. Виберіть співвідношення кількості недисоційованих і дисоційованих молекул кислоти, ступінь дисоціації якої 0,4 (40 %):
A3 : 2; Б2 : 3; В 2 : 5; Г5 : 2.
4. Виберіть слабкі електроліти: А HCl; Б H2S; В Н20; Г H2S04.
5. Виберіть сильну кислоту:
А Бромідна; Б Сульфідна; В Молочна; Г Силікатна.
6. У воді об'ємом 2 л розчинили кислоту кількістю 0,2 моль. Ступінь дисоціації кислоти 0,02. Визначте число її недисоційованих молекул у цьому розчині. Які дані у задачі зайві?
7.Встановіть відповідність між електролітами та ступенем дисоціації.
|
Електроліт
1 Сильний
2 Слабкий
|
Ступінь дисоціації
А а = 0
Б а → 1
В 0 < а < 0,03
|
8. Роздивіться малюнок 11.3 і визначте найсильнішу з-поміж зображених на ньому кислот.
9. Розв'яжіть кросворд, ключове слово якого по вертикалі - назва літери - позначення ступеня дисоціації. По горизонталі: 1. Найпоширеніший дуже слабкий електроліт. 2. Клас неорганічних сполук, здебільшого сильні електроліти. 3. Кількісна характеристика дисоціації електролітів. 4. Кислотний залишок слабкої галогеноводневої кислоти. 5. Слабка кислота із жарознижувальним ефектом.
Скарбничка досвіду
Використовуючи прилад для дослідження електропровідності рідин, дослідіть електропровідність дистильованої води та розчинів, які трапляються у побуті ( див.§ 9). З'ясуйте, чи залежить електропровідність розчину від частки розчинюваної речовини у ньому, температури тощо. Які речовини, що їх розчини було досліджено, виявилися сильними електролітами? За результатами дослідження підготуйте презентацію.
Г. А. Лашевська, Хімія, 9 клас
Вислано читачами з інтернет-сайтів
Збірка конспектів уроків по всім класами, домашня робота, скачати реферати з хімії, книги та підручники згідно каленадарного плануванння з хімії для 9 класу
Зміст уроку
 конспект уроку і опорний каркас конспект уроку і опорний каркас
 презентація уроку презентація уроку
 акселеративні методи та інтерактивні технології акселеративні методи та інтерактивні технології
 закриті вправи (тільки для використання вчителями) закриті вправи (тільки для використання вчителями)
 оцінювання
Практика оцінювання
Практика
 задачі та вправи,самоперевірка задачі та вправи,самоперевірка
 практикуми, лабораторні, кейси практикуми, лабораторні, кейси
 рівень складності задач: звичайний, високий, олімпійський рівень складності задач: звичайний, високий, олімпійський
 домашнє завдання
Ілюстрації домашнє завдання
Ілюстрації
 ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа ілюстрації: відеокліпи, аудіо, фотографії, графіки, таблиці, комікси, мультимедіа
 реферати реферати
 фішки для допитливих фішки для допитливих
 шпаргалки шпаргалки
 гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення гумор, притчі, приколи, приказки, кросворди, цитати
Доповнення
 зовнішнє незалежне тестування (ЗНТ) зовнішнє незалежне тестування (ЗНТ)
 підручники основні і допоміжні підручники основні і допоміжні
 тематичні свята, девізи тематичні свята, девізи
 статті статті
 національні особливості національні особливості
 словник термінів словник термінів
 інше
Тільки для вчителів інше
Тільки для вчителів
 ідеальні уроки ідеальні уроки
 календарний план на рік календарний план на рік
 методичні рекомендації методичні рекомендації
 програми програми
 обговорення обговорення
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь - Образовательный форум.
|